温室白粉虱SCAR分子鉴定技术的建立及应用
2012-06-09王金娜王相晶张友军王少丽
王金娜,王相晶,张友军,王少丽*
温室白粉虱Trialeurodes vaporariorum是世界范围的灾害性害虫,已报道的寄主植物超过900种(Kirk等,2000)。其以成虫和若虫吸取寄主植物汁液,使叶片褪色、变黄、萎蔫,并分泌大量蜜露,污染果实和叶片;更为重要的是传播植物病毒病,如黄瓜黄化、番茄褪绿等,严重时可引起叶片干枯、植株死亡等。自20世纪70年代中期该虫在我国北方地区爆发危害以来,一直是我国北方地区的主要害虫 (朱国仁等,2006)。近几十年来,北方地区菜田生态系统发生了深刻变化,特别是加温温室和塑料大棚蔬菜生产的迅速发展,为该害虫提供了冬季繁衍的良好环境,形成虫源基地,使得原本在露地不能越冬的害虫有了大发生的可能;温室、大棚和露地蔬菜生产紧密衔接、相互交错,使温室白粉虱种群得以繁衍和周年发生,危害加重,在大型连栋温室果菜上常猖獗成灾。目前温室白粉虱仍是我国北方蔬菜生产的重要限制因子之一 (时玉娟等,2011)。
在我国北方地区,温室白粉虱和烟粉虱Bemisia tabaci寄主重叠、危害习性相似,生活史相近,且同域混合发生,体型微小、外形相似而难以区分。虽然有文献提出其外部形态或显微镜检识别特征 (朱国仁等,2006;褚栋等,2008),但是这两种害虫的外部形态上的快速区分对于非粉虱研究专业人士来说仍旧比较困难,而且由于粉虱类害虫的形态特征常因环境条件、寄主植物差异等存在变异,尤其是异地采集保存在酒精中的粉虱类害虫或者是保存不完整的标本等,采用上面两种方法根本无法鉴别。而DNA鉴定技术相对快速、准确,对于样品的保存相对简单,且与样本的完整性与否无关,因此,很有必要发展其快速DNA鉴定技术。
随着分子生物学的发展,近年来分子生物学技术发展迅速,利用分子标记技术只需要少量的DNA就可以快速准确地鉴定出昆虫种类,该类技术不仅可以检测成虫,对其它各虫态亦具有同样的检测效能。以前有研究者采用扩增测序mtCOI序列或者ITS2序列,并与已登录在GenBank上的该基因序列一起构建聚类树,由聚类分析得知分析样本与已知序列之间的亲缘关系远近,进而推断出该基因的所属种类 (Hinomoto et al.,2007;Ben-David et al.,2007;Ma et al.,2009;Liu et al.,2011)。但是该技术需要标本在PCR扩增之后进行回收、克隆和测序,这样会耗费大量的财力和劳力。限制性片段长度多态性 (Restriction fragment length polymorphism,简称RFLP)和单链构象多态性 (Single-Stranded Confirmation Polymorphisms,简称SSCP)等技术也通常被用来进行昆虫种类的分子鉴定,但是其过程复杂,需要酶切、扩增或者扩增、聚丙烯酰胺凝胶电泳结合银染方法等,需要花费较长时间,费时费力。还有研究者扩增ITS区域片段结合限制性内切酶位点,根据酶切片段长短来判断种的差异 (Ma et al.,2009;Jeong et al.,2010),但此种方法尚需要两个操作步骤,且酶切结果受到多种因素影响而易出现切不开或者由于扩增错配导致的酶切位点改变等现象。特征序列扩增区域 (Sequence Characterized Amplified Regions,简称SCAR)标记技术是通过随机扩增多态性DNA(Random Amplified Polymorphic DNA,RAPD)技术筛选出靶标种特异片段,然后将目标RAPD片段进行克隆和测序,并根据此目标片段两端的碱基序列设计特异性引物;然后以该对特异性引物对基因组DNA片段再次进行PCR扩增,进而将与原RAPD片段相对应的单一位点鉴别出来;SCAR标记为共显性遗传,待检DNA样品间的差异可通过扩增产物的有和无来显示 (黎裕等,1999;Gupta et al.,2010)。与上述其它分子标记方法相比,具有操作简便、灵敏度高等优点,可用于样品的大规模检测。
本研究通过对不同粉虱类害虫的RAPD扩增,找到温室白粉虱的特异性扩增条带,进而转化为稳定的SCAR标记,来进行温室白粉虱的鉴定识别。同时,采用建立的该SCAR标记检测鉴定了采自田间不同省份的温室白粉虱样品。研究结果可为快速识别鉴定温室白粉虱提供一种简单的方法,同时对于其田间该虫的针对性防治具有重要意义。
1 材料与方法
1.1 试虫
本研究中的温室白粉虱试虫由中国农业科学院植物保护研究所张桂芬研究员提供,寄主植物为甘蓝。B型烟粉虱和Q型烟粉虱饲养于本课题组,寄主植物分别为甘蓝和棉花,期间不接触任何化学药剂。其他作为对照的试虫样品分别采集于田间,柑绿粉虱2011年10月份采集于中国农业科学院院内菊花寄主上;螺旋粉虱和黑刺粉虱于2011年10月分别采集于海南儋州的番石榴寄主和海口大坡镇福昌村的酸桔寄主上;ZJ-2型烟粉虱室内酒精保存样品由中国农业科学院植物保护研究所张桂芬研究员提供。
供试的田间温室白粉虱种群分别采自云南、山西、山东、吉林、甘肃和青海地区的蔬菜作物上。该试虫标本在室内首先采用形态鉴定法 (朱国仁等,2006)和复眼镜检法 (褚栋等,2008)鉴别为温室白粉虱种群,然后用于本研究中SCAR分子标记的检测。
1.2 供试试剂
随机引物采用Operon公司的RAPD通用引物系列,分别为OPA、OPB、OPC系列,每个系列分别包含20条引物。随机引物和特异性引物分别由上海英竣生物工程公司合成和北京擎科生物工程公司合成。DNA序列测序委托北京擎科生物工程有限公司进行。PCR扩增中使用的聚合酶为2×Taq10 Master Mix(0.1U TaqE/μL),购自北京奥赛博科技发展有限公司。试虫的基因组DNA提取试剂盒和克隆试剂盒分别购自北京百泰克生物技术有限公司和北京全式金生物技术有限公司。DNA标准Marker购自北京全式金生物技术有限公司。
1.3 单头粉虱成虫DNA提取
基因组DNA的提取采用DNA提取试剂盒(溶液型)(百泰克,北京)进行,按照试剂盒说明书进行,稍有改动。具体操作如下:(1)将单头烟粉虱置于滴有10 μL裂解液中的Parafilm膜上,以0.2 mL的PCR管底部作为匀浆器充分研磨,用另20 μL的裂解液清洗匀浆器2次,合并混匀;(2)以微量移液器移入1.5 mL离心管内,加入2 μL蛋白酶K,混匀,55℃下水浴4 h或者过夜;(3)离心几秒钟,加入2.5 μL RNase,置于37℃烘箱15~30 min;(4)取出上述样品,晾至室温,加入蛋白沉淀液25 μL,漩涡振荡器上高速震荡25 s;(5)冰浴5 min,沉淀蛋白;室温下13000 r/min离心5 min;小心吸取上清液到另一个新管中 (不要吸入沉淀);(6)加入等体积的异丙醇50 μL,颠倒混匀30次;(7)室温下12000 r/min离心10 min,弃上清,加入1 mL 70%乙醇颠倒漂洗DNA沉淀,室温下12000 r/min离心2 min,弃上清;(8)加入1 mL无水乙醇颠倒漂洗DNA沉淀,室温下12000 r/min离心2 min,弃上清;(9)加入20 μL DNA溶解液,65℃下水浴60 min,溶解DNA,然后置-20℃保存备用。
1.4 RAPD扩增
以上述基因组DNA为模板,采用60条随机引物分别进行随机扩增,记录筛选出来的特异条带以及相应扩增引物,并对这些条带进行标记。扩增总体积为 20 μL,包含 10 μL 2 ×Taq10 Master Mix、1 μLDNA 模板、3 μL RAPD 引物 (10 mM)和6 μL ddH2O。PCR反应程序为:首先进行94℃预变性4 min,之后进行40个循环,包括94℃变性1 min,37℃退火 50 s,72℃延伸 95 s,最后72℃延伸10 min。扩增反应在Biorad S-1000扩增仪上进行。程序结束后,分别取6 μL各样品的PCR扩增产物,在1%琼脂糖凝胶上电泳,并在凝胶成像系统 (Biorad)上分析电泳结果。
1.5 特异性扩增产物的回收克隆
对RAPD扩增结果中发现温室白粉虱样品中的特异性条带进行标记。在琼脂糖凝胶电泳上回收该特异性条带,采用DNA纯化试剂盒 (百泰克,北京)进行纯化,把该纯化片段连接到pEASY-T1载体上,转化到TOP10感受态细胞上,37℃条件下倒置培养过夜,挑取白色克隆,接入LB液体培养基中37℃过夜振荡培养,最后采用质粒提取试剂盒提取质粒,采用通用引物M13正向和反向引物扩增验证后,阳性质粒送交北京擎科生物工程有限公司进行测序。
1.6 SCAR引物设计及PCR扩增
基于特异性片段的序列测定结果,采用Primer 5软件设计一对SCAR特异性引物 (Tv-F和Tv-R)。PCR反应体系设定为20 μL,其中2×Taq10 Master Mix为10 μL,上游引物和下游引物分别为1 μL,DNA 模板为 1 μL,ddH2O 为 7 μL。SCAR-PCR反应程序如下:94℃预变性3 min,之后进行35个循环 (94℃变性1 min,59℃退火45 s,72℃延伸1.5 min),最后72℃延伸10 min。扩增产物的检测方法同1.4所述。
1.7 SCAR引物的特异性和灵敏性检验
采用B型烟粉虱、Q型烟粉虱、黑刺粉虱、螺旋粉虱、柑橘粉虱及ZJ-2型烟粉虱作为对照种,通过上述SCAR扩增程序来验证温室白粉虱该引物对的特异性。同时,将单头温室白粉虱成虫的基因组DNA提取之后,采用ND-2000C测定基因组DNA的浓度,然后对该DNA依次进行10倍梯度稀释,以不同浓度 DNA为模板,检验该SCAR引物扩增的灵敏性。每个浓度分别检测10头个体。
1.8 SCAR引物对田间种群的验证
对2011年度采集自云南、山西、山东、吉林、甘肃、青海6个地区的粉虱类害虫,采用形态法、复眼镜法 (褚栋等,2008)鉴定为温室白粉虱种群。采用设计的SCAR引物对这些种群的DNA模板进行PCR扩增,验证引物对扩增田间种群的特异性。
2 结果与分析
2.1 RAPD扩增及SCAR引物设计
在60条引物的RAPD随机扩增中,引物OPA-17对温室白粉虱表现出很强的种的特异性,一条600 bp左右的DNA条带在温室白粉虱的DNA扩增的凝胶图谱中出现,且该特异性条带很亮,且在检测的24头不同个体中均稳定出现,重复性强,而在其他烟粉虱生物型或者其它粉虱种类中均未出现。图1显示了OPA-17对温室白粉虱、B型烟粉虱和Q型烟粉虱的随机扩增图谱。

图1 引物OPA-17对不同粉虱类害虫的RAPD扩增图谱Fig.1 RAPD amplification profiles of the different whitefly species with primer OPA-17
将温室白粉虱的特异性序列进行回收、克隆后进行序列测定。序列测定结果表明温室白粉虱的特异性扩增片段长度为620 bp,GenBank登录号为JQ690764。该基因序列在NCBI上进行BLAST比对,未发现任何和该基因片段具有较高相似性的序列,说明该片段特异性很强。根据此测序结果,设计一对SCAR引物,上游和下游引物序列分别为:Tv-F(5'-TGA CCC ACA GAC AGA GTA-3')和 Tv-R(5'-CGA AAT CGC TGA CTA AAT-3'),预期扩增片段大小为412 bp。
2.2 SCAR引物特异性和灵敏度检验
采用我们设计的特异性SCAR引物对温室白粉虱种群进行PCR扩增,同时以其它烟粉虱不同生物型或者其它粉虱种类作为对照种群,发现仅在温室白粉虱中出现了一条412 bp的特异性条带,而在作为对照的其它粉虱种类或烟粉虱生物型中均未出现任何条带 (图2),随后我们对该条带回收克隆测序,发现与由RAPD扩增到的特异性条带中的对应片段序列完全一致。经ND-2000C测定,提取的单头温室白粉虱成虫的基因组DNA浓度为5.3 ng/μL,依次进行10倍梯度稀释之后,发现DNA模板稀释103倍时,仍可观察到清晰的条带,稀释104~106倍时仍可观察到扩增条带,但很微弱,稀释107倍时完全不能扩增到预期条带(图3),表明该SCAR引物对具有很高的扩增灵敏度,可以从皮克级浓度的基因组DNA中扩增到预期条带。

图2 SCAR引物对温室白粉虱及近缘种属粉虱的SCAR-PCR扩增结果Fig.2 Amplification results of Trialeurodes vaporariorum and its related species using SCAR primers
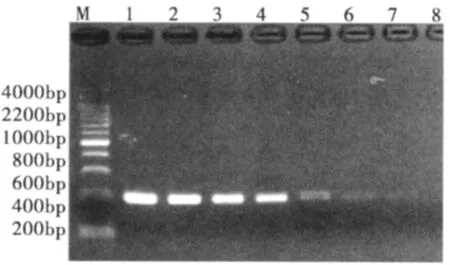
图3 SCAR引物对单头温室白粉虱成虫DNA及其不同浓度下扩增结果Fig.3 Amplification results of single genomic DNA of Trialeurodes vaporariorum adult with different concentration
2.3 SCAR引物扩增田间温室白粉虱种群的特异性检验
为了验证该SACR引物对温室白粉虱田间种群鉴定的特异性和有效性,我们对采自云南、山西、山东、吉林、甘肃和青海田间的温室白粉虱种群进行SCAR扩增检验,结果表明在上述各地区的每头成虫试虫中均出现了预期的412 bp的DNA片段,而水为模板的阴性对照中无任何条带 (图4),说明所设计的温室白粉虱SCAR引物对于田间种群同样具有很强的扩增有效性,可用于田间种群的验证和检测。
3 结论与讨论
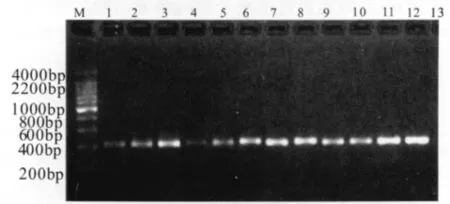
图4 温室白粉虱SCAR引物对田间不同地区温室白粉虱种群的扩增结果Fig.4 Amplification patterns of Trialeurodes vaporariorumcollected from different regions using SCAR primers
温室白粉虱与烟粉虱都是世界范围的灾害性害虫,但由于两种粉虱类害虫的外形极为相似,寄主重叠、危害习性相似,生活史相近,且同域混合发生,随着田间烟粉虱生物型逐渐由B型转变为Q型为主,而烟粉虱的耐药性远高于温室白粉虱,因此明确二者在田间混合发生时的优势种类对于害虫的针对性防治具有重要的意义。随着分子生物学发展,害虫不同种类的分子鉴定技术日益得到关注和发展。由RAPD扩增出的特异性条带转化而来的SCAR标记是一种十分稳定的分子标记,在应用上具有操作简便快捷,结果可靠稳定性高且价格低廉等特点 (Kiran et al.,2010;Gupta et al.,2010;Cirillo et al.,2012)。近年来该项技术不断被应用于农业重要害虫种的特异性检测中 (孟祥钦等,2010;张桂芬等,2010;Kang et al.,2012;Zhao and Wu,2012)。
本研究筛选出来的温室白粉虱的SCAR分子标记特异性很强,可以将温室白粉虱与我国常见的其他粉虱种类区分开来,如B型烟粉虱、Q型烟粉虱、浙江土著烟粉虱、黑刺粉虱、螺旋粉虱和桔绿粉虱等 (图2)。而且,该SCAR标记的灵敏度高,可以在单头温室白粉虱成虫的基因组DNA浓度为5.3 ng/μL时稀释1000倍后进行PCR扩增,仍能成功检出很强的、单一的预期特异性条带 (图3),说明该SCAR引物可成功地从皮克级别的DNA样品中检测出温室白粉虱的存在,这样,在所采集样品缺乏完整性或者少量存在时,也具有检测的可行性,尤其是对于筛选可以捕食温室白粉虱的天敌昆虫时具有更重要的意义。同时,本研究中设计的SCAR标记对于检测室内及田间的温室白粉虱种群均表现出很强的特异性和适用性(图4),因此可直接用于田间温室白粉虱种群的检测。虽然褚栋等 (2004)提出一种用重复序列扩增转化而来的SCAR标记,用于鉴别烟粉虱和温室白粉虱,但文中采用的是试虫群体DNA模板的提取和检测方法,而且当时我国仅在云南地区刚发现Q型烟粉虱出现 (褚栋等,2005),其余省市田间与温室白粉虱同域发生的烟粉虱生物型均为B型。而目前,国内大部分地区Q型烟粉虱已取代B型烟粉虱,成为国内的主要的为害生物型 (潘慧鹏等,2010;Pan et al.,2011),已有文献中建立的SCAR分子标记及烟粉虱其他生物学鉴定方法对于B型烟粉虱以外的其它不同生物型及其它近缘的不同粉虱类害虫的特异性和灵敏度尚不得而知,而本研究结果全面有效地补充了上述研究中存在的缺陷和不足,且在不同地区的田间种群中全部得到了验证,稳定性很强。
本研究中设计的SCAR引物分析谱带单一,特异性强,价格低廉,操作简单,非专业人士也便于操作,对于样品的保存及完整性要求不高,非常适宜应用于定性检测,该技术体系的建立,对温室白粉虱的快速识别、及时检测与监测、针对性治理及对可能发生的外来入侵性烟粉虱害虫的及时预警和发现等均具有重要意义。然而,实际检测验证过程中所涉及的烟粉虱种类较多,该SCAR引物对国外的粉虱类害虫的特异性还有待于进一步验证。孟祥钦等 (2010)筛选出一对西花蓟马的特异性SCAR分子标记,该对引物不仅对不同虫态的西花蓟马具有扩增能力,而且在西花蓟马的寄主植物组织内亦能检测到了其卵的存在,而粉虱类害虫把卵也产在叶片组织内,该SCAR特异性引物由于其较高的扩增灵敏性,因此也可能对温室白粉虱的不同虫态、寄主植物组织以及捕食该粉虱害虫的天敌昆虫具有特异性检测能力,但这需要进一步的试验验证。
References)
Alessandra C,Stefania DG,Giovanni DB,Giovanni G,Umberto G,Marilena C,2012.A new SCAR marker potentially useful to distinguish Italian cattle breeds.Food Chemistry,130(1):172-176.
Ben-David T,Melamed S,Gerson U,Morin S,2007.ITS2 sequences as barcodes for identifying and analyzing spider mites(Acari:Tetranychidae).Experimental and Applied Acarology,41:169-181.
Chu D,Wang B,Zhang SH,Tao YL,Liu GX,2008.Rapid differentiation between Bemisia tabaci and Trialeurodes vaporariorum adults by microscopie examination of compound eyes.Entomological Knowledge,45(1):154-155.[褚栋,王斌,张四海,陶云荔,刘国霞,2008.一种快速鉴别烟粉虱与温室白粉虱成虫的方法-复眼镜检法.昆虫知识,45(1):154-155]
Chu D,Zhang YJ,Cong B,Xu BY,Wu QJ,2004.Developing sequence characterized amplified regions(SCARs)to identify Bemisia tabaci and Trialeurodes vaporariorum.Plant Protection,(6):27-30.[褚栋,张友军,丛斌,徐宝云,吴青君,2004.SCAR分子标记鉴别烟粉虱和温室白粉虱.植物保护,(6):27-30]
Chu D,Zhang YJ,Cong B,Xu BY,Wu QJ,2005.Identification for Yunnan Q-biotype Bemisia tabaci population.Entomological Knowledge,42:54-56.[褚栋,张友军,丛斌,徐宝云,吴青君,2005.云南Q型烟粉虱种群的鉴定.昆虫知识,42:54-56]
Cirillo A,Del Gaudio S,Di Bernardo G,Galano G,Galderisi U,Cipollaro M,2012.A new SCAR marker potentially useful to distinguish Italian cattle breeds.Food Chemistry,130(1):172-176.
Gupta VK,Sharma R,Jindal V,Dilawari VK,2010.SCAR marker for identification of host plant specific in whitefly,Bemisia tabaci(Genn.).India Journal of Biotechnology,9(4):360-366.
Hinomoto N,Tran DP,Pham AT,Le TBN,Tajima R,Ohashi K,Osakabe MH,Takafuji A,2007.Identification of spider mites(Acari:Tetranychidae)by DNA sequences:a case study in northern Vietnam.International Journal of Acarology,33(1):53-60.
Jeong G,Kim H,Choi Y,Kim W,Park K,Bae S,Kim J,Choi J,2010.Molecular identification of two Trichogramma species(Hymenoptera:Trichogrammatidae)in Korea.Journal of Asia-Pacific Entomology,13(1):41-44.
Kang SY,Kim YH,Lee HJ,Kim BJ,Lim KJ,Lee SH,2012.Onestep identification of B and Q biotypes of Bemisia tabaci based on intron variation of carboxylesterase 2.Journal of Asia-Pacific Entomology,doi:10.1016/j.aspen.
Kiran U,Khan S,Mirza KJ,Ram M,Abdin MZ,2010.SCAR markers:A potential tool for authentication of herbaldrugs.Fitoterapia,81(8):969-976.
Kirk AA,Lacey LA,Brown JK,Ciomperlik MA,Goolsby JA,Vacek DC,Wendel LE,2000.Napompeth B.variation in the Bemisia tabaci s.1.species complex(Hemiptera:Aleyrodidae)and its natural enemies leading to successful biological control of Bemisia biotype B in the USA.Bulletin of Entomological Research,90:317-327.
Li Y,Jia JZ,Wang TY,1999.Types of molecular markers and their development.Biotechnology Information,15(4):19-22.[黎裕,贾继增,王天宇,1999.分子标记的种类及其发展.生物技术通报,15(4):19-22]
Liu QL,Cai JF,Chang YF,Gu Y,Guo YD,Wang XH,Weng JF,Zhong M,Wang X,Yang L,Wu KL,Lan LM,Wang JF,Chen YQ,2011.Identification of forensically important blow fly species(Diptera:Calliphoridae)in China by mitochondrial cytochrome oxidase I gene differentiation.Insect Science,18(5):554 -564.
Ma WH,Li XC,Timothy JD,Lei CL,Wang M,Benjamin AD,Robert LN,2009.Utility of mtCOI polymerase chain reaction-restriction fragment length polymorphism in differentiating between Q and B whitefly Bemisia tabaci biotypes,Insect Science,16(2):107-114.
Meng XX,Min L,Wan FH,Zhou ZS,Wang WK,Zhang GF,2010.SCAR marker for rapid identification of the western flower thrips,Frankliniella occidentalis(Pergande)(Thysanoptera:Thripidae).Acta Entomologica Sinica,53(3):323-330.[孟祥钦,闵亮,万方浩,周忠实,王文凯,张桂芬,2010.西花蓟马的SCAR分子检测技术.昆虫学报,53(3):323-330]
Pan HP,Chu D,Ge DQ,Wang SL,Wu QJ,Xie W,Jiao XG,Liu BM,Yang X,Yang NN,Su Q,Xu BY,Zhang YJ,2011.Further spread of and domination by Bemisia tabaci(Hemiptera:Aleyrodidae)biotype Q on field crops in China.Journal of Economic Entomology,104(3):978-985.
Pan HP,Ge DQ,Wang SL,Wu QJ,Xu BY,Xie W,Zhang YJ,2010.Replacement of B biotype Bemisia tabaci by Q biotype B.tabaci in some areas of Beijing and Hebei.Plant Protection,36(6):40-44.[潘慧鹏,戈大庆,王少丽,吴青君,徐宝云,谢文,张友军,2010.在北京和河北局部地区Q型烟粉虱取代了B型烟粉虱.植物保护,36(6):40-44]
Shi YJ,Zhang MX,Liu JE,Li XY,2011.Studies of non-polluted control technology for Trialeurodes vaporariorum on tomato in protected field in Rizhao city.China Fruit and Vegetable,(2):26-28.[时玉娟,张明欣,刘加娥,李晓英,2011.日照市保护地番茄温室白粉虱无公害防治技术研究.中国果菜,(2):26-28]
Zhao YE,Wu LP,2012.RAPD-SCAR marker and genetic relationship analysis of three Demodex species(Acari:Demodicidae).Parasitol Res.,110(6):2395-402.
Zhang GF,Wu X,Guo JY,Liu WX,Peng ZQ,Wan FH,2010.Establishment and application of a SCAR marker for rapid diagnosis of the spiraling whitefly,Aleurodicus dispersus Russell.Acta Phytophylacica Sinica,37(5):385-390.[张桂芬,吴霞,郭建英,刘万学,彭正强,万方浩,2010.螺旋粉虱SCAR标记的建立与应用.植物保护学报,37(5):385-390]
Zhu GR,Wu QJ,Zhang YJ,Xu BY,2006.Identification and control of two kinds of whiteflies on vegetables.China vegetables,(6):49-51.[朱国仁,吴青君,张友军,徐宝云,2006.蔬菜上两种粉虱的识别与防治.中国蔬菜,(6):49-51]
