奶酪中产杆菌样细菌素乳酸菌的分离与鉴定
2012-06-08周瑶王颖安宇姚笛张红
周瑶 ,王颖 ,安宇 ,姚笛 ,张红
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江八一农垦大学生命科技学院)
细菌素,是通常由质粒编码的某些细菌分泌的肽抗生素,吸附于敏感菌细胞的表面特异受体。这种短肽是先天免疫的重要防御物质,其作用机制或是通道形成穿膜蛋白,使膜去极化;或是DNA酶或RNA酶的抑制剂。其具有广谱抗菌活性和抗病毒、抗真菌、抗寄生虫及抗肿瘤等生物活性,且不易产生抗药性,是生物天然的、非特异性防御系统的重要组成部分[1]。但这类拮抗物在分子量、理化特征、敏感度及作用途径差异很大。国外对乳酸菌素的研究较早,目前最彻底、应用最广的细菌素当属由各种乳酸乳球菌产生的乳链菌肽(Nisin),是唯一被允许作为防腐剂在食品中使用的[2];国内对乳酸菌素的研究起始于1980年末,中科院微生物所率先分离和筛选出产生Nisin Z的乳酸链球菌菌株,抑菌谱更加广泛。据报道,奶酪中的细菌素对大肠杆菌,金黄色葡萄球菌等病原菌均有强烈的抑制作用[3],所以对奶酪中产细菌素乳酸菌的生理生化特性研究有着深远的社会与经济意义。本文对内蒙古奶酪中分泌细菌素的乳酸杆菌进行传统的微生物方法的分离和鉴定。
1 材料与方法
1.1 实验材料
1.1.1 实验原料
内蒙古传统发酵奶酪(市场购买)。
指示菌:金黄色葡萄球菌、致病性大肠杆菌、单增李斯特杆菌、志贺(氏)、铜绿假单孢杆菌、蜡样杆菌、黑曲霉、青霉(实验室保存);抑菌活性指示菌为单核细胞增生李斯特菌和致病性大肠杆菌。
1.1.2 实验试剂
蛋白酶K和H2O2酶(广州杰诺生物酶公司);碳酸钙、柠檬酸铵、NaCl和葡萄糖(天津大茂化学试剂厂);MRS培养基、蛋白胨培养基和LB培养基(北京陆桥技术有限公司)。
1.1.3 实验设备
生化培养箱、电热恒温水锅、电热恒温培养箱、电热恒温鼓风干燥箱和台式多管架离心机(上海森信实验仪器有限公司),pH计和电子天平(上海梅特勒-托利多仪器有限公司),旋转蒸发器(上海亚荣生化仪器厂)。
1.2 方法
1.2.1 分离产细菌素的乳酸菌
1.2.1.1 制备奶酪发酵液
将内蒙古奶酪和生理盐水按照1∶50的比例在25℃下震荡培养24 h,活化3次,取最后一次备用。吸取梯度稀释至10-5的发酵液1mL,均匀涂布在MRS培养基上,37℃下培养72 h。挑取优势菌落培养,染色镜检观察,确定菌落形态和特征[4]。
1.2.1.2 发酵代谢物的鉴定
细菌素抗菌活性的检测采用牛津杯法[5]。
(1)有机酸的排除实验 为了排除发酵液代谢过程中产生的乳酸、乙酸等有机酸的干扰,将培养好的发酵液离心后获得无细胞发酵上清液,将此上清液的pH值调为5.0与发酵液相同pH值的乳酸、乙酸为对照,采用牛津杯琼脂扩散法测定抑菌活性,结果见表1。
(2)H2O2的排除实验 取分离菌发酵液0.5mL,加入 9 mg·mL-1H2O2酶 0.5mL,35 ℃处理 1.5 h,以未处理的发酵液为对照,测定抑菌活性的变化情况。
(3)蛋白类抑菌物质的确定 将产细菌素菌株的无细胞发酵液pH值调至中性后,按1 mg·mL-1加入蛋白酶K混匀,37℃反应3 h然后与未经处理的发酵液(对照)一起做抑菌实验,测定抑菌活性的变化情况。
1.2.2 鉴定产细菌素的乳酸菌的抑菌效果
1.2.2.1 产细菌素乳酸菌发酵液的制备
离心处理发酵液,3000 rpm 15min,取上清备用。排除有机酸和H2O2的干扰加入60%(NH4)2SO4盐析,4℃沉淀12 h后,5000 rpm 20min,用原体积1/10的蒸馏水溶解蛋白质沉淀制成发酵液。
1.2.2.2 确定发酵物的抑菌谱
取发酵上清液,采用牛津杯法对指示菌做抑菌实验。利用平板划线2%CaCO3的MRS琼脂培养基,从奶酪发酵液中分离得到G+,接触酶阴性的,并使石蕊牛奶凝乳的乳酸菌4株,以大肠杆菌和单核细胞假单增生李斯特作为敏感指示菌,经纸片法测定4株疑似菌株的抑菌结果见图1和2。由图可知G2菌株的抑菌活性较高,所以只选用G2分别测定对嗜热链球菌、大肠杆菌、单细胞增生李斯特菌、枯草芽孢杆菌、金黄色葡萄球菌、费氏志贺氏菌(微生物实验室保藏,分别标示为1~6)的抑菌活性,结果见图3。
1.2.3 测定分离菌株的生理生化特性
对分离到的菌株进行常规的生理生化特性的测定以及温度适应性和耐盐性的确定[6-9]。
2 结果与分析
2.1 抑菌效果的鉴定
由图1和2可知G2菌株的抑菌活性较高,所以只选用G2分别测定对6种指示菌的抑菌活性,结果显示G2对单细胞增生李斯特菌最敏感,然后为金黄色葡萄球菌,对嗜热链球菌、大肠杆菌和费氏志贺氏菌敏感度相当,对枯草芽孢杆菌最不敏感。
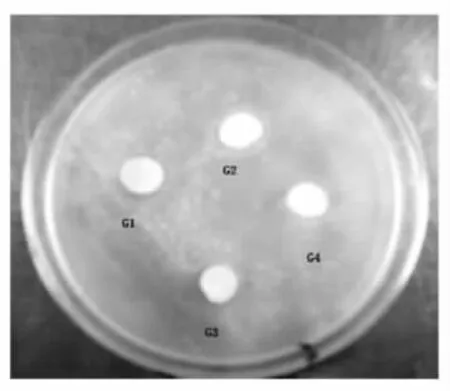
图1 G2菌对大肠杆菌的抑菌效果Fig.1 The antibacterial result of G2 to E coli
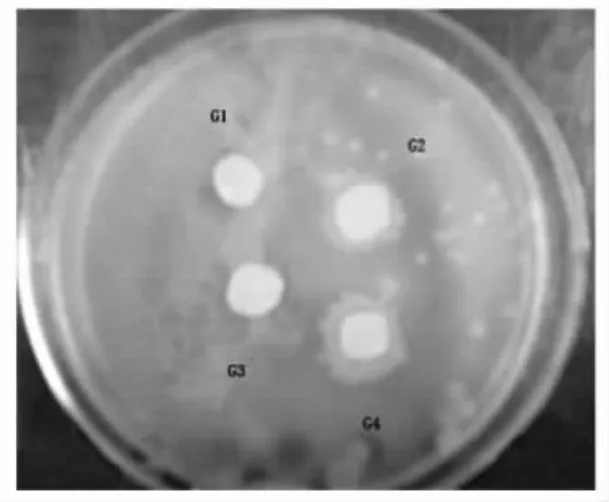
图2 G2菌对单增李斯特菌的抑菌效果Fig.2 The antibacterial result of G2 to Mono Listeria
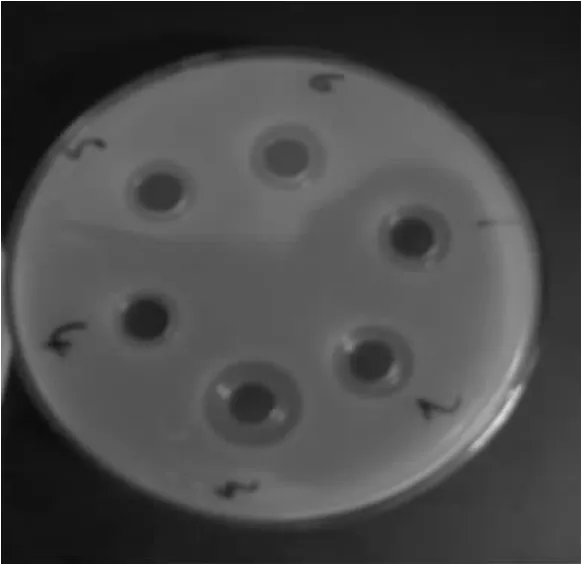
图3 G2对六种菌的抑菌活性Fig.3 The antibacterial activity of G2 to six kinds of bacteria
2.2 分离菌的形态及初步鉴定
2.2.1 发酵菌株的形态确定
在MRS平板上培养48 h后菌落特征和菌体形态(图4和图5)。菌落直径1~3 mm,不形成孢子。菌体卵球形,单个,成对或无鞭毛,圆形乳白色,表面光滑。短链状,不运动,G+。

图4 G2菌株的菌体特征(10×100倍)Fig.4 The Bacterial characteristics of G2
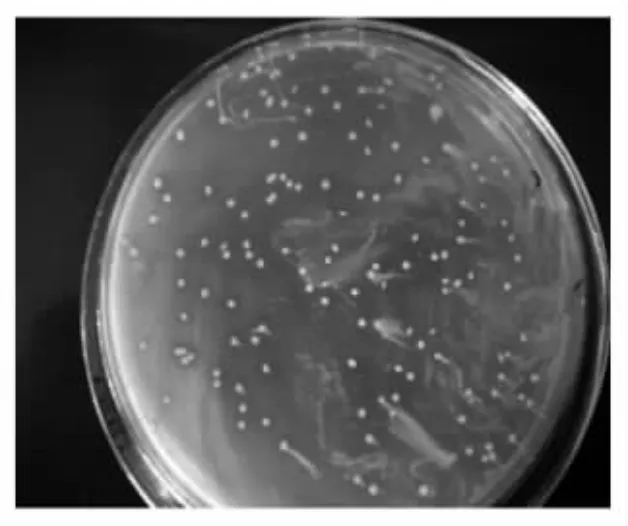
图5 G2的菌落形态Fig.5 The colonial morphology of G2
2.2.2 发酵液中抑菌物质的确定
采用牛津杯琼脂扩散法测定抑菌活性的结果见表1。由表1可知,同为pH值5.0的乳酸和乙酸对大肠杆菌和单增李斯特菌无抑制作用,而奶酪发酵液抑制作用显著,可推断抑菌效果与有机酸无关。另一方面,H2O2是乳酸菌的代谢副产物,也可抑制微生物的生长发育,添加H2O2酶可以消除H2O2的抑制作用,结果显示与H2O2无直接相关性。最后,按1 mg·mL-1的浓度在调至中性的产细菌素菌株的无细胞发酵液中加入蛋白酶K,搅拌均匀后38℃反应3 h,阴性发酵液对照做抑菌实验,实验数据表明蛋白酶K处理的菌株发酵液,抑菌活性下降显著,证明其抑菌作用的主要成分是蛋白质类。
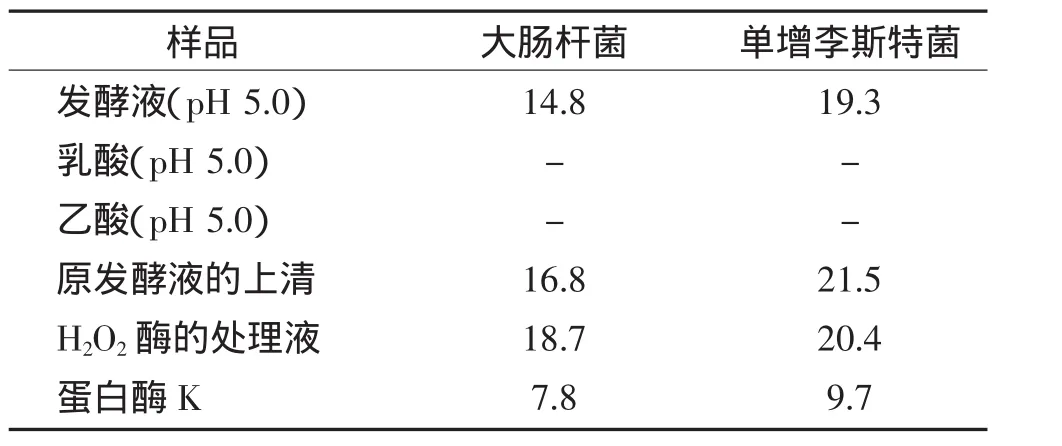
表1 不同处理对抑菌活性的影响Table 1 Effect of different treatment on antibacterial activity
2.3 细菌素抑菌谱的确定
细菌素抑菌谱结果如表2,可以看出分离菌株所产细菌素对酵母和霉菌没有抑制作用,对其他污染菌均有不同程度的抑制作用。

表2 G2菌株抑菌谱测定结果Table 2 The antibacterial spectrum of the separated strains
2.4 分离菌菌种的生理生化鉴定
综合形态观察和生理生化实验鉴定[6],根据《伯杰细菌鉴定手册》及《乳酸菌分类鉴定及实验技术》[7-8],进一步判断其为保加利亚乳杆菌。

表3 G2菌株生理生化鉴定结果Table 3 The biochemical identification results of Lactic acid bacteria G2 strain
3 结论
鉴定菌种程序中传统的理化试验是基本,本试验即基于常规抗菌谱测定、菌落形态与特征和生理生化实验鉴定等方法,从内蒙古奶酪中分离的1株乳酸杆菌。鉴于每一种细菌的种内和株间也可能存在性状和生化反应的突变和特异,紧靠表型试验的常规技术对菌株做出准确的鉴定的方法也可能存在缺陷和不足,所以本实验的抑菌活性的测定中,采用多种方法相结合来确定细菌素的主要成分,基本能够确定分泌的细菌素是蛋白质。
关于细菌素的理化特征的深入研究,对碳源、氮源、无机盐等培养基主要成分对细菌素产量的影响的观测不能忽视,同时应该结合对新发现菌株和原产于诱变后的高产菌株的进一步筛选与鉴定,另外,对于已知细菌素遗传基因、结构基因和功能基因的鉴定与克隆,进而对乳酸菌分泌的细菌素在遗传特性及功能调控等继续深入,对于推广其广阔的应用前景具有积极的作用。
[1]刘慧,李平兰,高秀芝,等.开菲尔粒中乳酸菌的分离方法研究[J].食品科学,2007(6):56-60.
[2]Hechard Y,Sahl H.G.Mode of action ofmodified and unmoditied bacteriocins from Grampositive bacteria[J].Biochimie,2007,84:545-557.
[3]Koji Yamazaki,minako Suzuki. Purification and Characterazation of a Novel Class Ⅱa Bacteriocin,Piscicocin CS526,from Surimi-Associated Carnobacterium piscicola CS526 [J]. Applied and Environmental Microbiology,2005,71(1):554-557.
[4]Gill A O,Holey R A.Interactive inhibition of meat spoilage and pathogenic bacteria by lysozyme of Food[J].Microbiology,2003,80:251-259.
[5]Branen J K,Davidson P M.Enhancement of Nisin,lysozyme and monolaurin antimicrobial activities by ethylene diamine tetraacetic acid and lactoferrin [J].International Journal of Food Microbiology,2004,90:63-74.
[6]王颖,桑文彦,安宇.开菲尔粒中产球菌样细菌素乳酸菌的分离与鉴定[J].黑龙江八一农垦大学学报,2011,23(5):50-53.
[7]郭本恒.乳品微生物学[M].北京:中国轻工业出版社,2001.
[8]Antonio Maldonado,Jose Luis Ruiz-Barba.Purification and Genetic Characterazation ofPlantarcin NC8,a Novel Coculture-Inducible Two-Peptide Bacteriocion from Lactobacillus plantarum NC8 [J]. Applied and Environmental Microbiology,2003,69(1):383-389.
