新生大鼠海马神经元原代无血清培养与鉴定
2012-06-05黄立宁韩建民曹翠丽
黄立宁,韩建民,刘 雅,刘 悦,曹翠丽
(河北医科大学1.第二医院麻醉科;2.神经生物研究室,河北石家庄 050000)
新生大鼠海马神经元原代无血清培养与鉴定
黄立宁1,韩建民1,刘 雅1,刘 悦1,曹翠丽2*
(河北医科大学1.第二医院麻醉科;2.神经生物研究室,河北石家庄 050000)
目的 建立一种简单、易行的海马神经元无血清体外培养方法以获得高纯度、高活力的海马神经元。方法取新生24 h内SD大鼠,分离海马,经消化后种植于包被有Matrigel基膜的玻片上,24 h后换含有N2、B27的Neurobasal无血清培养基,于不同时间在倒置相差显微镜下观察细胞的生长状态;采用β-tublinⅢ免疫荧光细胞化学技术鉴定海马神经元纯度。结果 大部分海马神经元于3~24 h贴壁且可长出细长突起,3 d细胞具有典型神经元的形态特征,5d后神经元突起进一步增多并形成稠密的网络连接,7 d后神经元胞体丰满,趋于成熟。经β-tublinШ免疫荧光技术鉴定纯度为94.2%±3.6%。结论 此方法简单有效,可获得高纯度的海马神经元。
海马;神经元;原代培养;新生大鼠
对于众多神经领域研究,诸如神经元发育分化、神经再生、神经疾病的发生机制,原代培养的神经元是一个很好的实验模型,具有影响因素单一、机体干扰因素少和结果易分析等优点。所以,常用于细胞和分子水平上深入研究神经元物质代谢、生理、药理及形态特征[1-2]。海马属于大脑的边缘系统,在学习、记忆、情绪反应及神经系统疾病的病理生理变化等方面有重要作用,而且海马组织是中枢神经系统内主要的神经干细胞聚集区,具有高度序化板层结构和神经元相对独立分布的特点,境界相对清晰,便于取材,因此,海马神经元体外培养模型被广大基础医学和临床医学研究者当做理想的实验模型。但在原代培养中海马神经元的纯度、活力及产量还存在一些急待解决的问题。本研究参考原有的培养方法并进行改进,获得了一种简单、易行的海马神经元培养方法,为今后研究麻醉药对海马神经元毒性作用提供高纯度的海马神经元。
1 材料与方法
1.1 材料
1.1.1 实验动物:新生24 h内清洁级SD大鼠,体质量4.8~6.5 g,雌雄不限,(河北医科大学动物实验中心提供,合格证号:1106088)。
1.1.2 主要试剂:DMEM培养基和胎牛血清(FBS)、B27、N2培养基添加剂(Gibco公司);Neurobasal培养基(Invitrogen公司);Accutase酶、Hoechst 33258(Sigma公司);小鼠抗大鼠β-tublinШ单克隆抗体(Millipore公司);FITC标记山羊抗鼠IgG(KPL公司);Matrigel基膜(BD公司);青链霉素(华北制药集团)。
1.1.3 主要仪器:倒置相差显微镜、倒置荧光显微镜TE2000-S(Nikon公司),二氧化碳恒温培养箱(Thermo公司)。
1.2 方法
1.2.1 培养板的预处理:24孔塑料培养板放入盖玻片平铺 Matrigel基膜(1∶30,DMEM 稀释),放入培养箱,孵育1 h,接种细胞前吸出待用。
1.2.2 海马神经元的分离、纯化和培养:取新生24 h内SD大鼠经75%乙醇浸泡、消毒。剪开皮肤和颅骨,暴露两侧大脑半球,用弯镊取出大脑并放入含预冷PBS液的培养皿中,培养皿置于冰床上,用眼科无齿尖镊小心分开皮层,暴露并取出双侧海马组织,冷PBS液反复冲洗,去除残留血管和脑膜后用眼科虹膜剪将海马组织剪成1 mm×1 mm×1 mm的小块,将其移入离心管,以800 r/min 5 min离心弃上清,加入3倍于海马组织体积的Accutase酶,放入培养箱消化10~20 min,其间震荡数次,当消化液混浊、不含有明显组织块时,加入含10%FBS的DMEM液终止消化,经充分吹打,200目铜滤网过滤。收集过滤后的细胞以800 r/min 5 min离心,弃上清,加入含10%FBS的DMEM液,吹打成细胞悬液。转至塑料培养瓶中,放入培养箱经差速贴壁1 h,收获贴壁速度较胶质细胞慢的神经元,吹打后以0.4%台盼蓝染色计数活细胞并调整悬液的细胞密度,按1×106/mL的浓度将细胞种植在Matrigel基膜包被后的盖玻片上,每片加150 μL细胞悬液,将接种好的24孔板置于含有去离子水的湿盒中,将其放入二氧化碳恒温培养箱,24 h内全量换含有1%N2、2%B27的Neurobasal培养液,其后,每2天半量换液,并在倒置相差显微镜下观察神经元生长情况。
1.3 大鼠海马神经元的免疫荧光细胞化学鉴定
1.3.1 免疫荧光细胞化学:取出盖玻片,4%多聚甲醛室温固定15 min,0.3%Triton X-100透膜15~20 min,10%牛血清白蛋白(bovine serum albumin,BSA)37℃孵育30 min封闭非特异性结合位点,倾去血清加入2%BSA稀释的小鼠抗大鼠β-tublinШ单克隆抗体(1∶200)4℃过夜,加入2%BSA稀释的1∶50 FITC标记的羊抗小鼠IgG二抗、50 mg/L Hoechst 33258复染细胞核,湿盒内室温避光孵育1 h,所有操作步骤前经1×PBS轻洗3遍,每次5 min,滤纸吸干盖玻片多余液体。倒置荧光显微镜下观察,同一视野用不同的激发光激发FITC和Hoechst33258分别摄取细胞和细胞核的荧光图片,利用显微镜自带NIS成像软件将所得图片进行组合。
1.3.2 大鼠海马神经元纯度的鉴定:以β-tublinШ单克隆抗体荧光染色显示海马神经元,用 Hoechst33258复染显示所有细胞核。神经元纯度计算方法:在高倍显微镜下随机选取5个视野,计算出其中阳性细胞的个数,换算成百分比,重复5次,取其均值作为阳性神经元的纯度。
2 结果
2.1 海马神经元的形态观察
在倒置相差显微镜下观察,刚接种的细胞呈圆形,体积小、透亮呈悬浮状态,单个均匀分布,培养3 h后开始贴壁,细胞接种20 h后可见大部分细胞已贴壁,但培养液内组织残渣较多,换液去除残渣。贴壁细胞形态多呈梭形、三角形,长出细长突起,长短不一。3 d后细胞具有典型神经元的形态特征,胞体饱满,多呈梭形,少数呈不规则形,胞浆丰富,突起较前明显增长、增粗,连接成网络,仍可见少量扁平状的神经胶质细胞。5 d后神经元胞体继续增大,互相迁移靠近,开始形成集落样神经元群落,突起已形成较稠密的神经纤维网络。7~10 d神经元胞体最丰满,周围光晕明显,突起交织成更加稠密的网络,突起增粗增长且光晕明显,立体感增强。14 d后细胞聚集现象明显,培养板上出现明显的细胞间空白区域。20 d后神经细胞开始退化,细胞边缘光晕变淡,突起开始退缩,部分细胞核固缩明显(图1)。
2.2 海马神经元纯度鉴定
经β-tublinШ单克隆抗体和Hoechst33258在荧光倒置显微镜下鉴定(图2),计算海马神经元纯度为94.2%±3.6%。
3 讨论
海马是神经元相对独立分布并较为集中的组织,涉及学习、记忆及情绪反应等许多复杂生理功能,因此,海马神经元的原代培养在基础和临床研究应用十分广泛。但是,一直以来神经元在原代培养中都是死亡率较高的一类细胞,在海马神经元的培养过程中,如何提高神经元的纯度、贴壁率和活力一直困扰着广大的研究者。

图1 体外培养不同时间大鼠海马神经元形态观察Fig1 Hippocampal neurons derived from new-born rats cultured at different time(×200)
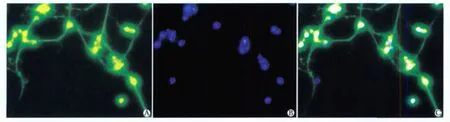
图2 培养7 d的海马神经细胞免疫荧光染色Fig 2 Immunofluorescence staining of hippocampal neurons on the 7th day
本实验汲取过去部分研究者的经验[3-5]并结合自身体会就海马神经元原代培养过程中的经验,现总结如下:1)实验从取材到接种完毕的时间一定控制在2h内完成且取材过程在冰床上进行,以保持细胞的活力。2)在消化剪碎的组织时,存在较高浓度的胰蛋白酶对细胞表面损伤较大,消化时间不易掌握;而较低浓度的胰蛋白酶消化不彻底以致所得细胞数量少等问题,因此本实验未使用传统的胰蛋白酶而采用Accutase酶。Accutase酶具有胶原酶和蛋白酶活性,作用更温和,消化时间要求相对宽松,对细胞表面损伤相对较小且消化较彻底,从而使细胞具有更高的活力。在人胚皮层神经干细胞培养中应用Accutase酶发现[6]比胰蛋白酶培养的同期细胞团直径大,推测与Accutase酶作用温和,对细胞特别是形成神经球必需的细胞黏附分子的损伤相对较小有关。3)在包被玻片时,未使用多聚赖氨酸,而使用Matrigel基膜,Matrigel是从小鼠肉瘤中抽提得到的可溶性的基底膜抽提物,此种肉瘤不仅富含细胞外基质蛋白,还含有TGF-β,FGF,tPA和其他生长因子。在室温下,可聚合成一种具有生物活性的基质材料,其作用与哺乳动物细胞基底膜类似,有研究者成功地将Matrigel基膜用于人胚胎干细胞的培养[7],本研究尝试性将Matrigel基膜取代传统的多聚赖氨酸用于海马神经元的原代培养,取得了良好的效果。4)在抑制胶质细胞过度增殖方面,本研究用差速贴壁和无血清培养相结合的方法,未使用阿糖胞苷,避免了因加入阿糖胞苷引起的神经元损伤。5)接种前充分混匀,接种时依靠表面张力将接种液在玻片上接种呈半圆形,此种方法即可以减少接种液用量又可使细胞至玻片的距离缩短,提高贴壁率。
用此方法培养可获得高纯度、高活力的海马神经元,方法简单无需特殊设备,在普通的细胞培养室即可完成。所培养的细胞能够建立体外神经网络,形成有效的突触连接,为进一步研究奠定了基础。
[1]Hsin S,Kim MG,Wang CF,et al.Proline-rich tyrosine kinase 2 regulates hippocampal long-term depression[J].J Neurosci,2010,30:11983 -11993.
[2]Lu H,Pang W,Hu YD,et al.Effects of intracellular zinc depletion on the expression of VDAC in cultured hippocampal neurons.[J].Nutr Neurosci,2011,14:80 -87.
[3]赵秀鹤,迟兆富,尚伟,等.新生人鼠海马神经元的体外原代培养[J].基础医学与临床,2007,27:329-332.
[4]周明,聂菁,吕诚,等.一种大鼠海马神经元的原代培养方法[J].南昌大学学报:医学版,2010,50:1-3.
[5]曾可斌,胡长林,陈阳美.大鼠海马神经元培养与鉴定[J].基础医学与临床,2004,24:514-577.
[6]任萍,关云谦,张愚.人胚皮层神经干细胞培养方法的探讨[J].分子细胞生物学报,2007,40:79-83.
[7]李宁,朱宝长,朱宛宛,等.慢病毒介导绿色荧光蛋白转染人胚胎干细胞及其培养[J].基础医学与临床,2008,28:1083-1087.
Serum-free primary culture and identification of hippocampal neurons from newborn rats
HUANG Li-ning1,HAN Jian-min1,LIU Ya1,LIU Yue1,CAO Cui-li2*
(1.Dept.of Anaesthesiology,the Second Hospital;2.Dept.of Neurobiology,Hebei Medical University,Shijiazhuang 050017,China)
ObjectiveTo establish a simple and practical method of the serum-free primary culture of hippocampal neuronsin vitroto obtain highly purified and energetic neurons.MethodsHippocampi of newborn rats after birth in 24 hours were taken out and digested.Hippocampal neurons were planted on the glass slides covered with Matrigel basement membrane.Twenty-four hours after the cell being plated,the culture medium was removed and replaced by serum-free neurobasal one with N2 and B27 supplementations.The morphological changes of the neurons were observed under inverted phase-contrast microscope at different time.Immunofluorescence staining for β-tublinⅢ was performed to identify the purity of neurons.ResultsA large number of hippocampal neurons began to adhere to the glass slides and develop small neurites in 3~24 hours.Then,cells with typical neuron morphology appeared on the third day.Up to the 5th day,many neurites extended to form dense network.Soma of neurons became well developed on the 7th day.Fluorescence staining with β-tublinⅢ showed that the purity of neurons was 94.2% ±3.6%.ConclusionsThe present protocol is a simple and efficient method for culturing hippocampal neurons with high purity.
hippocampus;neurons;primary culture;newborn rats
R-331
A
1001-6325(2012)01-0083-04
2011-05-20
2011-07-18
河北省2011年医学科学研究重点课题计划(20110338)*< class="emphasis_bold">通信作者(corresponding author):
(corresponding author):caocuili615@163.com
