食管癌耐药皮下移植瘤裸鼠模型的建立
2012-06-05左连富郭建文李金丫
刘 亮,左 静,左连富*,郭建文,李金丫
(河北医科大学第四医院1.肿瘤研究所流式细胞室;2.肿瘤内科,河北石家庄 050011)
食管癌耐药皮下移植瘤裸鼠模型的建立
刘 亮1,左 静2,左连富1*,郭建文1,李金丫1
(河北医科大学第四医院1.肿瘤研究所流式细胞室;2.肿瘤内科,河北石家庄 050011)
目的 建立食管癌耐药裸鼠模型及探讨食管癌耐药机制。方法 4周龄的BALB/c nu/nu裸小鼠36只,随机分为6组,左前肢肩胛下皮下分别接种食管癌细胞Eca109及食管癌耐药细胞Eca109/ABCG2,建立裸鼠皮下移植瘤模型。成瘤后腹腔注射阿霉素(ADM)1、4 mg/kg。RT-PCR方法检测移植瘤细胞中三磷酸腺苷结合转运蛋白G2(ABCG2)mRNA表达,流式细胞术检测移植瘤细胞中ABCG2蛋白、凋亡及细胞中ADM含量。结果 成功建立裸鼠食管癌耐药细胞移植瘤模型,皮下接种细胞1周后成瘤,成瘤率100%。注射ADM,接种Eca109/ABCG2细胞的裸鼠皮下移植瘤体积、质量和ABCG2表达量显著高于接种Eca109细胞移植瘤(P<0.05),但细胞凋亡率及细胞内ADM含量显著降低(P<0.05)。结论 接种Eca109/ABCG2细胞的裸鼠皮下移植瘤模型是具有ABCG2耐药表型的食管癌耐药动物模型。
食管鳞状细胞癌;流式细胞术;多药耐药;三磷酸腺苷结合转运蛋白G超家族成员2
*通信作者(corresponding author):zuolianfu4909@sina.com
食管癌是世界范围内较常见的恶性肿瘤,发病率及病死率较高,严重威胁着人们的生命健康。目前食管癌的治疗主要依靠手术,放疗及化疗。手术仍是目前首选的治疗方法,但对于一些晚期肿瘤或由于其他原因不能手术的患者,往往会选择化疗,在化疗过程中出现的多药耐药 (multidrug resistance,MDR)严重影响了治疗的效果,甚至导致化疗失败。目前食管癌多药耐药机制仍未阐明,且缺乏食管癌耐药动物模型。研究发现三磷酸腺苷结合盒 (ATP-binding cassette,ABC)转运蛋白与肿瘤多药耐药有关[1],ABCG2是近年来发现的与肿瘤多药耐药有关的ABC家族成员[2],但与食管癌耐药关系的研究较少。本研究利用动物模型研究ABCG2与食管癌耐药的关系,建立食管癌耐药裸鼠模型,初步探讨食管癌多药耐药机制,为食管癌耐药逆转寻找新的靶点。
1 材料与方法
1.1 材料
1.1.1 细胞系来源及实验动物:人食管鳞状细胞癌细胞系Eca109,本实验室培养、传代。人食管癌耐药细胞系Eca109/ABCG2细胞本实验室构建培养[3]。
BALB/c nu/nu裸小鼠36只,4周龄,雌雄各半,体质量17~20 g,购自中国医学科学院实验动物研究所[动物许可证编号:SCXK(京)2005-0013],饲养于河北医科大学第四医院动物实验中心清洁级动物室内(SPF级)。
1.1.2 主要实验仪器及试剂:Epics-XLⅡ型流式细胞仪(Beckman-Coulter公司);FITC标记的ABCG2(5D3)抗体(Biolegend公司);阿霉素(浙江海正药业股份有限公司);胎牛血清(杭州四季青公司)。
1.2 细胞培养
人食管癌耐药细胞系Eca109/ABCG2用含10% FBS的 RPMI1640培养基(含300 mg/L G418),于37℃、5%CO2的恒温培养箱中培养,实验前 1周改换含 10%FBS(不含 G418)的 RPMI1640培养基。
1.3 荷瘤裸鼠动物模型建立及实验分组药物干预治疗
取200 μL浓度为3×107个/mL处于对数生长期的Eca109、Eca109/ABCG2细胞分别接种至裸鼠左前肢肩胛皮下。
将36只裸鼠按体质量随机分为6组,雌雄各半,分笼饲养。其中注射Eca109及Eca109/ABCG2细胞裸鼠皮下种植瘤组各3组。裸鼠皮下注射细胞1周后成瘤率100%,开始用药。
药物注射方式及时间:1和4 mg/kg ADM,腹腔注射,1次/3d,共注射7次,对照组给予0.9%氯化钠注射液。
1.4 ADM对裸鼠移植瘤生长抑制作用
1.4.1 绘制肿瘤生长曲线:实验过程中隔日测量1次裸鼠的体质量并用游标卡尺测量肿瘤的长、短径,绘制肿瘤生长曲线,肿瘤近似体积按公式V=ab2/2计算(a,b分别为肿瘤的最长、最短径)。
1.4.2 计算肿瘤抑制率:药物停用1 d后采用拉颈法统一无痛苦处死裸鼠,剥离皮下肿瘤称重。肿瘤体积或质量抑制率=(对照组肿瘤体积或质量-实验组肿瘤体积或质量)/对照组肿瘤体积或质量×100%。
1.5 标本采集
取出瘤体后,部分组织液氮冻存,用于RT-PCR检测;部分瘤组织立即用网搓法制备单细胞悬液用于FCM检测。
1.6 RT-PCR方法检测移植瘤细胞中ABCG2 mRNA表达量
使用Trizol试剂提取组织细胞的总RNA,利用Promega A3500试剂盒进行反转录,以适量反转录所得的cDNA为模板,在TaqDNA聚合酶催化下进行PCR扩增。所用引物及扩增片段长度:ABCG2:正向引物:5'-GGTCAGAGTGTGGTTTCTGTAGCA-3',反向引物:5'-GTGAGAGATCGATGCCCTGCTTTA-3',扩增片段280 bp,GAPDH:正向引物:5'-ACCACAGTCC ATGCCATCAC-3',反向引物:5'-TCCACCACCCTGTT GCTGTA-3',扩增片段452 bp。取8 μL PCR 产物,在1.5%琼脂糖凝胶中电泳,EB染色,紫外凝胶成像仪上观察并拍照。用Gel-proAnalyzer3.1软件分析扩增产物的吸光度(A)值,计算ABCG2(A)值与GAPDH(A)值的比值,对ABCG2mRNA表达强度进行半定量分析。
1.7 FCM检测裸鼠皮下种植瘤细胞ABCG2蛋白、凋亡及细胞中ADM含量
应用网措法将瘤组织制备成单细胞悬液,调整细胞浓度为1×107个/mL。取单细胞悬液0.1 mL(含1×106个细胞),加入FITC标记的ABCG2抗体0.01 mL,室温避光放置30 min,上机检测,以平均荧光强度表示蛋白含量。取0.1 mL细胞悬液向其中加入PI染液1 mL,4℃染色30 min,上机检测凋亡,以凋亡率表示凋亡状态。取1 mL细胞悬液直接上机检测,ADM可被488nm激光激发后发出红光被流式细胞仪接收检测,以平均荧光强度表示细胞内ADM含量。
1.8 统计学分析
2 结果
2.1 裸鼠皮下移植瘤模型建立
接种Eca109、Eca109/ABCG2细胞后,7 d左右开始成瘤,瘤体逐渐增大,成瘤率达100%。种植瘤呈圆形或椭圆形(图1),待瘤体长至0.5 cm时开始用药。
2.2 皮下移植瘤生长曲线及肿瘤生长抑制率
从皮下移植瘤生长曲线上可以看出,随着时间延长,接种Eca109/ABCG2细胞皮下移植瘤的体积增长的速度较接种 Eca109细胞快,提示接种Eca109/ABCG2细胞皮下移植瘤对ADM产生耐药(图2)。1、4 mg/kg ADM 作用后,接种 Eca109/ABCG2细胞皮下移植瘤的体积及质量显著高于接种Eca109细胞(P<0.05),移植瘤的体积及质量抑制率显著降低(P<0.05)(表1,2)。
图1 人食管癌细胞裸鼠皮下移植瘤Fig 1 Human esophageal cancer xenograft in nude mice
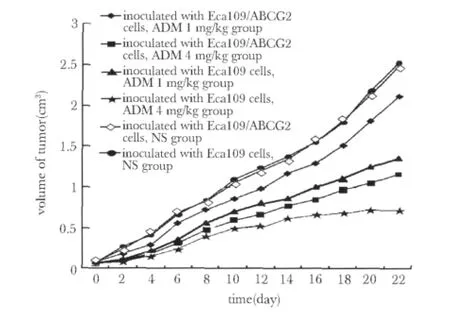
图2 裸鼠皮下移植瘤生长曲线图Fig 2 Growth curve of xenograft in nude mice
2.3 RT-PCR方法检测接种不同细胞皮下移植瘤中ABCG2 mRNA表达差异
接种Eca109/ABCG2细胞的皮下移植瘤中ABCG2mRNA表达量显著高于接种Eca109细胞的表达(P<0.05)(表3)。
表1 ADM药物作用后接种Eca109及Eca109/ABCG2细胞裸鼠皮下移植瘤体积及质量Table 1 Effect of ADM on the volume and weight of Eca109,Eca109/ABCG2 cells xenograft tumors in nude mice(±s,n=6)

表1 ADM药物作用后接种Eca109及Eca109/ABCG2细胞裸鼠皮下移植瘤体积及质量Table 1 Effect of ADM on the volume and weight of Eca109,Eca109/ABCG2 cells xenograft tumors in nude mice(±s,n=6)
*P <0.05 compared with Eca109/ABCG2 cells xenograft tumor.
drug dose(mg/kg)lls xenograft tumor volume(cm3) weight(g) volume(cm3) weight(g)Eca109/ABCG2 cells xenograft tumor Eca109 ce control 0 2.49±0.10 2.18±0.08 2.53±0.17 2.25±0.19 ADM 1 2.11±0.03 1.77±0.08 1.35±0.04* 1.13±0.13*4 1.16±0.09 0.90±0.03 0.71±0.04* 0.57±0.07*
表2 ADM药物作用后接种Eca109及Eca109/ABCG2细胞裸鼠皮下移植瘤体积及质量抑制率Table 2 The volume and weight inhibition effect of ADM on the growth of Eca109,Eca109/ABCG2 cells xenograft tumors in nude mice(±s,%,n=6)

表2 ADM药物作用后接种Eca109及Eca109/ABCG2细胞裸鼠皮下移植瘤体积及质量抑制率Table 2 The volume and weight inhibition effect of ADM on the growth of Eca109,Eca109/ABCG2 cells xenograft tumors in nude mice(±s,%,n=6)
*P <0.05 compared with Eca109/ABCG2 cells xenograft tumor.
drug dose(mg/kg)Eca109/ABCG2 cells xenograft tumor inhibiti on rate Eca109 cells xenograft tumor inhibiti on rate volume weight volume weight control 0————ADM 1 15.30±1.17 18.93±2.80 46.71±1.67* 49.63±3.33*4 53.42±3.55 58.51±0.80 71.84±1.68* 74.79±2.75*
表3 接种Eca109及Eca109/ABCG2细胞裸鼠皮下移植瘤细胞ABCG2 mRNA及蛋白表达量Table 3 ABCG2 mRNA and protein expression of Eca109,Eca109/ABCG2 cells xenograft tumors(±s,n=6)

表3 接种Eca109及Eca109/ABCG2细胞裸鼠皮下移植瘤细胞ABCG2 mRNA及蛋白表达量Table 3 ABCG2 mRNA and protein expression of Eca109,Eca109/ABCG2 cells xenograft tumors(±s,n=6)
*P <0.05 compared with Eca109/ABCG2 cells xenograft tumor.
drug dose(mg/kg)lls xenograft tumor ABCG2 mRNA ABCG2 protein ABCG2 Eca109/ABCG2 cells xenograft tumor Eca109 ce mRNA ABCG2 ptotein control 0 0.92±0.07 449.24±5.41 0.67±0.06* 358.64±13.21*ADM 1 0.93±0.07 450.30±13.59 0.68±0.06* 360.30±13.90*4 0.93±0.05 452.64±14.72 0.68±0.06* 362.58±17.04*

图3 流式细胞术检测移植瘤细胞中ABCG2蛋白表达量Fig 3 ABCG2 protein expression of xenograft tumors assayed by FCM
2.4 FCM方法检测裸鼠皮下移植瘤细胞中ABCG2蛋白、凋亡及细胞中ADM含量
2.4.1 移植瘤细胞中ABCG2蛋白表达的差异:接种Eca109/ABCG2细胞的皮下移植瘤中ABCG2蛋白表达量显著高于接种Eca109细胞的表达(P<0.05)(表3,图3),检测的结果同RT-PCR一致。2.4.2 移植瘤细胞凋亡情况:相同浓度的ADM作用组,接种Eca109/ABCG2细胞的皮下移植瘤细胞凋亡率显著低于接种Eca109细胞皮下移植瘤细胞凋亡率(P<0.05)(表4)。
表4 ADM作用后接种Eca109及Eca109/ABCG2细胞皮下移植瘤细胞凋亡率Table 4 Effect of ADM on cell apoptosis of Eca109,Eca109/ABCG2 cells xenograft tumors(±s,%,n=6)
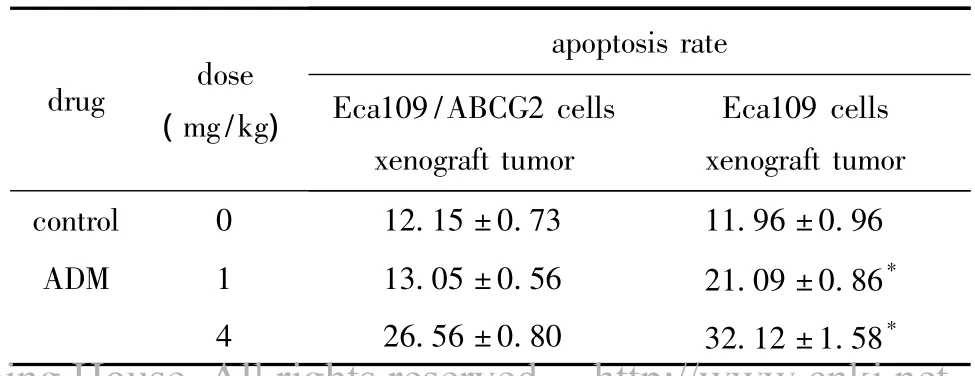
表4 ADM作用后接种Eca109及Eca109/ABCG2细胞皮下移植瘤细胞凋亡率Table 4 Effect of ADM on cell apoptosis of Eca109,Eca109/ABCG2 cells xenograft tumors(±s,%,n=6)
*P <0.05 compared with Eca109/ABCG2 cells xenograft tumor.
drug dose(mg/kg)apoptosis rate Eca109/ABCG2 cells xenograft tumor Eca109 cells xenograft tumor control 0 12.15±0.73 11.96±0.96 ADM 1 13.05±0.56 21.09±0.86*4 26.56±0.80 32.12±1.58*
2.4.3 移植瘤细胞中ADM含量:相同浓度的ADM作用组,接种Eca109/ABCG2细胞的皮下移植瘤细胞中ADM含量显著低于接种Eca109细胞的ADM含量(P<0.05)(表5)。
表5 ADM作用后接种Eca109及Eca109/ABCG2细胞皮下移植瘤细胞内ADM含量Table 5 Content of ADM in Eca109,Eca109/ABCG2 cells xenograft tumors treated with ADM(±s,n=6)
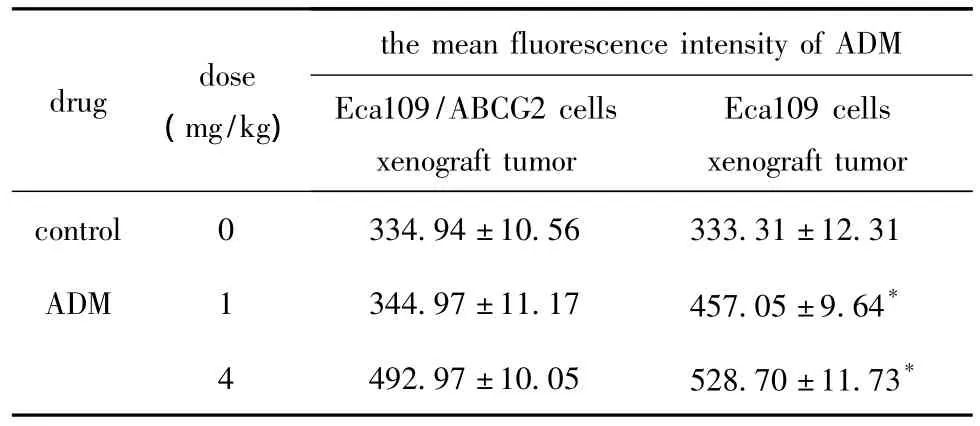
表5 ADM作用后接种Eca109及Eca109/ABCG2细胞皮下移植瘤细胞内ADM含量Table 5 Content of ADM in Eca109,Eca109/ABCG2 cells xenograft tumors treated with ADM(±s,n=6)
*P <0.05 compared with Eca109/ABCG2 cells xenograft tumor.
drug dose(mg/kg)the mean fluorescence intensity of ADM Eca109/ABCG2 cells xenograft tumor Eca109 cells xenograft tumor control 0 334.94±10.56 333.31±12.31 ADM 1 344.97±11.17 457.05±9.64**
3 讨论
肿瘤多药耐药是影响化疗效果的重要因素。目前化疗已是肿瘤常规治疗方法之一,与手术和放疗并称肿瘤的3大治疗方法。对于一些晚期肿瘤或其他原因失去手术机会的患者,往往会选择化疗。因此,化疗在肿瘤的治疗上起着重要的作用。化疗过程中出现的多药耐药严重影响化疗疗效,甚至会导致化疗失败。因此阐明肿瘤多药耐药机制,对于多药耐药逆转具有重要意义。目前研究发现一类跨膜蛋白与肿瘤多药耐药关系密切,这类跨膜蛋白多为三磷酸腺苷结合转运蛋白家族成员[4-6],ABCG2是近来发现的与肿瘤多药耐药有关的因子[7-11]。ABCG2又称乳腺癌耐药蛋白,是从人乳腺癌耐药细胞系MCF-7/AdrVp分离得到的[12],由655个氨基酸组成的跨膜蛋白,可以将细胞中的化疗药物泵出细胞外降低细胞内化疗药物有效浓度从而产生耐药。研究多围绕乳腺癌和白血病等,少见在食管癌中的研究。
食管癌化疗过程中产生多药耐药也是较常见的现象,尤其对于复发性肿瘤多药耐药就更为普遍。目前食管癌多药耐药产生机制仍未阐明,且缺乏研究耐药机制的动物模型。本研究将食管癌耐药细胞Eca109/ABCG2[3]接种于裸鼠皮下建立食管癌皮下移植瘤耐药动物。实验中从裸鼠皮下移植瘤生长曲线观察到接种Eca109/ABCG2细胞的皮下移植瘤随着天数的增加肿瘤体积较接种Eca109细胞增长迅速。提示接种Eca109/ABCG2细胞的裸鼠皮下移植瘤对ADM产生耐药,食管癌耐药细胞 Eca109/ABCG2接种于裸鼠皮下形成的移植瘤仍保持耐药特性。
应用RT-PCR和FCM方法检测到接种Eca109/ABCG2细胞的裸鼠皮下移植瘤细胞中ABCG2mRNA和蛋白表达量显著增高,细胞内ADM含量和细胞凋亡率显著减少,ABCG2的高表达成功解释了细胞内ADM含量减少,导致对细胞的杀伤性降低(细胞凋亡率减少),最终产生耐药的原因,ABCG2将进入细胞内的ADM泵出细胞外从而降低细胞内ADM有效浓度,产生耐药,提示ABCG2与食管癌多药耐药有关。
综合上述研究,此食管癌耐药动物模型是具有ABCG2耐药表型的多药耐药裸鼠模型,可作为研究食管癌多药耐药的动物模型。
食管癌多药耐药是多因素引起的,本课题小组在今后的实验中会进一步研究其他耐药途径与食管癌多药耐药的关系,为阐明食管癌耐药机制提供实验基础。
[1] Shukla S,Ohnuma S,Ambudkar SV.Improving Cancer Chemotherapy with Modulators of ABC Drug Transporters[J].Curr Drug Targets,2011,12:621-630.
[2]Polgar O,Robey RW,Bates SE.ABCG2:structure,function and role in drug response[J].Expert Opin Drug Metab Toxicol,2008,4:1-15.
[3]刘亮,左静,赵丽,等.ABCG2食管癌耐药细胞系Eca109/ABCG2的建立[J].解放军医学杂志,2010,35:32-35.
[4]Shi Z,Tiwari AK,Shukla S,et al.Sildenafil Reverses AB-CB1-and ABCG2-Mediated Chemotherapeutic Drug Resistance[J].Cancer Res,2011,71:3029-3041.
[5]Zembruski NC,Büchel G,Jödicke L,et al.Potential of novel antiretrovirals to modulate expression and function of drug transportersin vitro[J].J Antimicrob Chemother,2011,66:802-812.
[6]Pick A,Müller H,Mayer R,et al.Structure-activity relationships of flavonoids as inhibitors of breast cancer resistance protein(BCRP)[J].Bioorg Med Chem,2011,19:2090-2102.
[7]Liu HG,Pan YF,You J,et al.Expression of ABCG2 and its significance in colorectal cancer[J].Asian Pac J Cancer Prev,2010,11:845-848.
[8]Dou J,Jiang C,Wang J,et al.Using ABCG2-molecule-expressing side population cells to identify cancer stem-like cells in a human ovarian cell line[J].Cell Biol Int,2011,35:227-234.
[9]刘亮,赵丽,刘江惠,等.三磷酸腺苷结合转运蛋白G超家族成员2基因在食管癌中的表达及意义[J].中国医科大学学报,2008,37:776-778.
[10]刘亮,左静,赵丽,等.阿霉素诱导食管癌耐药细胞中ABCG2的表达及其意义[J].中国医科大学学报,2010,39:101-104.
[11]刘亮,左静,赵丽,等.ABCB1、ABCG2与食管癌患者多药耐药的关系[J].中国老年学杂志,2011,31:15-17.
[12]Doyle L A,RossD D.Multidrug resistance mediated by the breast cancer resistance protein BCRP(ABCG2)[J].Oncogene,2003,22:7340-7358.
Establishment of esophageal cancer drug resistant xenograft nude mice model
LIU Liang1,ZUO Jing2,ZUO Lian-Fu1*,GUO Jian-Wen1,LI Jin-Ya1
(1.Dept.of FCM Analysis,Tumor Institute;2.Dept.of Internal Oncology,the Forth Hospital of HeBei Medical University,Shijiazhuang 050011,China)
ObjectiveTo establish A nude mice model of esophageal cancer drug resistant xenograft and explore the mechanism of esophageal cancer drug resistance.MethodsThirty-six nude mice(BALB/c nu/nu,4 weeks old)were divided into six groups randomly.Nude mice were respectively inoculated with Eca109 or Eca109/ABCG2 cells subcutaneously in the left subscapularis to establish xenograft nude mice model.The experimental groups
ADM(1,4 mg/kg/3 d,respectively)for 7 times.ABCG2mRNA level of xenograft was detected by RTPCR.ABCG2 protein level,cell apoptosis and ADM content in cells of xenograft were detected by flow cytometry.ResultsThe model of esophageal cancer xenograft in nude mice was successfully established,the tumorigenic rate was 100%.In the same ADM concentration group,volume,weight and ABCG2 expression of transplanted tumor inoculated with Eca109/ABCG2 cells was significantly higher than that that inoculated with Eca109 cells(P<0.05),but the cell apoptosis and ADM content was significantly lower(P<0.05).ConclusionsThe nude mice xenograft inoculated with Eca 1 0 9/ABCG 2 cells model is an ideal animal model of esophageal cancer drug resist-ance with ABCG2 resistance phenotype.
esophageal squamous cell carcinoma;Flow cytometry;multidrug resistance;ABCG2
R 735.1
A
1001-6325(2012)01-0077-06
2011-04-22
2011-07-22
河北省自然科学基金 (C2007001060);河北省普通高等学校强势特色学科肿瘤学建设经费(冀教高[2005]52号);河北省医学科学研究重点课题(20110131)
