妊娠期糖尿病及正常糖耐量孕妇血浆护骨素水平的比较
2012-06-05宋爱羚孙梅励
宋爱羚,聂 敏*,孙梅励,王 瑛,2
(1.中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点实验室,北京 100730;2.山西医科大学附属第二临床学院内分泌科,山西太原 030000)
妊娠期糖尿病及正常糖耐量孕妇血浆护骨素水平的比较
宋爱羚1,聂 敏1*,孙梅励1,王 瑛1,2
(1.中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点实验室,北京 100730;2.山西医科大学附属第二临床学院内分泌科,山西太原 030000)
目的 比较妊娠期糖尿病(GDM)和正常糖耐量(NGT)妊娠妇女在怀孕中晚期血浆护骨素(OPG)及相关因子水平。方法 NGT和GDM妊娠妇女各65例,于孕24~28周取静脉血,-20℃低温保存。用酶联免疫吸附测定法(ELISA)测定血浆护骨素(OPG)水平,同时测定空腹血糖(FPG),空腹胰岛素(FINS),糖化血红蛋白(HbA1c),血脂水平,超敏C反应蛋白(hs-CRP),血细胞计数,计算胰岛细胞功能(HOMA-B)和胰岛素抵抗(HOMA-IR)的评估指数。结果 GDM 组和 NGT组血浆骨保护素(OPG)水平分别为2 619[1 968,3 917]ng/L和3 225[2 146,4 226]ng/L,两组间无明显差异。在NGT组,OPG与FINS(r=0.335;P<0.05)、HOMA-IR(r=0.363;P<0.05)和血小板计数(r=0.333;P<0.05)呈正相关,与载脂蛋白B(r=-0.254;P<0.05)呈负相关,在GDM组,未发现上述指标与OPG水平相关。结论 OPG可能参与了糖耐量正常孕妇孕期的胰岛素抵抗和炎性反应。
护骨素;妊娠期糖尿病;空腹胰岛素水平
*通信作者(corresponding author):nm_pumch@yahoo.com.cn
护骨素(Osteoprotegerin,OPG)又称破骨细胞抑制因子,是由380个氨基酸组成的分泌型糖蛋白,属于肿瘤坏死因子受体超家族的新成员。它阻止RANKL与RANK的结合,抑制RANK的作用,从而阻断破骨细胞的生成,在骨代谢中发挥关键作用[1]。
研究发现,OPG不仅仅是一种骨保护因子,也是一种重要的血管调节因子。在发生血管钙化、冠状动脉疾病和中风时,患者血清OPG水平增加,其升高原因可能是机体发生的代偿反应,通过增加OPG水平,延缓血管的钙化[2]。文献报道,新诊断的2型糖尿病患者血浆OPG水平增加[3]。患糖尿病的老年女性的OPG水平高于未患糖尿病的老年女性[4]。糖尿病患者的循环OPG水平与其微血管并发症、尿微量白蛋白水平[5]和神经病变[6]显著相关。以上研究表明OPG可能也参与了糖尿病的发病。对于妊娠妇女来说,胎盘是产生OPG的重要来源,在人类胎盘组织、胎膜及羊水中均存在OPG及OPGmRAN的表达。但有关OPG水平与妊娠糖尿病发病关系的研究国内外尚未见报道。本研究拟探讨OPG在正常糖耐量(normal glucose tolerance,NGT)组以及妊娠期糖尿病(gestational diabetes mellitus,GDM)组中的水平差异及其相关影响因素,以明确其与GDM发病的关系。
1 对象与方法
1.1 研究对象
经研究对象知情同意,从2010年4月~2011年3月在北京协和医院内分泌门诊常规产前检查的妊娠妇女中随机选取研究对象,合并自身免疫性疾病以及孕前已有糖耐量异常或2型糖尿病者均予排除。所有受试者于怀孕24~28周进行50 g葡萄糖筛查实验,1 h血糖大于7.8 mmol/L者继续进行100 g葡萄糖耐量实验(oral glucose tolerance test,OGTT),按照美国糖尿病诊断标准,空腹、1、2和3 h血糖阈值分别为:5.3、10.0、8.6 和7.8 mmol/L,其中任意两个点超过正常范围,诊断为妊娠期糖尿病,纳入GDM组;4点全部正常诊断为糖耐量正常,纳入NGT组。两组分别纳入65例研究对象。
1.2 研究方法
1.2.1 方法:测量身高,血压,记录怀孕前的体质量,计算孕前体质量指数(pre-BMI=体质量/身高2),并空腹抽取静脉5 mL置 EDTA抗凝管中,3 000 r/min离心5 min后留血浆。酶联免疫测定法测定真胰岛素(TINS);葡萄糖氧化酶法测定空腹血糖(FPG)(Olympus公司);微柱层析法测定糖化血红蛋白(HbA1c)(试剂由 Bio-Rd,INC公司);奥林巴斯全自动生化仪测定血脂各项指标(Olympus公司)。
1.2.2 ELISA测定OPG:酶联免疫法检测护骨素水平(Beneficical Solution,INC公司),批内变异系数为5.3%,批间变异系数为9.6%。
1.2.3 评价指标和计算公式:用HOMA指数来评估胰岛细胞功能(HOMA-B)和胰岛素抵抗(HOMAIR)。计算公式:HOMA-IR=FINS(mIU/L)×FBG(mmol/L)/22.5;HOMA-B=FINS(mIU/L)×20/(FPG-3.5)。
1.3 统计学分析
SPSS10.0软件进行统计分析,所有指标进行正态性检验后,服从正态分布的用均数 ±标准差(±s)表示,非正态分布的用中位数和四分位数间距表示。两组间均数的比较采用t检验或非参数检验。Person相关分析统计各项指标与OPG的关系。
2 结果
2.1 NGT和GDM组基本临床资料的比较
GDM组的年龄,收缩压,空腹血糖,空腹胰岛素,糖化血红蛋白,HOMA-IR,甘油三酯,载脂蛋白(a)均明显高于对照组(P<0.05),而HOAM-B、高密度脂蛋白和胆固醇则低于对照组(P<0.05)(表1)。
表1 研究对象临床和生化指标的比较Table 1 The comparision of clinical and metabolic characteristics of the subjects studied( ± s or medians,n=65)
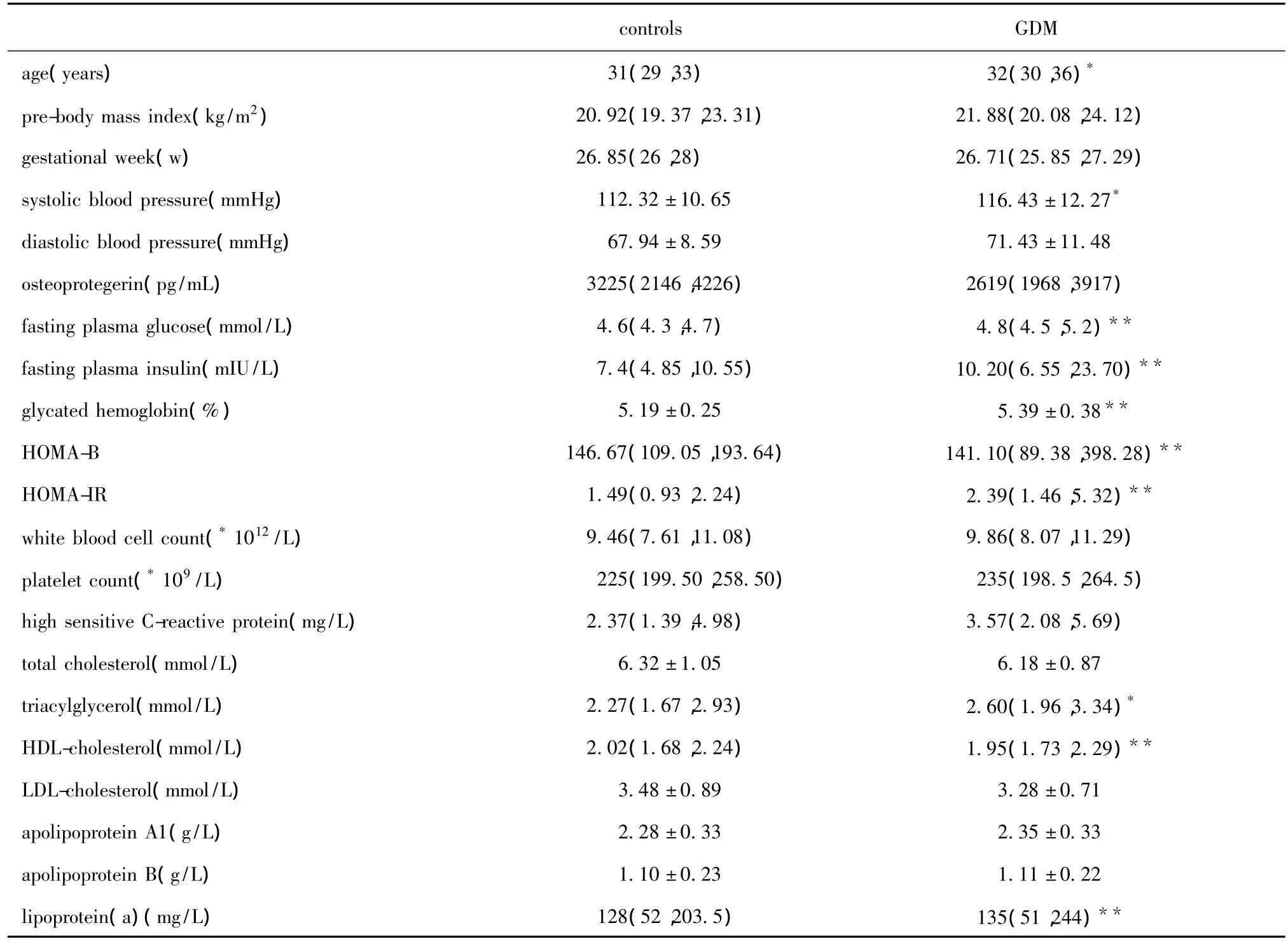
表1 研究对象临床和生化指标的比较Table 1 The comparision of clinical and metabolic characteristics of the subjects studied( ± s or medians,n=65)
*P <0.05,**P <0.01 compared with control.
controls GDM age(years) 31(29,33) 32(30,36)*pre-body mass index(kg/m2) 20.92(19.37,23.31) 21.88(20.08,24.12)gestational week(w) 26.85(26,28) 26.71(25.85,27.29)systolic blood pressure(mmHg) 112.32±10.65 116.43±12.27*diastolic blood pressure(mmHg) 67.94±8.59 71.43±11.48 osteoprotegerin(pg/mL) 3225(2146,4226) 2619(1968,3917)fasting plasma glucose(mmol/L) 4.6(4.3,4.7) 4.8(4.5,5.2)**fasting plasma insulin(mIU/L) 7.4(4.85,10.55) 10.20(6.55,23.70)**glycated hemoglobin(%) 5.19±0.25 5.39±0.38**HOMA-B 146.67(109.05,193.64) 141.10(89.38,398.28)**HOMA-IR 1.49(0.93,2.24) 2.39(1.46,5.32)**white blood cell count(*1012/L) 9.46(7.61,11.08) 9.86(8.07,11.29)platelet count(*109/L) 225(199.50,258.50) 235(198.5,264.5)high sensitive C-reactive protein(mg/L) 2.37(1.39,4.98) 3.57(2.08,5.69)total cholesterol(mmol/L) 6.32±1.05 6.18±0.87 triacylglycerol(mmol/L) 2.27(1.67,2.93) 2.60(1.96,3.34)*HDL-cholesterol(mmol/L) 2.02(1.68,2.24) 1.95(1.73,2.29)**LDL-cholesterol(mmol/L) 3.48±0.89 3.28±0.71 apolipoprotein A1(g/L) 2.28±0.33 2.35±0.33 apolipoprotein B(g/L) 1.10±0.23 1.11±0.22 lipoprotein(a)(mg/L) 128(52,203.5) 135(51,244)**
2.2 NGT和GDM组OPG水平的比较及OPG与临床指标的相关研究结果
统计结果提示,血浆OPG水平在GDM组是2 619(1 968,3 917)ng/L,在 NGT 组 是 3 225(2 146,4 226)ng/L,两组间无明显差异。按照ADA的诊断标准分层研究发现,在NGT组中,OPG与空腹胰岛素、HOMA-IR和血小板数3个指标呈正相关(P<0.01),与载脂蛋白 B呈负相关(P<0.05)。
3 讨论
本研究首次探讨了血浆OPG水平与GDM相关指标的关系。研究发现血浆OPG水平在GDM组和NGT组无明显差异,与以前的文献报道结果相似[7-8]。但另外一项研究认为,与体质量指数(body mass index,BMI)匹配的对照组相比,OPG水平在有GDM病史的妇女中是增加的[9],结果与我们的研究不同。可能是研究的人群不一样,每个人群所处的疾病阶段不同引起的。
本研究发现NGT组,OPG与空腹胰岛素以及HOMA-IR呈正相关,一定程度上支持了胰岛素抵抗与OPG水平的相关作用。而在GDM组OPG水平与胰岛素以及HOMA-IR不相关,可能是GDM组中其他影响胰岛素抵抗的作用因素掩盖了OPG对其的作用。目前研究表明,循环中OPG水平和胰岛素抵抗是否明确相关尚无定论[7,10]。有的研究并没有发现在代谢综合征患者中OPG水平的明显改变[11],但在肥胖的患者[12]和老年男性[13]血浆 OPG水平与胰岛素抵抗相关。正常血糖钳夹实验表明:胰岛素能使血浆OPG水平下降[14]。同时,体外培养的血管内皮细胞产生的OPG水平受到胰岛素敏感性及其作用的影响,用胰岛素增敏剂格列酮类药物和胰岛素均可减少血管平滑肌细胞产生OPG。胰岛素抵抗时OPG水平上升的机制,可能与外周胰岛素抵抗产生的胰岛素活性的下降导致了OPG的累积[10]有关。
本研究还发现,血浆OPG水平与血小板数存在明显的正相关,关于OPG和炎性反应之间的关系目前尚存在争议。研究报道有GDM病史的妇女血浆OPG水平和炎性因子超敏C反应蛋白(C-reactive protein,CRP)之间有着明显的相关性[8]。一项来自达拉斯心脏病学的研究同样发现血浆OPG水平和CRP明显相关。而在一项小样本的研究中并没有发现其与炎性标志物之间存在关系[15]。另一项研究发现有GDM病史的患者中,超敏C反应蛋白、纤维蛋白酶原以及OPG水平都是增加的[8]。而本研究并没有发现这种相关性。
大量研究报道循环中OPG水平与心血管危险因素以及动脉粥样硬化相关。在研究中发现OPG水平和载脂蛋白B有一定的相关性,而载脂蛋白是心血管危险因素之一。但未发现与其他血脂指标有明显相关性,鉴于研究样本量较少,因此本研究仅提示OPG有可能参与了脂代谢,需进行大样本量的研究以证实。
在糖耐量正常怀孕妇女中OPG可能参与了妊娠期的胰岛素抵抗和炎性反应。
[1]Simonet WS,Lacey DL,Dunstan CR,et al.Osteoprotegerin:a novel secreted protein involved in the regulation of bone density[J].Cell,1997,89:309 -319.
[2]Kim SM,L eet J,Ryu OH,et al.Serum osteop rotegerin levels are associated with inflammation and pulsew avevelocity[J].Clin Endocrinol,2005,63:594 -598.
[3]Jung CH,Lee WY,Kim SY,et al.The relationship between coronary artery calcification score,plasma osteoprotegerin level and arterial stiffness in asymptomatic type 2 DM[J].Acta Diabetol,2010,47:145 -152.
[4]Browner WS,Lui LY,Cummings SR.Associations of serum osteoprotegerin levels with diabetes,stroke,bone density,fractures,andmortality in elderlywomen [J].J Clin Endocrinol Metab,2001,86:631-637.
[5]Xiang GD,PU JH,Zhao LS,et al.Association between plasma osteoprotegerin concentrations and urinary albumin excretion in type 2 diabetes[J].Diabet Med,2009,26:397-403.
[6]Terekeci HM,Senol MG,Top C,et al.Plasma osteoprotegerin concentrations in type 2 diabetic patients and its association with neuropathy[J].Exp Clin Endocrinol Diabetes,2009,117:119 -123.
[7]Akinci B,Celtik A,Yuksel F,et al.Increased osteoprotegerin levels in women with previous gestational diabetes developing metabolic syndrome[J].Diabetes Res Clin Pract,2011,91:26-31.
[8]Akinci B,Demir T,Celtik A,et al.Serum osteoprotegerin is associated with carotid intima media thickness in women with previous gestational diabetes[J].Diabetes Res Clin Pract,2008,82:172 -178.
[9]Madarasz E,Tamas G,Tabak AG,et al.Osteoprotegerin levels in women with prior gestational diabetes mellitus[J].Diabetes Care,2009,32.
[10]Yaturu S,Rains J,Jain SK.Relationship of elevated osteoprotegerin with insulin resistance,CRP,and TNFalpha levels in men with type 2 diabetes[J].Cytokine,2008,44:168-171.
[11]Golledge J,Leicht AS,Crowther RG,et al.Determinants of endothelial function in a cohort of patients with peripheral artery disease[J].Cardiology,2008,111:51-56.
[12]Ugur-Altun B,Altun A,Gerenli M,et al.The relationship between insulin resistance assessed by HOMA-IR and serum osteoprotegerin levels in obesity[J].Diabetes Res Clin Pract,2005,68:217 -222.
[13]Gannage-Yared MH,Fares F,Semaan M,et al.Circulating osteoprotegerin is correlated with lipid profile,insulin sensitivity,adiponectin and sex steroids in an ageing male population[J].Clin Endocrinol(Oxf),2006,64:652 -658.
[14]Jorgensen GM,Vind B,Nybo M,et al.Acute hyperinsulinemia decreases plasma osteoprotegerin with diminished effect in type 2 diabetes and obesity[J].Eur J Endocrinol,2009,161:95 -101.
[15]Van Campenhout A,Golledge J.Osteoprotegerin,vascular calcification and atherosclerosis [J].Atherosclerosis,2009,204:321-329.
Comparision of plasma osteoprotegerin in women with gestational diabetes mellitus and normal glucose tolerance
SONG Ai-ling1,NIE Min1*,SUN Mei-li1,WANG Ying1,2
(1.Key Laboratory of Endocrine,Ministry of Health,Dept.of Endocrinology,PUMC Hospital,CAMS & PUMC,Beijing 100730;2.the Secondly Affiliated Clinical College,Dept.of Endocrinology,ShanXi Medical College,Taiyuan 030000,China)
ObjectiveTo determine the plasma osteoprotegerin(OPG)levels in pregnant women with gestational diabetes mellitus(GDM)and normal glucose tolerance(NGT)during their mid-late pregnancy,and to investigate the relationship between OPG and its involved factors.MethodsSixty-five women with GDM and 65 women with NGT were enrolled.Blood samples of each participant were collected during the 24~28 weeks of gestation and stored at-20℃ until use.Plasma concentration of OPG was measured by enzyme linked immunosorbent assay(ELISA).The level of fasting plasma glucose(FPG),fasting insulin(FINS),glycated hemoglobin(HbA1c),lipid,high-sensitivity C-reactive protein(hs-CRP),blood cell count,and calculated the homeostasis model assessment of beta-cell function(HOMA-B)and insulin resistance(HOMA-IR)were also measured.ResultsThe levels of plasma OPG in GDM and NGT groups were 2 619[1 968,3 917]and 3 225[2 146,4 226]ng/L.There was no significant different between the two groups.In the group of NGT,OPG levels were positively correlated with FINS(r=0.335,P<0.05),HOMA-IR(r=0.363,P<0.05),platelet count(r=0.333,P<0.05)and negatively related with apolipoprotein B(r= -0.254,P<0.05),but in GDM group,the relation between OPG and the biomarker mentioned above was not found.ConclusionsOPG may be involved in insulin resistance and inflammation during the pregnancy in women with NGT.
osteoprotegerin;gestational diabetes mellitus;fasting insulin
R 714.14
A
1001-6325(2012)01-0021-04
2011-09-28
2011-11-23
国家自然科学基金(81070630)
