PINK1参与调节多巴胺的合成
2012-06-05贾焕珍鲁玲玲龚普盛付越姣赵春礼段春礼
贾焕珍,鲁玲玲,龚普盛,付越姣,赵春礼,段春礼,杨 慧
(首都医科大学神经生物学系北京神经科学研究所北京市神经再生修复研究重点实验室神经变性病教育部重点实验室,北京 100069)
PINK1参与调节多巴胺的合成
贾焕珍,鲁玲玲,龚普盛,付越姣,赵春礼,段春礼,杨 慧*
(首都医科大学神经生物学系北京神经科学研究所北京市神经再生修复研究重点实验室神经变性病教育部重点实验室,北京 100069)
目的 探讨PINK1基因对多巴胺合成的调节作用。方法 用高压液相色(HPLC)电化学方法检测多巴胺(DA)含量,用Western blots和Real-Time PCR法检测DA合成限速酶酪氨酸羟化酶(TH)和多巴脱羧酶(DDC)的表达量,通过免疫共沉淀(Co-IP)和免疫组织化学染色观察PINK1和TH之间是否存在相互作用。结果PINK1基因敲减后,细胞内DA水平为5.356±0.536 μg/L,显著低于对照组的11.630±1.559 μg/L(P<0.05);TH mRNA和蛋白的表达分别为0.371±0.140和0.195±0.062,显著低于对照组的1.009±0.152和0.386±0.044(P<0.05);DDCmRNA和蛋白的表达分别为0.396±0.124和0.149±0.029,显著低于对照组的1.100±0.070和0.323±0.037(P<0.05);免疫荧光化学检测PINK1和TH存在共定位,Co-IP显示PINK1和TH存在相互作用。结论PINK1可以通过调控DA的合成酶TH和DDC的表达影响DA的合成。
PINK1;RNA干扰;酪氨酸羟化酶;MN9D细胞
帕金森病(Parkinson's Disease PD)是常见的中枢神经系统退行性病变,主要病理变化是中脑黑质致密部多巴胺能神经元的选择性变性和丢失,纹状体多巴胺(dopamine,DA)含量降低,进而引起运动功能障碍[1]。PINK1是已知与 PD相关的致病基因[2],PINK1突变可以引起遗传性 PD[3],而且有研究表明PINK1与散发性PD亦有密切关系[4]。因此,研究PINK1的功能,对于理解PD的发生有重要意义。
在果蝇模型中,PINK1突变可以引起部分脑区酪氨酸羟化酶(Tyrosine Hydroxylase,TH)阳性神经元的减少,以及DA含量的减少[5-6]。在斑马鱼模型中,PINK1功能缺失同样可以引起TH阳性神经元及 DA含量的下降[7-8]。同时 PINK1如何调控DA代谢没有相关报道。多巴胺能神经元的特性之一就是产生和分泌DA神经递质。该递质释放减少是导致PD症状的主要原因。因此,阐明PINK1与DA合成的关键限速酶TH之间的关系具有重要意义。
1 材料与方法
1.1 材料
动物:SD大鼠[首都医科大学动物部提供,等级:SPF,许可证编号SCXK(军)2007-004]。细胞:小鼠多巴胺能神经母细胞瘤细胞系(MN9D细胞),由Novartis公司Bastian Hengerer博士惠赠。引物合成(上海英骏生物技术有限公司北京测序部);Wizard Plus Midipreps DNA Purification systems(Promega公司);DMEM/F12培养基、胎牛血清(FBS)和胰蛋白酶(Gibco公司);RIPA裂解液(北京普利莱基因技术有限公司);TH,β-actin抗体(Sigma公司);PINK1 抗体[9],DDC 抗体 (Abcam 公司),Lipofectamine 2000,普通质粒小抽提试剂盒(Qigen公司),HRP标记的二抗购于KPL公司;荧光二抗购于Invitrogen公司。
1.2 细胞培养及转染
MN9D细胞采用含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM/F12培养基,置于37℃,5%CO2培养箱中培养。质粒转染按照Lipofectamine2000操作说明书进行。
1.3 高压液相色谱(HPLC)
MN9D细胞,转染48 h后,消化细胞,离心去上清,加入PBS洗2遍,细胞计数后,每组取5×106个细胞转移到新离心管中,离心取上清,加入HPLC裂解液,进行裂解,反复冻融2次,14 000 r/min,离心15 min后,取上清进行HPLC检测。
1.4 免疫组织化学染色
取正常培养的C57BL/6小鼠黑质部位脑片(40 μm),用 PBS 洗 3 遍,每次10 min,然后用0.03%PBST处理15 min。用5%山羊血清室温孵育1h,加入 anti-PINK1(1∶1 000)和 anti-TH 抗体(1∶10 000),4℃过夜,次日用 PBS洗3次,加入相应的FITC标记的羊抗兔(或鼠)免疫球蛋白抗体(1∶500),37℃避光孵育1 h,PBS冲洗 3 次,加入DAPI于37℃避光孵育5 min复染细胞核,PBS冲洗3次,封片后用共聚焦扫描显微镜观察。
1.5 Western blot检测
在MN9D细胞系中分别瞬时转染无关序列(对照组)和PINK1-shRNA(shRNA组),转染试剂选用Lipofectamine 2000,在转染后48 h提取全细胞蛋白,选用RIPA蛋白裂解液进行细胞裂解,BCA法测蛋白浓度,SDS PAGE电泳,半湿转法将蛋白转移至PVDF膜,8%脱脂牛奶封闭1 h,分别入 PINK1(1∶10 000)和 DDC(1∶1 000),TH(1∶10 000),β-actin(1∶5 000),4℃ 过夜。0.1%TBST洗膜 3次,入相应辣根过氧化物酶(HRP)标记的羊抗兔(或鼠)免疫球蛋白抗体中(1∶10 000),室温孵育1 h,洗膜同前。加入化学发光液,于暗室化学发光及显影、定影。
1.6 免疫共沉淀(Co-IP)
取SD大鼠黑质跟纹体组织,加入RIPA裂解液,匀浆,12 000 r/min离心,20 min,提全细胞蛋白进行免疫共沉淀实验。每个样品加入5 μL相应抗体(PINK1,TH,IgG)及1 mL Co-IP缓冲液,加入 IgG组作为空白对照,置于4℃旋转孵育12 h后均加入Protein G Agarose beads,于4 ℃轻轻旋转12 h,洗涤缓冲液漂洗后加入蛋白质上样缓冲液,95℃加热5 min,然后离心取上清,进行蛋白电泳。
1.7 Real-Time PCR检测基因表达水平
转染PINK1shRNA于MN9D细胞中,利用Trizol一步法提取(参照试剂盒说明书)总RNA,以oligo(dT)为引物进行反转录合成 cDNA。Real-Time PCR反应条件:50℃ 2 min;95℃ 2 min;95℃15 s,退火15 s,72℃ 45 s,共 40 个循环;72℃10 min。所用的引物为:小鼠β-actin上游引物:5'-AATCGTGCGTGACATCAAAGAG-3';下游引物:5'-GGCCATCTCCTGCTCGAA-3';小鼠 PINK1上游引物:5'-AGAAAACCAAGCGCGTGTCT-3';下游引物:5'-GGAAGCCCTGCCAGCAT-3';小鼠TH上游引物:5'-CGAGCTGCTGGGACACGTA-3';下游引物:5'-CT GGGAGAACTGGGCAAATG-3';小鼠 DDC上游引物:5'-CCGGCTAAAGGGCTCCAAT-3';下游引物:5'-TTTTGGCGCTGTTTATTCTTTG-3'。
1.8 统计学分析
所有实验数据均通过SPSS12.0统计软件进行t检验,数据用均数±标准差±s)表示。
2 结果
2.1 成功建立PINK1基因敲减的MN9D细胞模型
在shRNA组PINK1 mRNA和蛋白的表达均显著低于对照组。(P<0.05)(图1)。
2.2 PINK1基因敲减后,MN9D细胞中DA水平降低
shRNA组细胞DA含量为5.356±0.536 μg/L显著低于对照组的11.63±1.559 μg/L(P<0.05)。
2.3 PINK1基因敲减后,MN9D细胞中 TH的mRNA水平和蛋白水平均出现明显下调
在shRNA组TH mRNA和蛋白的表达均显著低于对照组(P<0.05)(图2)。
2.4 PINK1基因敲减后,MN9D细胞中DDC的mRNA水平和蛋白水平均出现明显下调
在shRNA组DDCmRNA和蛋白的表达均显著低于对照组(P<0.05)(图3)。
2.5 PINK1与TH在MN9D细胞存在共定位
PINK1与TH在MN9D细胞中存在共定位(图4)。
2.6 PINK1和TH之间可能存在相互作用
用TH抗体可以免疫沉淀PINK1蛋白,两者之间有相互作用(图5)。
3 讨论
PD的病理特征是多巴胺能神经元的选择性和进行性丢失。PINK1突变不仅可以引起家族性PD而且与散发性的PD密切相关,那么PINK1突变是如何引起多巴胺代谢异常,机理尚不清楚。本实验通过干扰PINK1基因的表达,成功建立干扰PINK1细胞模型。高压液相结果显示在PINK1shRNA组,DA水平显著降低。这与之前的文献报道结果相一致[11-12]。说明在本实验模型中PINK1参与调节多巴胺的生物合成。
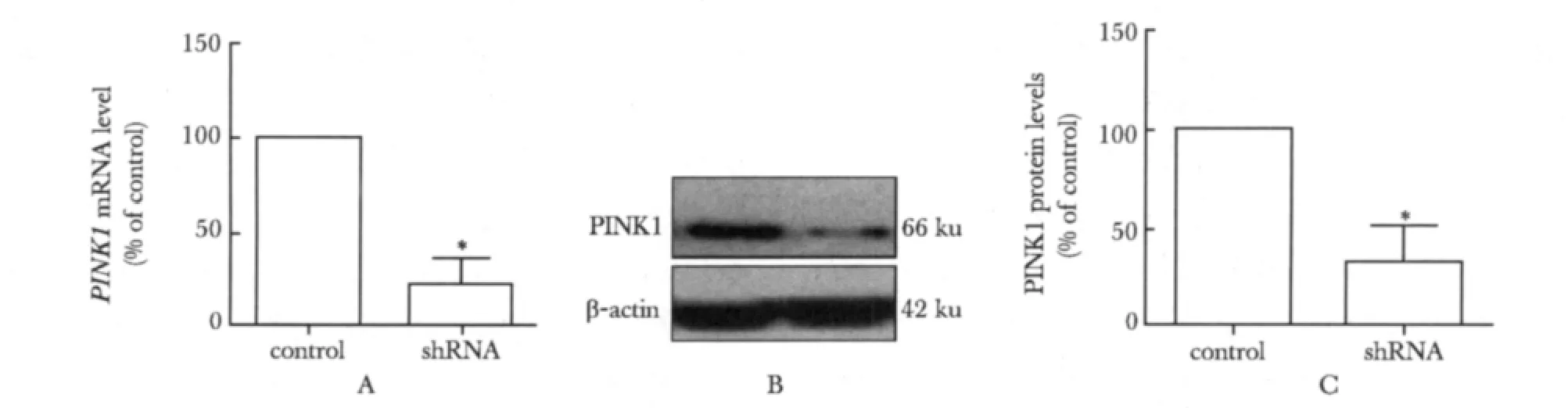
图1 用Real-time和western blot检测PINK1的干扰效率Fig 1 The interference efficiencies of PINK1-shRNA on PINK1 were detected by Real-time PCR and western blot
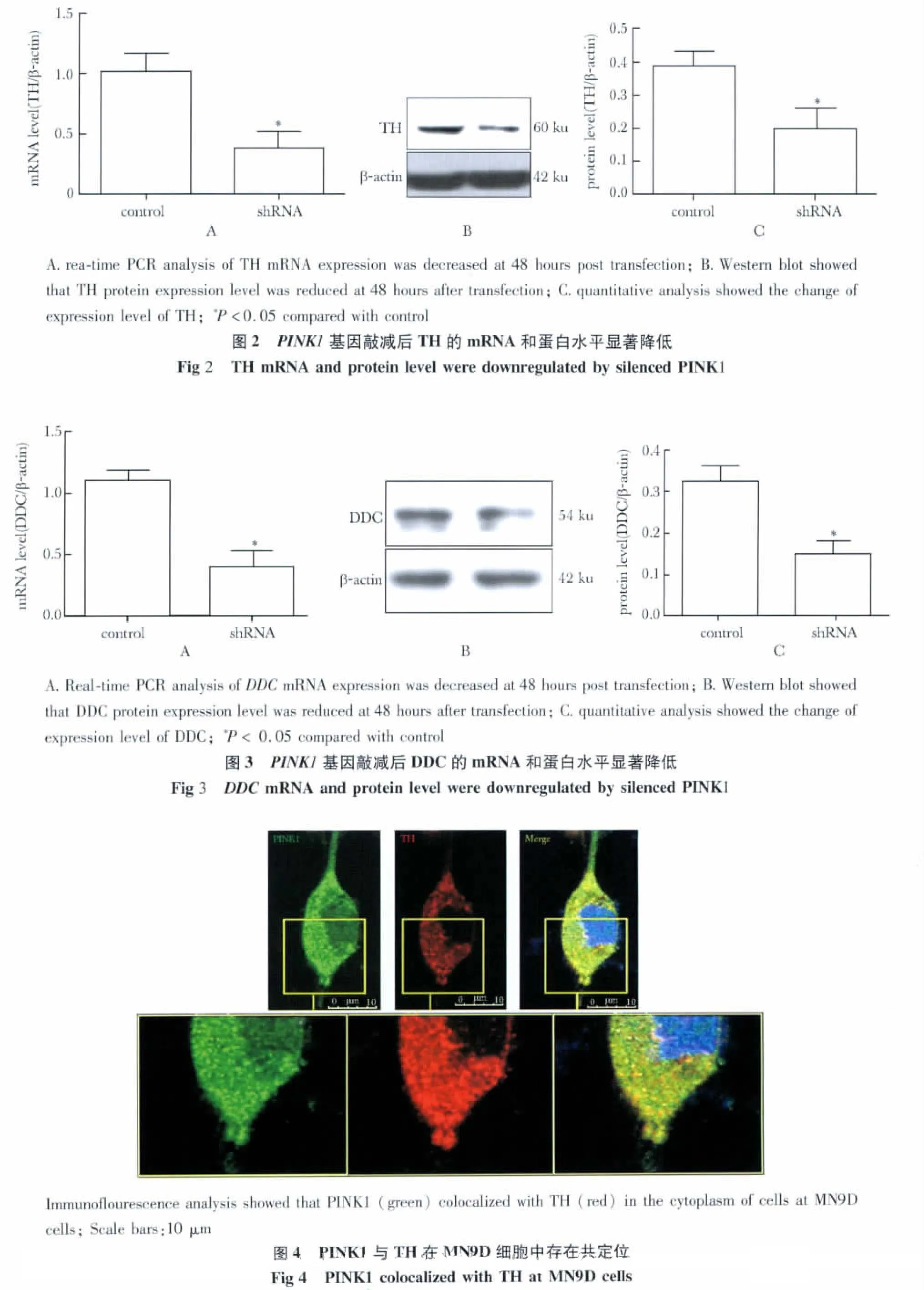
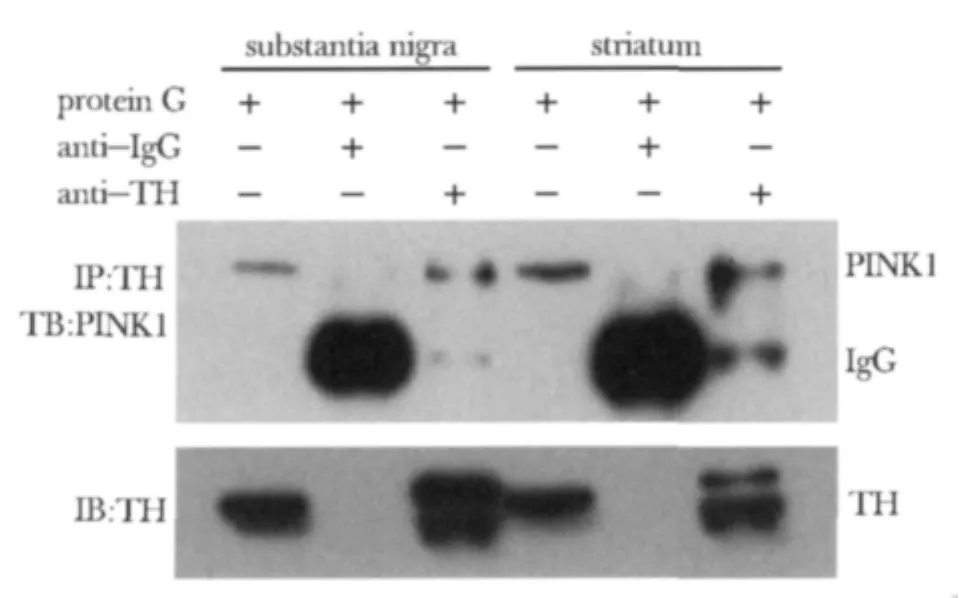
图5 PINK1与TH之间存在相互作用Fig 5 PINK1 associated with TH
DA合成过程中限速酶TH的活性和表达量的变化直接影响DA的变化,因此本实验进一步检测PINK1干扰之后TH的水平,结果显示TH无论是在mRNA水平还是蛋白水平均明显降低,说明PINK1可能是从转录水平来调节TH的表达,使其活性发生改变,与文献报道在果蝇[11]和斑马鱼[12]中干扰掉PINK1之后,DA水平和TH阳性神经元明显减低相一致,但是在转基因鼠中,敲减PINK1之后,DA水平下降,TH阳性神经元没有明显的降低[10],出现这样的结果可能是由于转基因鼠的代偿机制,某些蛋白的代偿作用使敲减PINK1的作用减弱,从而没有引起明显的表型,TH阳性神经元没有减少。
本研究同时检测了DA合成过程中的另一个酶DDC的变化,发现其在mRNA和蛋白水平明显降低。提示PINK1可能是通过同时影响DA合成过程中的两个酶TH与DDC的表达,来调节DA合成,其具体的调节机制,是本研究下一步的重点。
此外,由于PINK1是一个丝苏氨酸蛋白激酶,具有激酶的活性。而且也有相关的文献报道,Parkin是PINK1的底物,PINK1可以通过直接磷酸化Parkin影响其线粒体转位,所以PINK1可能通过直接与TH相互作用,使TH磷酸化进而影响其活性。本研究利用MN9D细胞进行免疫荧光双标记,发现PINK1和TH有共定位,同时Co-IP结果证实PINK1和TH存在一个共同体内,两者之间可能有相互作用。种种迹象表明PINK1可能是从慢速调节(TH表达量)和快速调节(TH的磷酸化修饰)双方面来调节TH的活性。当然,对于PINK1是否可以磷酸化TH,而改变TH的活性,最终影响DA的合成,目前仍不明确,将在今后的实验进行探讨。通过本研究,可以丰富我们对于PINK1生理功能的认识。此外,可能发现PINK1基因突变后导致PD发病的新线索,有助于理解PD发病,为临床PD治疗提供可能的药物作用靶点,因此具有潜在的临床应用价值。
[1]Dawson TM,Dawson VL.Molecular pathways of neurodegeneration in Parkinson's disease [J].Science,2003,302:819-822.
[2]Cui T,Fan C,Gu L,et al.Silencing of PINK1 induces mitophagy via mitochondrial permeability transition in dopaminergic MN9D cells[J].Brain Res,2011,1394:1 -13.
[3]Li Y,Tomiyama H,Sato K,et al.Clinicogenetic study of PINK1 mutations in autosomal recessive early-onset parkinsonism[J].Neurology,2005,64:1955-1957.
[4]Valente EM,Abou-Sleiman PM,Caputo V,et al.Hereditary early-onset Parkinson's disease caused by mutations in PINK1[J].Science,2004,304:1158-1160.
[5]Yang Y,Gehrke S,Imai Y,et al.Mitochondrial pathology and muscle and dopaminergic neuron degeneration caused by inactivation of Drosophila Pink1 is rescued by Parkin[J].Proc Natl Acad Sci,2006,103:10793 -10798.
[6]Park J,Lee SB,Lee S,et al.Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin[J].Nature,2006,441:1157-1161.
[7] Anichtchik O,Diekmann H,Fleming A,et al.Loss of PINK1 function affects development and results in neurodegeneration in zebrafish [J].The J Neuroscience,2008,28:8199-8207.
[8]Sallinen V,Kolehmainen J,Priyadarshini M,et al.Dopaminergic cell damage and vulnerability to MPTP in Pink1 knockdown zebrafish[J].Neurobiolo Dis,2010,40:93-101.
[9]Akundi RS,Huang Z,Eason J,et al.Increased Mitochondrial Calcium Sensitivity and Abnormal Expression of Innate Immunity Genes Precede Dopaminergic Defects in Pink1-Deficient Mice[J].Plos One,2011,6:e16038.
[10]李继胜,李尧华,李昕,等.人PINK1抗血清的制备及其免疫活性物质在大鼠脑组织中的表达[J].首都医科大学学报,2010,31:343-347.
The regulatory effects ofPINK1on dopamine biosynthesis
JIA Huan-zhen,LU Ling-ling,GONG Pu-sheng,FU Yue-jiao,ZHAO Chun-li,DUAN Chun-li,YANG Hui*
(Beijing Institute for Neuroscience,Beijing Center of Neural Degeneration and Repairing,Key Laboratory of Neurodegenerative Diseases,Capital Medical University,Beijing 100069,China)
ObjectiveTo explore the role forPINK1in the regulation of dopamine biosynthesis.MethodsThe dopaminergic MN9D cells were used as a cell model for the present study.PINK1gene was knockdown by RNAi technique.The dopamine(DA)level,mRNA and protein expression level of tyrosine hydroxylase(TH)and dopa decarboxylase(DDC)were then detected by HPLC with electrochemical detection,real-time RT-PCR or Western blots 48h later,respectively.The association between PINK1 and TH was observed with Co-IP and immunohistochemistry.ResultsWhenPINK1was silenced,DA content was 5.356 ±0.536 μg/L significantly lower than the control group of 11.630±1.559 μg/L(P<0.05),THmRNA and protein expression were 0.371±0.140 and 0.195±0.062 significantly lower than that of control group 1.009±0.152 and 0.386±0.044(P<0.05),DDCmRNA and protein expression were 0.396±0.124 and 0.149 ±0.029 significantly lower than that of control group 1.009±0.152 and 0.386±0.044,respectively(P<0.05).ConclusionsPINK1has a regulatory effect on dopamine biosynthesis,through its influence on TH and DDC.
PINK1;RNA interference;tyrosine hydroxylase;MN9D cells
R 742.5
A
1001-6325(2012)01-0016-05
2011-07-28
2011-11-23
国家重点基础研究发展计划(2011CB504103);国家自然科学基金(30970940);北京市教育委员会科技发展计划重点项目(KZ201010025022);北京市自然基金面上项目(5102012,5102007);北京市高校人才强教资助PHR(200907113)
*通信作者(corresponding author):huiyang0105@sina.com
