用组织贴壁法从整根脐带分离培养间充质干细胞及其生物学特性的检测
2012-06-05陶艳玲扈江伟
张 颢,张 斌,程 梅,陶艳玲,扈江伟,徐 曼,陈 虎*
(1.哈尔滨市第一医院哈尔滨血液病肿瘤研究所,黑龙江哈尔滨 150010;2.军事医学科学院附属医院造血干细胞移植科,北京 100071)
用组织贴壁法从整根脐带分离培养间充质干细胞及其生物学特性的检测
张 颢1,2,张 斌2#,程 梅1,陶艳玲1,扈江伟2,徐 曼2,陈 虎2*
(1.哈尔滨市第一医院哈尔滨血液病肿瘤研究所,黑龙江哈尔滨 150010;2.军事医学科学院附属医院造血干细胞移植科,北京 100071)
目的 建立从整根脐带分离培养间充质干细胞(UC-MSCs)的技术,并对其生物学特性进行检测。方法 用组织贴壁法分离UC-MSCs,并通过传代进行纯化和扩增培养,绘制生长曲线,用流式细胞仪检测UC-MSCs表面抗原及细胞周期;在特定诱导体系中,检测UC-MSCs向脂肪、成骨及软骨分化的潜能;用RT-PCR检测多能干细胞标志多能干细胞标志Oct-4,Sox-2,NanogmRNA水平。结果 成功建立了UC-MSCs分离培养的方法;贴壁细胞均表达CD73、CD90及 CD105,不表达造血细胞表型CD34、CD45和HLA-DR;细胞倍增时间为(24.04±0.49)h,G0~G1期和S+G2+M期所占比例分别为81.56%和18.44%;UC-MSCs能够向脂肪、成骨和软骨分化;表达Oct-4,Sox-2,Nanog基因。结论 组织贴壁法是一种较好的分离培养UC-MSCs的方法,培养的细胞为更原始的间充质干细胞,增殖能力强。
脐带;间充质干细胞;分化
*通信作者(corresponding author):chenhu217@yahoo.com.cn
#共同第1作者
间充质干细胞(mesenchymal stem cells,MSCs)是一类成体干细胞,主要来源于骨髓,具有重要的应用价值,如治疗移植物抗宿主病等[1]。脐带来源广泛,病毒感染机会小,无伦理问题,对供者无不良影响,克服了骨髓源MSCs随年龄增长而分化能力下降等特点,使人脐带MSCs可能替代骨髓源MSCs,成为MSCs的主要来源之一[2]。许多学者从脐带中分离出MSCs,一般采用酶蛋白消化法,存在着操作繁琐、污染机率增加、细胞损伤较大及成本高等缺点[3-4],因此寻找更为简洁的分离培养的方法成为必要。本研究采用组织贴壁法从整根脐带中分离MSCs,并对其进行生物学特性研究,以探讨脐带间充质干细胞(umbilical cord mesenchymal stem cells,UC-MSCs)更为理想的分离培养方法,为MSCs库的建立及临床应用奠定坚实的基础。
1 材料与方法
1.1 材料与试剂
脐带来源于哈尔滨市第一医院产科,经产妇同意后(签定知情同意书),无菌条件下剖宫产的足月健康新生儿取得。Ⅱ型胶原酶、DMEM/F12培养基和胎牛血清(Gibco公司);地塞米松、吲哚美辛、胰岛素、β-甘油磷酸钠和抗坏血酸(Sigma公司)。PE标记的CD105、CD73和FITC标记的CD34、CD45、CD90和HLA-DR抗体及其相应同型对照(Becton Dickinson公司)。
1.2 UC-MSCs分离培养
取上述脐带组织,PBS反复冲洗去除血迹,将脐带组织剪碎至1 mm3大小,置于培养皿中,于培养皿壁加入含10%胎牛血清、100 ku/L青霉素、100 mg/L链霉素的DF-12完全培养液,置37℃、5%CO2,饱和湿度培养箱培养,每3天添加1次完全培养液,10 d后弃去脐带组织和培养上清后全量换液,每3~4天全量换液,观察细胞至80%汇合时,0.25%胰蛋白酶1 mmol/L EDTA 消化,按1∶3传代。
1.3 UC-MSCs免疫表型的鉴定
取第3代处于对数生长期 UC-MSCs,按每管1×105个细胞,依次加入10 μL鼠抗人单克隆抗体PE标记的CD105、CD73,和FITC 标记的CD34、CD45、CD90和HLA-DR抗体及其相应同型对照标记细胞,室温避光30 min;用PBS洗2~3次,流式细胞仪检测。
1.4 生长曲线绘制
将贴壁细胞用0.25%胰蛋白酶消化后,按2 ×104个/孔接种在24孔板内,每隔24 h消化3个孔,收集细胞,并用0.4%的台盼蓝计数活细胞,绘制生长曲线。
1.5 细胞周期检测
在细胞生长的对数期,消化细胞,4℃冷70%乙醇固定并透膜24 h,10 mg/L的RNase A 37℃孵育30 min,加入50 mg/L碘化丙啶4℃避光孵育5 min,流式细胞仪检测,ModiFIT软件分析结果。
1.6 向脂肪细胞诱导分化
细胞以2×104/孔的密度接种于6孔板,诱导分化体系为含10%胎牛血清、10-6mol/L地塞米松、100 mg/L 1-甲 基-3-异 丁 基-黄 嘌 呤 (IBMX)、50 mg/L抗坏血酸的IMDM培养基。每3天半量换液1次。倒置显微镜下观察脂肪滴的形成,第14天采用油红O染色检测脂肪滴。
1.7 向成骨细胞诱导分化
细胞以2×104/孔的密度接种于6孔板,诱导分化体系为含1×10-8mol/L地塞米松,2×10-4mol/L抗坏血酸,7 ×10-3mol/L β-磷酸甘油的 IMDM 培养基,每3天半量换液1次。第14天用Von Kossa染色检测钙化基质沉淀。
1.8 向软骨细胞诱导分化
收集第3代细胞,取2×105个细胞放于10 mL塑料管内,1 500 r/min,离心10 min,弃上清液,加入0.5 mL软骨诱导培养液,软骨诱导分化体系为添加10%胎牛血清、1%ITS(胰岛素、转铁蛋白、硒)+1、0.1 μmol/L地塞米松、50 μmol/L抗坏血酸磷酸盐、1 mmol/L丙酮酸钠、10 μg/L TGF-β3 的高糖 DMEM培养基。每3天全量换液,培养3周后,石蜡包埋,切片,进行甲苯胺蓝染色鉴定。
1.9 多能干细胞分子标志检测
收集第3代UC-MSCs,按照Trizol说明书提取细胞总RNA,取上述RNA样品1 μL进行反转录反应,反应体系为20 μL,反应条件为30℃ 5 min,42℃ 40 min,95℃ 5 min。取反转录产物5 μL进行PCR扩增,检测多能干细胞标志基因Oct-4、Sox-2、NanogmRNA表达水平。Oct-4 Sox-2,Nanog,和内参β-actin所用引物序列,退火温度及产物长度(表1)。PCR扩增产物经1.5%琼脂糖凝胶电泳,凝胶图像分析系统分析。
2 结果
2.1 UC-MSCs形态学观察
培养7~10 d左右有少量细胞沿组织块周边爬出,倒置显微镜可见贴壁细胞呈梭形、多角形。16~21 d以后增长速度增快,可见成纤维细胞样集落形成,此后增生成为形态相对均一的梭形细胞,呈平行排列生长或旋涡状生长,于第3周可形成大于80%汇合贴壁细胞层(图1)。

表1 引物序列、退火温度及PCR扩增产物长度Table 1 Primer sequences,primer annealing temperatures and sizes of PCR products
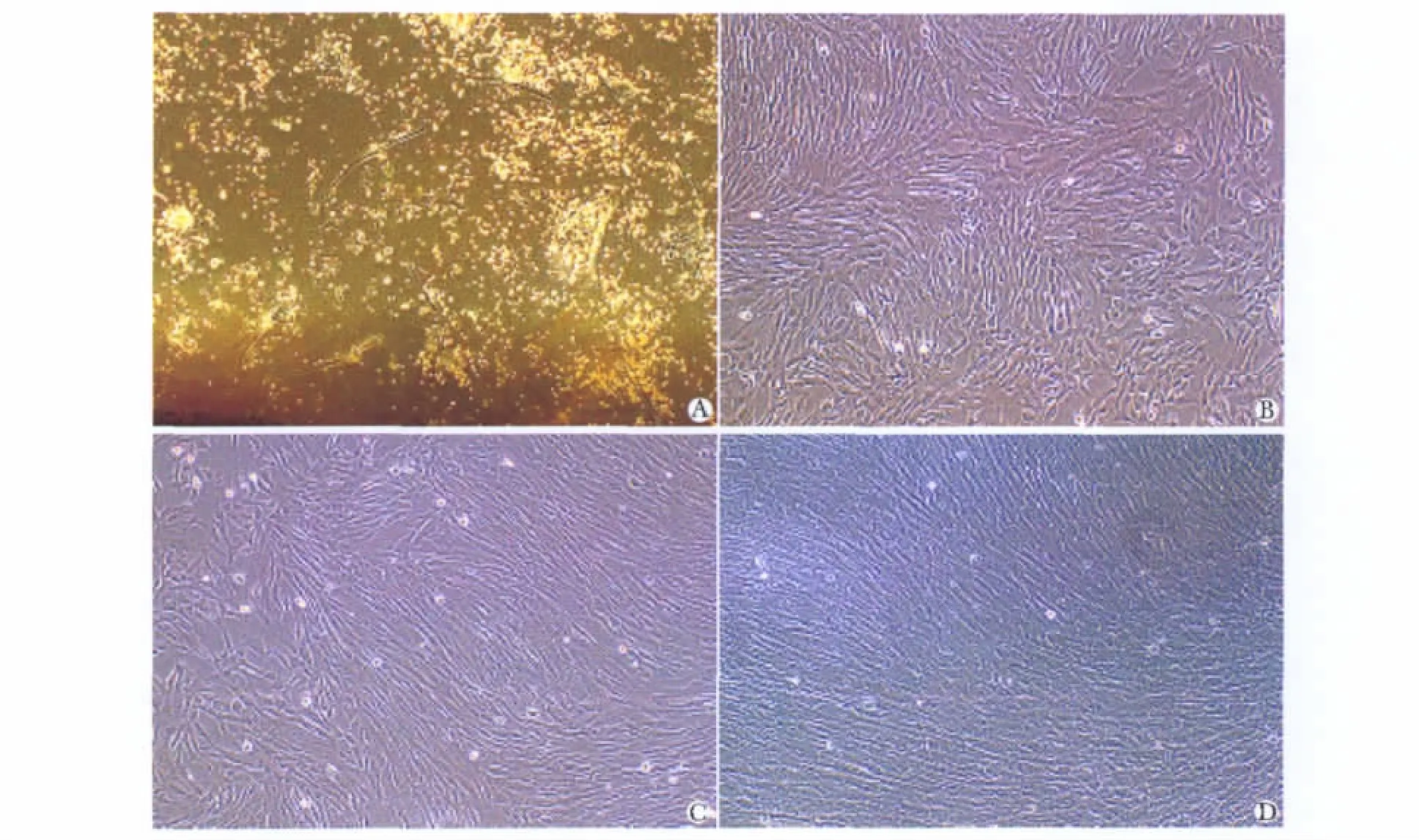
图1 原代脐带间充质干细胞体外培养形态学变化过程Fig 1 The morphology of UC-MSCs at primary passsage in vitro(×100)
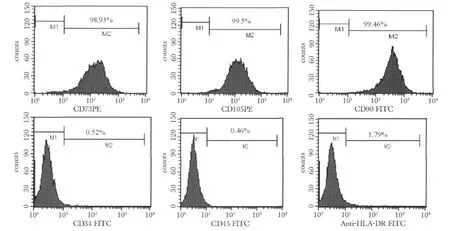
图2 P3代UC-MSCs免疫表型Fig 2 Imumunophenotype of UC-MSCs at P3
2.2 UC-MSCs的免疫表型分析
贴壁细胞均表达CD105、CD73和CD105,不表达造血细胞表型CD34、CD45和HLA-DR,由此初步说明,从脐带分离出来的贴壁细胞为间充质干细胞(图2)。
2.3 UC-MSCs的生长曲线
UC-MSCs生长曲线基本符合细胞生长曲线规律,分为潜伏期、对数期、平台期,分别为1、2~6和7 d后。提示UC-MSCs在体外增殖相对稳定,生长状态无异常。细胞增殖较快,在对数生长期,细胞倍增时间均约为(24.04±0.49)h(图3)。
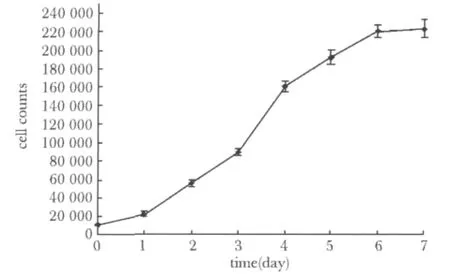
图3 P3代脐带间充质干细胞生长曲线Fig 3 Growth curve of UC-MSCs at passage 3
2.4 UC-MSCs的细胞周期分析
UC-MSCs的细胞周期分析:81.56% 细胞在G0~G1期和18.44%细胞在S+G2+M期(图4)。

图4 P3代UC-MSCs的细胞周期Fig 4 Cell cycle analysis of UC-MSCs at passage 3
2.5 UC-MSCs的的分化潜能
脂肪诱导7 d倒置显微镜下即可见胞浆有脂滴形成,第14天油红-O染色呈强阳性(图5A);成骨诱导第14天实验组茜红素阳性(图5B);软骨诱导分化3周,甲苯胺蓝染色阳(图5C)。
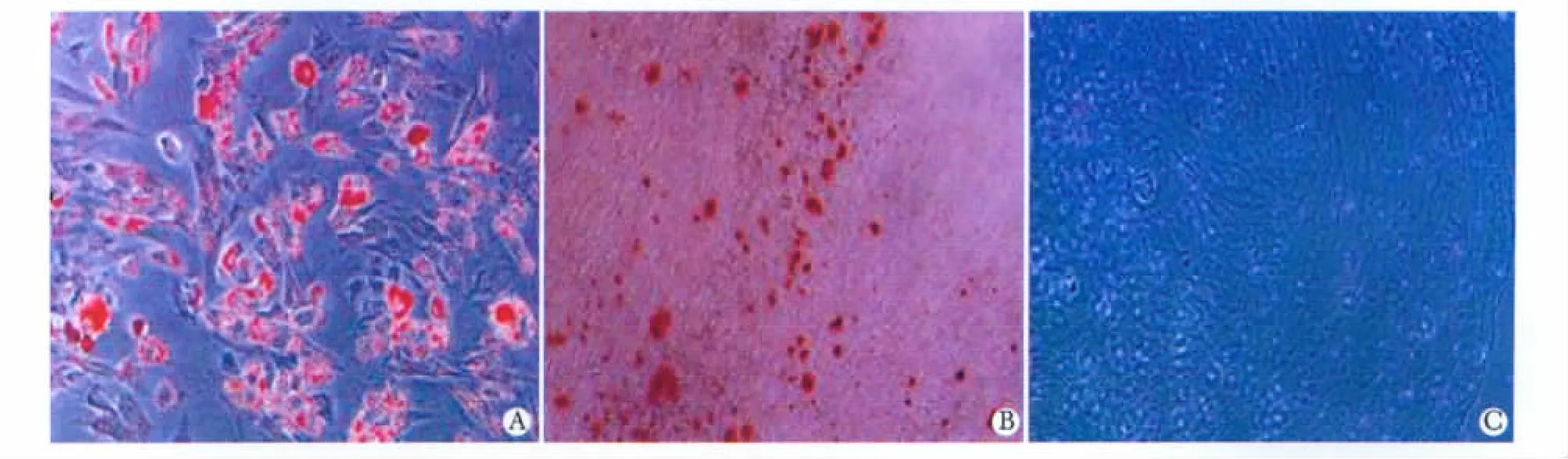
图5 P3代UC-MSCs的多向分化潜能Fig 5 Multidifferentiation potential of UC-MSCs at passage 3
多能干细胞分子标志第3代UC-MSCs表达多能干细胞的标志Oct-4,Sox-2,NanogmRNA水平(图6)。
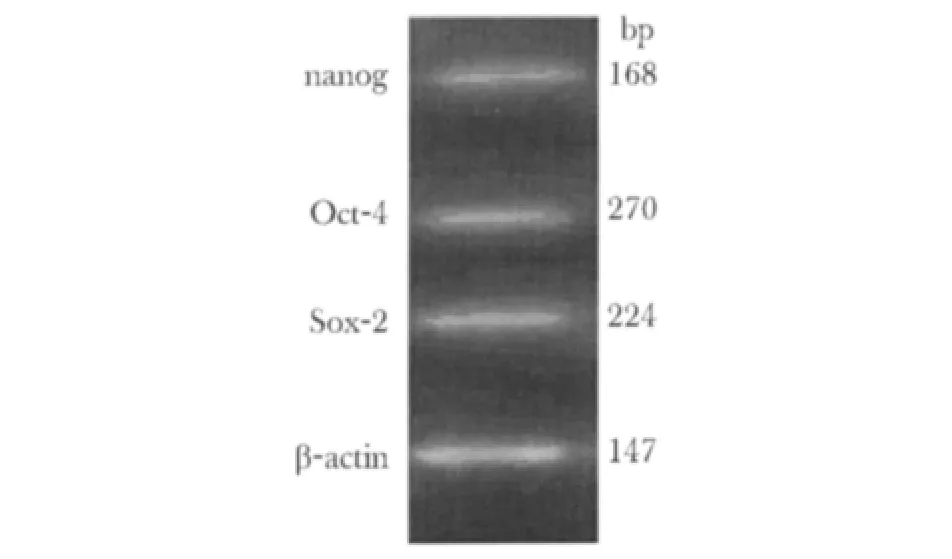
图6 P3代UC-MSCs Nanog,Oct-4,Sox-2 mRNA表达Fig 6 Evaluation of pluripotent markers Nanog,Oct-4,Sox-2 mRNA abundance by RT-PCR
3 讨论
近年来研究表明MSCs具有免疫调节及组织损伤修复等功能,有望在临床治疗移植物抗宿主病、自身免疫性疾病、组织修复等疾病。研究表明脐带成为间充质干细胞新的来源,具有很大的应用前景,因此寻找一种新的分离方法成为许多学者研究的热点[5-8]。本研究采用脐带组织贴壁法成功从整条脐带分离出MSCs。采用本方法分离的原代细胞多于7~10 d从剪碎脐带组织爬出,呈梭形、多角形,于第3周左右可形成大于80%汇合贴壁细胞层。连续传20代,细胞形态无明显改变。细胞形态具有均一地成纤维细胞形态,增殖能力强。15代内细胞表面标志无明显改变,表达CD73、CD90和CD105,不表达CD34、CD45和HLA-DR,这与骨髓源 MSCs表型一致[9]。大部分MSCs为早期细胞,具有典型的干细胞增殖特点。生长曲线绘制显示细胞增殖较快,在对数生长期,细胞倍增时间短于成人骨髓源地MSCs[10],表明脐带MSCs有更强地增值能力,为短期内扩展出临床所需要的细胞提供了保障。
MSCs的鉴定尚无特异性的表面标志,除免疫表型外,还要研究其多向分化能力(成脂肪、成骨和成软骨分化)。在特定地诱导体系下,UC-MSCs能够向脂肪、成骨和软骨细胞分化,表明其具有多向分化潜能,证实了从脐带所分离出来的细胞为MSCs,符合间充质干细胞国际定义标准[11]。
研究表明胚胎干细胞表达多能干细胞标志,如Oct-4 Nanog和Sox-2,它们能够维持细胞的未分化多能性及多向分化潜能,其表达下降能够导致干细胞失去多能性及自我更新[12]。本研究发现该组织贴壁法分离出来的UC-MSCs表达Oct-4、Nanog及Sox-2,这表明UC-MSCs具有更原始的多能干细胞特性,这可能为说明UC-MSCs增殖能力强的原因之一,因此组织贴壁法能够分离出更为原始的UC-MSCs。
总之,组织贴壁法为一种从整根脐带中分离培养MSCs简单有效的方法,克服了酶消化法一些缺点,具有更强的增殖能力,且能够体外稳定培养,为建立间充质干细胞库及其临床应用奠定了理论依据。
[1]宋丽,陈嘉林.间充质干细胞免疫调节作用及其在自身免疫病中的意义[J].基础医学与临床,2009,29:1221-1223.
[2]范存刚,周景儒,张庆俊.人脐带间充质干细胞的生物学性质研究进展[J].基础医学与临床,2010,30:215-217.
[3]Lu LL,Liu YJ,Yang SG,et al.Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J].Haematologica,2006,91:1017-1026.
[4] Balamurugan AN,He J,Guo F,et al.Harmful delayed effects of exogenous isolation enzymes on isolated human islets:relevance to clinical transplantation[J].Am J Transplant,2005,5:2671 -2681.
[5]Le Blanc K,Frassoni F,Ball L,et al.Mesenchymal stem cells for treatment of steroid-resistant,severe,acute graftversus-host disease:a phase II study[J].Lancet,2008,371:1579-1586.
[6]Liang J,Zhang H,Hua B,et al.Allogenic mesenchymal stem cells transplantation in refractory systemic lupus erythematosus:a pilot clinical study[J].Ann Rheum Dis,2010,69:1423-1429.
[7]Ringden O,Uzunel M,Sundberg B,et al.Tissue repair using allogeneic mesenchymal stem cells for hemorrhagic cystitis,pneumomediastinum and perforated colon[J].Leukemia,2007,21:2271 -2276.
[8]Cooper K,Viswanathan C.Establishment of a mesenchymal stem cell bank[J].Stem Cells Int,2011:DOI:10.4061/905621.
[9]胡建立,李静,陈斌,等.成人AB型血清取代胎牛血清在体外有效扩增骨髓间充质干细胞.基础医学与临床[J].2010,30:576-581.
[10]Sung HJ,Hong SC,Yoo JH,et al.Stemness evaluation of mesenchymal stem cells from placentas according to developmental stage:comparison to those from adult bone marrow[J].J Korean Med Sci,2010,25:1418 -26.
[11]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal cells.The Inte,et al.rnational Society for Cellular Therapy position statement[J].Cytotherapy,2006,8:315 -317
[12]Digirolamo CM,Stokes D,Colter D Optimization of culture conditions to support undifferentiated growth of human embryonic stem cells[J].Cell Reprogram,2010,12:305-314.
Isolation and characterization of mesenchymal stem cells derived from whole human umbilical cord by applying a direct explant technique
ZHANG Hao1,2,ZHANG Bin2#,CHENG Mei1,TAO Yan-Ling1,HU Jiang-Wei2,XUN Man2,CHEN Hu2*
(1.Harbin Institute of Hematology & Oncology,First Hospital of Harbin,Harbin 150010;2.Dept.of Hematopoietic Stem Cell Transplantation,the Affiliated Hospital to Academy of Military Medical Sciences,Beijing 100071,China)
ObjectiveTo establish a technique for isolating mesenchymal stem cells from umbilical cord and their biological characteristics.MethodsMesenchymal stem cells(MSCs)were isolated from umbilical cord(UC)by applying a explant technique and explanding culturedin vitro.Growth curves were drawn,and The phenotypes and cell cycle were evaluated by flow cytometry.UC-MSCs were induced to differentiate into adipocytes,osteocytes and chondrocytes in special differentiation condition.Mutidifferentiation related genes and stem cell-related transcription factors,Nanog,Oct-4 Sox-2were detected by TR-PCR.ResultsUC-MSCs were isolated using a explant technique,and characteristic of plastic adherence and fibroblast-like morphology.the adherent cells displayed an abundant presence of CD73,CD90,CD105 and absence of CD34,CD45,HLA-DR.Cell cycle showed that there were percentages of stem cells as G0/G181.56%and S+G2+M 18.44%respectively.When cultured in differentiation media,they differentiated into adipocytes,osteocytes and chondrocytes.RT-PCR reactions confirmed that their mutidifferentiation related genes were positive.Moreover,stem cell-related transcription factors,Nanog,Oct-4 Sox-2were positively expressed in UC-MSCs.ConclusionsThe explant technique is a feasible method to obtain MSCs from whole human umbilical cord,and UC can be considered as a novel and convenient source of adult MSCs displaying primitive pluripotent sten cells and high expansion potential.
umbilical cord;mesenchymal stem cell;differentiation
R 331.22
A
1001-6325(2012)01-0071-06
2011-10-13
2011-11-28
国家高技术研究发展计划项目(863项目)(2011AA020114);军队临床高新技术重大项目(2010gxjs100);黑龙江省卫生厅科研课题(2011-518);首都临床特色应用研究(Z111107058811107);哈尔滨市科技创新人才研究专项基金(2009RFQQS027);
book=76,ebook=129
