引入易错PCR和DNA-shuffling技术构建单链抗体库
2012-06-05杨青平查成喜韩跃武
杨 浩,杨青平,查成喜,韩跃武*
(1.兰州大学基础医学院;2.甘肃省第三人民医院内分泌科,甘肃兰州 730000)
引入易错PCR和DNA-shuffling技术构建单链抗体库
杨 浩1,杨青平2,查成喜1,韩跃武1*
(1.兰州大学基础医学院;2.甘肃省第三人民医院内分泌科,甘肃兰州 730000)
目的 引入易错PCR和DNA-shuffling技术构建高库容量的单链抗体库。方法 收集不同年龄、性别、健康状态的人的静脉血各5 mL,提取单个核细胞总RNA,反转录为cDNA,PCR扩增VH和VL基因,应用易错PCR对VH和VL基因进行突变,同时用DNA-shuffling技术对全长单链抗体基因进行体外改组,获得的分子与T载体连接,转化E.coliDH5α,选取阳性克隆,经菌落PCR后酶切鉴定抗体库多样性,计算分析单链抗体库容量。结果 成功构建了库容量为4.37×1013的单链抗体库,经酶切鉴定,初步判定抗体库多样性良好。结论 引入易错PCR和DNA-shuffling技术,成功构建了单链抗体库,为后续筛选高亲和力抗体奠定了实验基础。
易错PCR;DNA-shuffling;单链抗体库
*通信作者(corresponding author):hanyuewu730000@163.com
单链抗体(single chain Fv,scFv)作为重要的基因工程抗体,是利用基因工程方法将抗体重链可变区(VH)和轻链可变区(VL)通过一段约5~25个氨基酸的连接肽(Linker)首尾拼接而形成的重组蛋白,具有很好的应用前景。但是,目前在构建单链抗体的过程中,往往因为抗体库的库容量不高导致筛选出的抗体的亲和力较低,影响抗体的功能[1]。本研究旨在构建高库容量的单链抗体库,为后续筛选高亲和力抗体奠定基础,也为构建高库容量核糖体展示单链抗体库提供依据。
1 材料与方法
1.1 材料
1.1.1 载体、菌株及细胞系:pUCm-T载体(上海生工生物工程技术服务有限公司),大肠杆菌E.coliDH5α(华美生物工程公司),基因型 SupE44△lacμ169(80lacZ △M15)hsdR17recAgyrA96thirelAl。
1.1.2 酶类和生化试剂:质粒抽提试剂盒、dNTP、限制性内切酶BstNI、DNaseI等(上海生工生物工程技术服务有限公司),Trizol试剂、快速DNA连接及转化试剂盒[宝生物工程(大连)有限公司]。
1.1.3 PCR引物设计:引物设计参考V-base(http://vbase.mrc-cpe.cam.ac.uk/)通用引物及文献[2],用Primer Premer5.0加以适当修改,引物合成由上海生工完成。连接肽引物:正向:5'-TCAGGTG GAGGCGGTTCTGGCGGAGGTGGCTCAGGCGGTGGA GGCTCG-3',反向:5'-CGAGCCTCCACCGCCTGAGC CACCTCCGCCAGAACCGCCTCCACCTGA-3',scFv 单链抗体引物:Cκ上游引物:5'-ACTGTGGCTGCACCA TCTG-3',Cκ下游引物:5'-ACACTCTCCCCTGTTGAA GCT-3',scFvf:5'-ATCGACGCTATCGCGGCCCAGCC GGCCCAGGT-3',scFvD:5'-GCTCAGAACACTCTCCC CTGTTGAAGCT-3',scFvU:5'-GCAGCTAATACGACT CACTATAGGAACAGACCACCATGGTCGACGCTATC GCGGCCCAGCCGGCCCAGGT-3',易错PCR引物 VHep上游引物:5'-ATCGACGCTATCGCGGCCCAGCC GGCCCAGGT-3',VHep 下游引物:5'-TCCGCCAGAA CCGCCTCCACCTGACTCGCACAGTAATACACGGC-3',Vκep上游引物:5'-GGTGGCTCAGGCGGTGGAGGC TC-3',Vκep 下游引物:5'-CAGATGGTGCAGCCACA GTCAGGCTGCTGATTGTGAGAG-3',Vλep 上游引物:5'-G GTGGCTCAGGCGGTGGAGGCTC-3',Vλep 下游引物:5'-CAGATGGTGCAGCCACAGTACCTAGGACG GTGACCTTGGTCCC-3'。
1.2 方法
1.2.1 人外周血淋巴细胞的分离与总RNA的提取:收集不同年龄组、不同性别及不同健康状态的人的静脉血各5 mL,用淋巴细胞分离液分离外周血淋巴细胞。PBS洗涤分离后的外周血淋巴细胞,计数,参照Trizol试剂使用说明,按108cells/mL Trizol的比例,提取人外周血淋巴细胞总RNA。提取后的总RNA用DEPC处理过的去离子水溶解,经过1.5%琼脂糖凝胶电泳判断RNA完整性,测定浓度,用于反转录。
1.2.2 人VH、VL和Cκ基因的扩增:以总RNA为模板,Oligo(dT)15为引物,在反转录酶作用下反转录合成cDNA第1条链。以cDNA第1链为模板,以不同亚型的重链及轻链的引物分别扩增人重链和轻链可变区基因。以Cκ引物扩增人恒定区基因。VH、Vκ扩增条件为:预变性94℃ 5 min;变性94℃30 s,退火69℃ 30 s,延伸72℃ 30 s,共30个循环;延伸72℃ 10 min。Vλ扩增条件为:预变性94℃5 min;变性94℃ 30 s,退火66℃ 30 s,延伸72℃30 s,共30个循环;延伸72℃ 10 min。Cκ扩增条件为:预变性94℃ 5 min;变性94℃ 30 s,退火43℃30 s,延伸72℃ 30 s,共 30 个循环;延伸72℃10 min。将PCR产物进行1.5%琼脂糖凝胶电泳,切胶回收目的片段。
1.2.3 VH和VL的易错PCR:取适量VH和VL进行易错 PCR。PCR 反应体系为50 μL,包括20 μmol/L上、下游引物各0.5 μL,5 U/L的 Taq 酶0.5 μL,10 ×易错 PCR 缓冲液(mmol/L:Tris-HCl(pH 7.4)100、KCl 500、MgCl260、MnCl20.5,0.1%(w/v)明胶)5 μL,10 × 易错 PCR dNTPs(mmol/L:dATP 2、dGTP 2、dCTP 10、dTTP 10)5 μL。扩增条件同上。
1.2.4 DNA-shuffling:采用重叠延伸 PCR[3]获得全长单链抗体后,对单链抗体进行体外改组实验。
1)DNaseⅠ消化改组模板
取3 μg单链抗体做为改组模板,于100 μL反应体系中进行碎片化处理。体系中含50 mmol/L Tris-HCl(pH 7.4)、1 mmol/L MgCl2、0.3 U DNaseⅠ。然后16℃ 反应15 min,100℃ 水浴加热10 min,使DNaseⅠ失活,降解片段经2%琼脂糖凝胶电泳,回收50~100 bp片段。
2)无引物PCR
将得到的小片段产物进行无引物PCR,反应体系为20 μL,体系中含 mmol/L:KCl 50、Tris-HCl 10(pH 9.0)、MgCl21.5,200 μmol/L 4 种 dNTP 和3 U Taq DNA聚合酶。PCR扩增条件为:预变性94℃3 min;变性94℃ 30 s,退火42℃ 30 s,延伸72℃30 s,共55个循环;延伸72℃ 10 min。PCR产物用2%琼脂糖凝胶电泳进行检测。
3)有引物PCR
取5 L无引物PCR获得的产物,在上述相同的反应体系中,用引物scFvU和scFvD进行PCR反应。扩增条件为预变性94℃ 3 min;变性94℃1 min,退火60℃ 1 min,延伸72℃ 1 min,共 30个循环;延伸72℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳进行检测。
1.2.5 单链抗体文库的构建:用CaCl2法制备大肠杆菌DH5α感受态细胞,利用快速DNA连接及转化试剂盒做DNA连接及转化。37℃过夜培养,经蓝白筛选,获得阳性克隆。
1.2.6 抗体库库容量及多样性分析:随机挑取6个阳性菌落分别放在含有20 μL 0.1%Triton X-100的离心管中,100℃、2 min水浴后,用引物 scFvU和scFvD进行PCR反应,条件同前,用1.5%琼脂糖凝胶电泳检测相应扩增条带。测定实验中获得的单链抗体的浓度,参照文献[4]计算抗体库库容量。随机挑取的6个阳性菌落PCR扩增scFv基因片段经1.5%琼脂糖凝胶电泳后进行切胶回收,用BstNI酶切scFv基因片段,4%琼脂糖凝胶电泳分析酶切指纹图谱,分析scFv基因片段多样性。
2 结果
2.1 总RNA的提取
经1%琼脂糖凝胶电泳后可见5 S、18 S和28 S 3条清晰条带(图1),总RNA质量较好。

图1 人外周血单个核细胞总RNA琼脂糖凝胶电泳图Fig 1 Electrophoresis of total RNA from human peripheral blood mononuclear cells
2.2 人VH、VL和Cκ基因的扩增
经过PCR扩增,最终得到了长度为335 bp的5个家族的VH基因片段、长度为300 bp的10个家族的VL基因片段(5个Vκ家族基因和5个Vλ家族基因)以及作为单链抗体间隔区的长度为320 bp的Cκ基因片段(图2)。
2.3 VH和VL的易错PCR
将VH和VL基因经过易错PCR扩增,得到了长度为335 bp VH基因片段、长度为300 bp的VL基因片段(图3)。
2.4 DNA-shuffling

图2 PCR扩增VH、VL和Cκ基因的琼脂糖凝胶电泳结果Fig 2 Electrophoresis of VH,VL and Cκgenes amplified by PCR
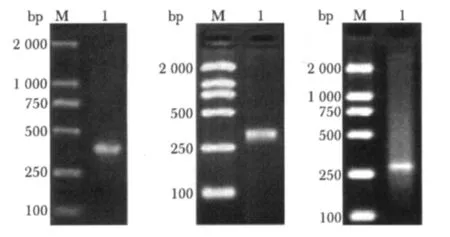
图3 易错PCR扩增的人VH和VL基因凝胶电泳图Fig 3 Electrophoresis of VH and VL genes amplified by error-prone PCR
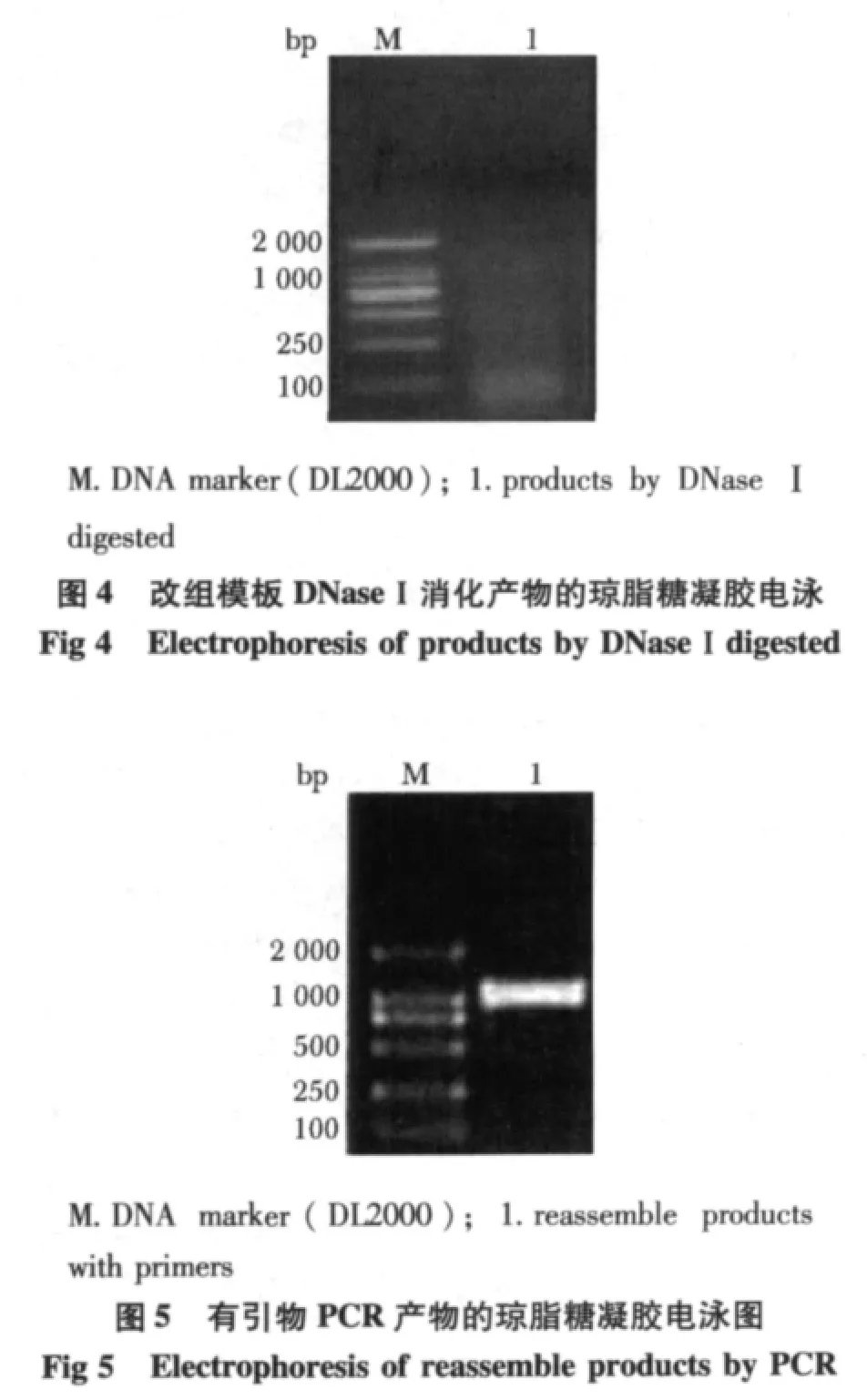
D NaseⅠ消化改组模板,获得大小在50~100 bp的DNA片段(图4),随后采用不加引物的PCR扩增,经过多次扩增后当序列的长度接近目的基因的长度时,进行有引物扩增,获得长度约为1 000 bp的scFv基因(图5)。
2.5 单链抗体文库的构建
随机挑取6个阳性菌落进行菌落PCR,6个菌落都获得了长度约为1 000 bp的 scFv基因片段(图6)。
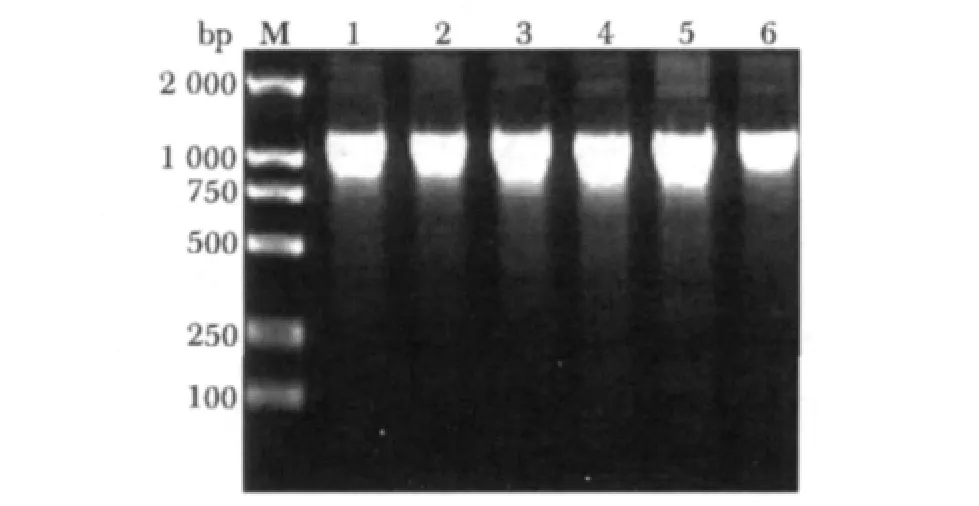
图6 菌落PCR产物琼脂糖凝胶电泳图Fig 6 Electrophoresis of products with colony PCR
2.6 抗体库库容量及多样性分析
本实验共获得scFv基因产物48.9 μg,长度为1 018 bp,经计算,单链抗体库的库容量为4.37×1013。挑取的6个单菌落scFv基因经BstNI酶切后得到的片段存在很大差异性(图7),初步分析该单链抗体库多样性良好。
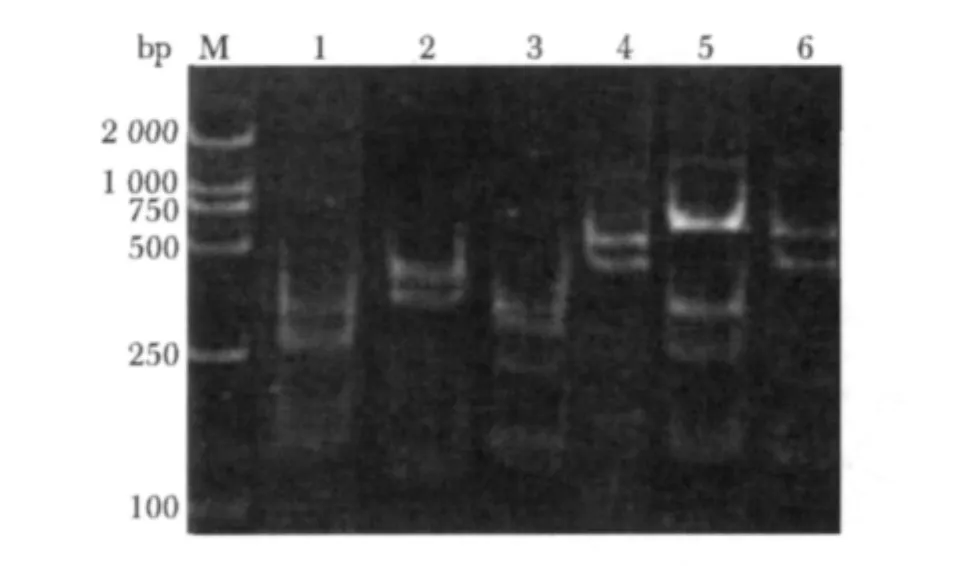
图7 BstNI酶切产物琼脂糖凝胶电泳图Fig 7 Electropherogram of products with BstNI digested
3 讨论
近年来,治疗性抗体显示出越来越广阔的应用前景,但由于抗体种属间的差异使其应用受到了很大限制,抗体库技术的出现为这一问题的解决提供了一条新的途径,为各种不同免疫原包括自身抗原的抗体获得提供了一条有效的途径[5]。然而抗体库库容不高一直是单链抗体技术需要解决的问题之一。本实验中,我们利用易错PCR策略来创造突变体基因,易错PCR是目前应用较多的随机突变技术之一[6],该技术是一种相对简单、快速廉价的随机突变方法。通过改变PCR反应条件,使扩增的基因出现碱基错配,从而导致目的基因的随机突变。易错PCR突变基因为接下来的DNA-shuffling提供了丰富的差异基因。DNA-shuffling是基因在分子水平上进行重组。通过改变单个基因(或基因家族)原有的核苷酸序列,创造新基因,并赋予表达产物以新功能。现阶段该技术以无以伦比的优越性已发展成为比较普遍的研究核酸和蛋白质体外定向分子进化的一种强有力的技术[7],已成功的用于工业用酶、抗体等多种重要蛋白质的定向改造,使蛋白质的酶活性、底物特异性及抗体亲和性、蛋白功能、热稳定性等得到显著提高[8]。本实验利用易错PCR获得的突变基因,再结合抗体基因家族进行改组,大大提高了体外进化的效率以及基因的多样性。为大容量人源抗体库的构建提供了良好的解决方案。成功获得的单链抗体库,为后续筛选得到高亲和力抗体奠定了基础。
[1]Meares CF.The chemistry of irreversible capture[J].Adv Drug Deliv Rev,2008,60:1383-1388.
[2]Lennard S.Standard protocols for the construction of scFv libraries[J].Methods Mol Biol,2002,178:59 -71.
[3]王溪桥,韩跃武,杨浩.大容量人源肝癌核糖体展示单链抗体库的构建[J].亚太传统医药,2010,6:11 -13.
[4]He M,Cooley N,Jackson A,et al.Production of human single chain antibodies by ribosome display[J].Methods Mol Biol,2004,248:177 -189.
[5]Christoph EH,Constontin VZM,Dominik VE,et al.Single-chain antibodies as diagnostic tools and therapeutic agents[J].Thromb Haemost,2009,101:1012 -1019.
[6]Minowa N,Akiyama Y,Hiraiwa Y.et al.Synthesis and antibacterial activity of novel neamine derivatives[J].Bioorg Med Chem Lett,2006,16:6351 -6354.
[7]Makalowski W.Genomics:Not junk after of all[J].Science,2003,300:1246-1247.
[8]Patten PA,Howard RJ,Stemmer WP.Applications of DNA shuffling to pharmaceuticals and vaccines[J].Curr Opin Biotechnol,1997,8:724-733.
The introduction of error-prone PCR and DNA-shuffling technology to build mono-chain antibody library
YANG Hao1,YANG Qing-ping2,ZHA Cheng-xi1,HAN Yue-wu1*
(1.School of Basic Medical Sciences,Lanzhou University;2.Endocrine Branch,the Third People's Hospital of Gansu,Lanzhou 730000,China)
ObjectiveTo construct a mono-storage capacity single-chain antibody(scFv)library using error-prone PCR and DNA-shuffling technologies.MethodsPeripheral blood was collected from different age,gender and healthy people.Total RNA was extracted from human peripheral blood mononuclear cells and reversely transcribed to cDNA by RT-PCR.VH and VL genes were amplified by PCR and mutated by error-prone PCR.The full-length ScFv fragments were recombinated with the DNA-shuffling technologyin vitro,and then connected with T vector and transformed intoE.coliDH5α.Antibody library diversity was identified by restriction enzyme digestion after colony PCR,and then the capacity of scFv was calculated.ResultsThe 4.37×1013capacity and better diversity ScFv library was constructed by error-prone PCR and DNA-shuffling techniques.ConclusionsThe scFv library with high-storage capacity and genetic diversity has been constructed,which laid a foundation of selection high-affinity antibodies.
error-prone PCR;DNA-shuffling;scFv library
R 392.11
A
1001-6325(2012)01-0056-05
2011-01-07
2011-07-29
