PTEN/Akt/mTOR通路增加K562/ADM细胞化疗敏感性
2012-06-05成志勇王素云卞永生温省初高晓丽
成志勇,王素云,卞永生,温省初,杨 宁,高晓丽,韩 英,潘 崚
(1.保定市第一医院血液肿瘤科,河北保定 071000;2.河北省人民医院血液内科,河北石家庄 050051;3.华西医科大学华西医院血液内科,四川成都 610041)
PTEN/Akt/mTOR通路增加K562/ADM细胞化疗敏感性
成志勇1*,王素云2,卞永生1,温省初1,杨 宁1,高晓丽1,韩 英1,潘 崚3
(1.保定市第一医院血液肿瘤科,河北保定 071000;2.河北省人民医院血液内科,河北石家庄 050051;3.华西医科大学华西医院血液内科,四川成都 610041)
目的 探讨K562/ADM细胞系中PTEN/Akt/mTOR信号通路对不同化疗药物敏感性的影响。方法 K562/ADM细胞分为未转染组、转染野生型PTEN组(Ad-PTEN-GFP)、转染空载体组(Ad-GFP),并与不同浓度雷帕霉素或三氧化二砷(As2O3)联合作用。通过MTT法检测细胞增殖,流式细胞术检测细胞凋亡率,荧光定量PCR检测PTEN、mTOR、BCL-2及BAXmRNA水平,Western blot检测 PTEN及 Akt、p-Akt蛋白水平。结果 野生型PTEN对K562/ADM细胞最大增殖抑制率为32.3%,与未转染组及Ad-GFP组相比,Ad-PTEN-GFP组mTORmRNA和p-Akt蛋白明显减低;雷帕霉素与As2O3联合应用后细胞增殖明显受抑,凋亡率(28.61% ±1.46%)明显高于单药作用组(P<0.05),BCL-2mRNA表达降低,BAXmRNA表达增加,以联合干预组最为明显。结论 PTEN/Akt/mTOR信号传导通路能够增加K562/ADM细胞对雷帕霉素及As2O3的敏感性。
Akt;PTEN;mTOR;雷帕霉素;三氧化二砷
*通信作者(corresponding author):dzczy@sohu.com
PI3K/Akt/mTOR通路是细胞内重要的信号传导通路,通过激活或抑制下游多种信号分子的表达,在细胞增殖、凋亡及多药耐药中发挥重要的生物学功能[1]。与张力蛋白同源的10号染色体缺失的磷酸酶基因(PTEN)通过调控PI3K/Akt通路的去磷酸化发挥抑制肿瘤生长的功能。有研究表明,PTEN在包括造血系统肿瘤在内的多种肿瘤中表达降低,与肿瘤的不良预后密切相关[2-4]。
新近研究显示,哺乳动物雷帕霉素靶蛋白(mTOR)信号通路调控失常与白血病发病存在相关性[5-6]。雷帕霉素(rapamycin,RAPA)是一种新型的大环内酯类免疫抑制剂,通过抑制mTOR发挥抗肿瘤增殖作用。三氧化二砷(arsenic trioxide,As2O3)具有广泛的抗肿瘤作用,特别是对白血病细胞和肝癌细胞有明确的生长抑制作用。其作用机制可能与诱导细胞分化或促凋亡有关,但其分子生物学机制尚有待进一步研究[7-8]。
K562/ADM细胞是对包括阿霉素在内的多种化疗药物耐药的人白血病细胞系。本实验探讨野生型PTEN基因联合RAPA和或As2O3对K562/ADM细胞的增殖抑制作用及其可能的分子机制,为进一步的体内实验与临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂及药物:反转录反应体系及引物(北京赛百盛生物工程公司)、SYBR Green Real Master Mix(北京天根生化科技有限公司);PTEN、Akt、SER 473 p-Akt鼠抗人单克隆抗体(Santa Cruz公司)、HRP标记的山羊抗鼠IgG(北京鼎国生物公司);Annexin V-FITC细胞凋亡检测试剂盒(北京宝赛生物);雷帕霉素(华北制药有限责任公司)、三氧化二砷(As2O3)(哈尔滨伊达药业有限公司)。
1.1.2 腺病毒及细胞系:重组腺病毒Ad-PTEN-GFP和Ad-GFP由上海吉凯生物公司合成并鉴定,在人胚肾细胞系293A细胞中进行扩增及滴度测定。293A细胞在含10%胎牛血清的高糖DMEM培养基中培养,K562/ADM细胞用含10%胎牛血清的RPMI 1640培养基培养;均在37℃含5%CO2饱和湿度环境培养。两种细胞均为本实验室长期保存品种。
1.2 方法
1.2.1 腺病毒转染和转染效率的测定:按感染复数(Multiplicity of infection,MOI)为200 在100 μL无血清培养液中加入含有PTEN基因(Ad-PTEN-GFP组;PTEN组)或空载体(Ad-GFP组;Ad组)的病毒液后转染K562/ADM细胞,在37℃、含5%CO2、无血清、无抗生素的1640培养基中孵育2 h后,加入含10%胎牛血清的RPMI 1640培养液继续培养,48 h后流式细胞仪检测两组表达绿色荧光蛋白的细胞比例,计算转染效率及对细胞增殖抑制率的影响。
1.2.2 腺病毒转染及药物联合干预实验:RAPA用DMSO溶解,RPMI 1640培养基稀释成储存浓度,终浓度为20和50 nmol/L;4℃避光保存,As2O3用RPMI 1640培养基稀释,选用终浓度为2.5和5 μmol/L。
腺病毒Ad-PTEN-GFP或Ad-GFP转染K562/ADM细胞系后,即刻加入上述浓度的RAPA或As2O3观察0、24、48和72 h对细胞增殖、凋亡的影响。
将RAPA与As2O3联合应用,观察药物对细胞增殖、凋亡的影响,并与单药进行对比。
1.2.3 MTT实验:在96孔板中,每孔接种对数生长期K562/ADM细胞5 000个,每组设3个复孔,同时设立无细胞的空白对照,在干预后不同时间点,加入MTT溶液,培育4 h后离心弃上清,加入DMSO振荡数分钟,酶标仪读取吸光度A490值,计算细胞生长抑制率,绘制生长曲线。细胞生长抑制率=[对照组值-实验组]/对照组×100%。
1.2.4 凋亡率检测:1)碘化丙啶(PI)单标检测细胞凋亡率:收集转染不同时间的细胞,每组收集1×106个细胞,70%乙醇4℃固定过夜;加入RNA酶,37℃水浴消化15~30 min后加入PI,4℃存放15 min以上,流式细胞仪检测凋亡率。2)AnnexinV/PI双染检测细胞凋亡率:收集不同干预组细胞,1×PBS洗涤2次后加入500 μL的连接缓冲液悬浮细胞,加入10 μL Annexin V-FITC 和5 μL PI,室温下避光、反应15 min,流式细胞仪检测细胞凋亡率。
1.2.5 实时荧光定量PCR:1)收集不同处理组细胞,Trizol提取总RNA,电泳鉴定RNA并定量,反转录合成cDNA。2)实时荧光定量PCR反应:SYBR反应体系共25 μL。反应条件为94℃ 5 min,94℃45 s,60℃ 1 min,30个循环,设空白对照。PCR反应前3~15个循环的荧光信号作为荧光本底信号,调节基线至适宜处,各荧光曲线与基线交叉点的循环数即为 Ct值。根据 ΔCt=Ct(目的基因)-Ct(β-actin),ΔΔCt=2-ΔCt计算检测基因 mRNA 相对表达量,每组重复3次取平均值。PCR引物序列(表1)。
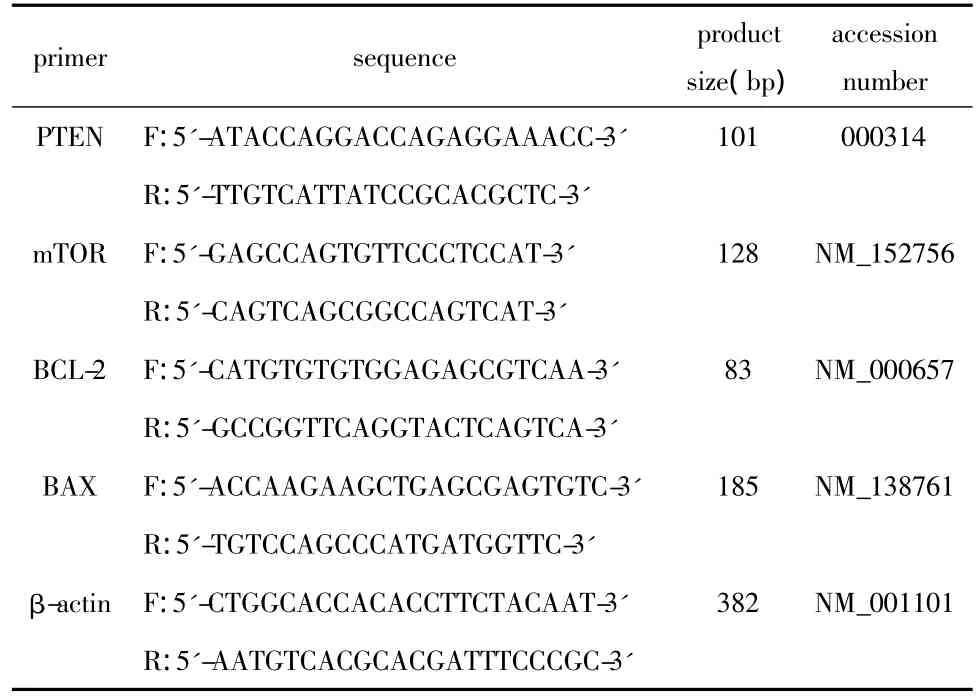
表1 FQPCR扩增引物序列Table 1 Primer sequence of FQPCR
1.2.6 Western blot法检测靶蛋白表达水平:收集不同组 K562/ADM细胞,每组取107个细胞,加入200 μL预冷的蛋白裂解液,4℃裂解1 h,冰浴下超声裂解15 min。4℃ 18 000×g离心20 min,取上清用考马斯亮蓝试剂盒测定蛋白浓度,分装后置-20℃保存。取80 μg样品蛋白质加入等体积上样缓冲液,经5%浓缩胶和10%SDS-PAGE凝胶电泳后,用水浴式电转仪转至硝酸纤维素膜上。经5%BSA 37℃封闭1 h,分别加入1∶500稀释的小鼠抗人PTEN、Akt和 p-Akt单克隆抗体,4℃培育过夜。TBS漂洗5 min×3次,加入山羊抗小鼠HRP标记二抗,37℃孵育1 h,TBS漂洗5 min×3次。化学发光法检测后分析结果。
1.3 统计学分析
所有数据用SAS 8.0统计软件分析处理,计量资料进行t检验,F检验及q检验。
2 结果
2.1 过表达PTEN基因对K562/ADM的增殖抑制作用
当MOI为200时,流式细胞直接检测腺病毒感染K562/ADM细胞的效率为82.2% ±5.8%,符合基因治疗对载体的要求(图1)。
转染后第4~7天,各组K562/ADM细胞的增殖抑制出现显著差别,Ad-PTEN-GFP组细胞的最大生长抑制率(32.3%)出现在第5天,显著高于Ad-GFP组(P<0.01)(图2)。

图1 以MOI=200转染3 d后细胞转染效率Fig 1 The transfection rate of K562/ADM cells after transfected with Ad-GFP or Ad-PTEN-GFP for the 3 days,with MOI=200

图2 PTEN对K562/ADM细胞的生长抑制曲线Fig 2 Anti-proliferation effect of PTEN on K562/ADM cells
2.2 野生型PTEN增加K562/ADM细胞对RAPA与As2O3的敏感性
干预后3 d,RAPA处理组:PTEN+RAPA 20及50 nmol/L组的A值均低于Ad+RAPA 20及50 nmol/L组(P<0.01);As2O3处理组:PTEN+As2O32.5及5 μmol/L组A值均低于 Ad+As2O32.5 及5 μmol/L组(P<0.01)(图3)。
转染 3 d后,RAPA干预组:PTEN+RAPA 20 nmol/L组的凋亡率(29.1% ±3.7%)高于Ad+RAPA 20 nmol/L组(19.8% ±2.5%)(P<0.05);PTEN+RAPA 50 nmol/L组的凋亡率(34.9% ±3.5%)高于Ad+RAPA 50 nmol/L组(23.1% ±2.8%)(P<0.01);As2O3干预组:PTEN+As2O32.5 μmol/L组的凋亡率(50.6% ± 6.2%)高于 Ad+As2O32.5 μmol/L组(36.8% ±4.1%)(P<0.01);PTEN+As2O35 μmol/L组的凋亡率(69.2% ±5.2%)高于Ad+As2O35 μmol/L组(41.7% ±4.6%)(P<0.01)。
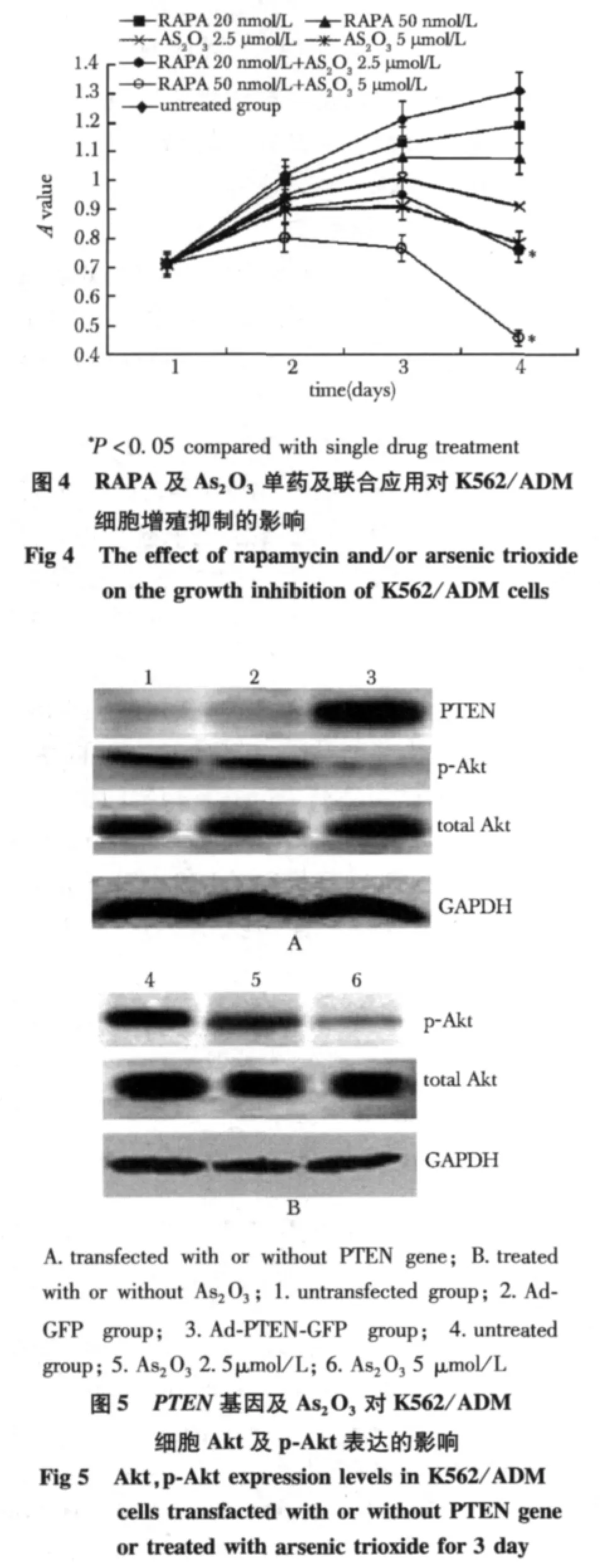
2.3 RAPA和/As2O3对K562/ADM细胞增殖抑制的影响
不同组药物干预3 d后,RAPA 20 nmol/L+As2O32.5 μmol/L组的A值明显低于RAPA 20 nmol/L组及As2O32.5 μmol/L组(P< 0.01);RAPA 50 nmol/L+As2O35 μmol/L组的A值明显低于RAPA 50 nmol/L组及As2O35 μmol/L组(P<0.01)。不同浓度RAPA与不同浓度As2O3联合作用组A值均低于各药物单独干预组(P<0.05)(图4)。
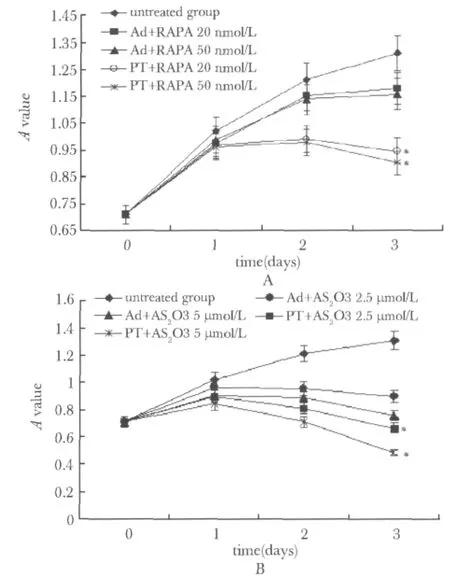
图3 不同浓度RAPA及As2O3对转染Ad-PTEN-GFP或Ad-GFP的K562/ADM细胞增殖抑制的影响Fig 3 The effect of different concentration rapamycin or arsenic trioxide treatment on the growth inhibition of K562/ADM cells transfected with Ad-PTEN-GFP or Ad-GFP
在RAPA及As2O3单药或联合应用24 h后,RAPA 20 nmol/L+As2O32.5 μmol/L 组 的 凋 亡 率(19.71% ±1.18%)明显高于 RAPA 20 nmol/L组(9.09% ±0.38%)或 As2O32.5 μmol/L组(14.79%±0.69%),(P<0.01);RAPA 50 nmol/L+As2O35 μmol/L组的凋亡率(28.61% ±1.46%)明显高于RAPA 50 nmol/L组(12.54% ±0.43%)或 As2O35 μmol/L组(20.21% ±1.29%)(P<0.01)。
2.4 野生型PTEN、RAPA与As2O3对K562/ADM细胞中PI3K/Akt/mTOR信号传导通路的影响
2.4.1 转染野生型PTEN基因降低p-Akt蛋白水平及mTORmRNA水平:转染 Ad-PTEN-GFP后,PTENmRNA(25.43±6.77)和蛋白表达水平明显高于Ad-GFP转染组(0.473±0.317)及未转染对照组(0.477±0.211)(P<0.01)(图5)。
转染Ad-PTEN-GFP后,p-Akt表达水平明显下降,低于未转染组和Ad-GFP组(P<0.01)。
同样,K562/ADM细胞转染PTEN基因后,mTORmRNA表达水平(0.219±0.042)明显低于未转染组(0.512±0.077)和 Ad-GFP组(0.501±0.071)(P<0.01)。
2.4.2 RAPA对Akt、p-Akt及mTOR表达的影响:RAPA对Akt及p-Akt无明显抑制作用,但明显抑制mTORmRNA表达,未干预组、20 nmol/L和50 nmol/L RAPA组mTORmRNA表达水平分别为:0.512±0.077;0.248±0.067;0.152±0.054(P<0.01),呈剂量依赖性减低。
2.4.3 As2O3对 Akt、p-Akt及 mTOR表达的影响:Akt无明显变化,p-Akt表达水平降低(图5),各组间P<0.01,表明As2O3可以呈剂量依赖性抑制p-Akt表达。As2O3作用后mTOR有轻度减低,但无明显抑制作用。
2.5 野生型 PTEN基因、RAPA与 As2O3对K562/ADM细胞凋亡分子的影响
转染Ad-PTEN-GFP组BCL-2表达水平低于转染Ad-GFP组(P<0.05),BAX表达水平则高于Ad-GFP组(P<0.05)。Ad-PTEN-GFP与 RAPA或As2O3联合作用组BCL-2表达低于Ad-GFP联合RAPA或As2O3作用组(P<0.05),BAX表达水平与BCL-2表达水平相反。
RAPA与As2O3联合作用组BCL-2mRNA表达水平低于单独作用组,BAXmRNA表达水平则高于单独作用组(P<0.05)(表2)。
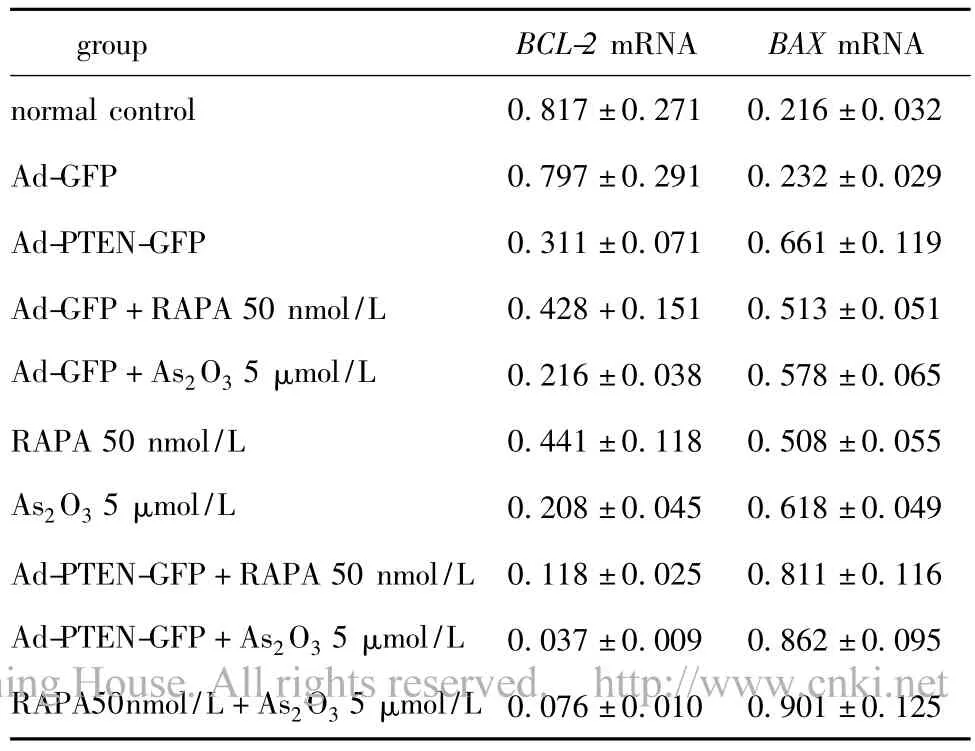
表2 PTEN基因、RAPA、As2O3及联合作用组于K562/ADM 细胞3 d后BCL-2、BAX mRNA表达水平的影响Table 2 The BCL-2,BAX mRNA expression levels in K562/ADM cells transfected with Ad-PTENGFP or Ad-GFP together with rapamycin or arsenic trioxide,or treated with rapamycin and/or arsenic trioxide for 3 days
3 讨论
PI3K/Akt通路是细胞内重要的信号传导通路,通过激活下游 mTOR、NF-κB,进一步促进 BCL-2、BCL-xL表达,抑制P53、灭活caspase、诱导细胞周期基因转录或其转录调控子的生成等,在促进细胞增殖、抑制细胞凋亡、诱导肿瘤细胞多药耐药等方面发挥重要作用[1],包括白血病在内的多种肿瘤中存在此信号通路的功能异常。
研究显示PI3K抑制剂可以抑制白血病细胞增殖,同时增加其对依托泊苷、阿糖胞苷和As2O3等传统化疗药物的敏感性[8-9]。
PTEN通过其磷酸酶活性调控PI3K/Akt通路去磷酸化,发挥肿瘤抑制功能[1-3],研究发现,PTEN基因在白血病中突变罕见,但有不同程度缺失、低表达及甲基化。将野生型PTEN转染急性髓系白血病(AML)耐药细胞系HL60AR和急性淋巴细胞白血病(ALL)细胞系 EU-1后,分别增加了细胞对As2O3[8]及阿霉素[10]的敏感性。PTEN 去甲基化后可逆转Ph+ALL细胞对伊马替尼的耐药[11]。
本研究结论与上述研究一致,通过将野生型PTEN转染K552/ADM细胞后,可以增加该细胞对RAPA或As2O3的敏感性。RAPA为mTOR抑制剂,PTEN基因可以直接或间接抑制mTOR表达,RAPA与野生型 PTEN联合作用后,可抑制 PI3K/Akt/mTOR通路,发挥协同抗肿瘤作用。As2O3自身具有抑制p-Akt的活性,与PTEN基因转染联合作用于K562/ADM细胞后,通过抑制p-Akt活性,增加了细胞对As2O3的敏感性。
根据本研究结果推测,RAPA抑制mTOR表达、As2O3抑制p-Akt表达,两药合用增强了对PI3K/Akt/mTOR通路抑制作用,从而发挥协同抗肿瘤效果。
本研究还发现转染PTEN基因或RAPA与As2O3单药处理K562/ADM细胞后均可以单独抑制BCL-2,增加BAXmRNA的表达,在联合作用后,抑制BCL-2及增加BAXmRNA表达的作用明显增强,从而提示上述方法联合应用后可以增加相互之间的协同作用。
本研究通过将野生性PTEN基因转染K562/ADM细胞,证实了野生型PTEN基因可以增加K562/ADM细胞对RAPA或As2O3药物的敏感性,同时RAPA与As2O3联合应用增强了对K562/ADM细胞的增殖抑制作用,通过探讨上述协同作用的可能的分子机制,为逆转白血病多药耐药提供理论依据。
[1]Khwaja A.PI3K as a target for therapy in haematological malignancies[J].Curr Top Microbiol Immunol,2010,347:169-188.
[2]Li J,Yen C,Liow D,et al.PTEN,a putative protein tyrosine phosphatase gene mutated in human brain,breast,and prostate cancer[J].Science,1997,275:1943 -1947.
[3]王素云,成志勇,邓凯等,野生型PTEN基因对人多发性骨髓瘤细胞系RPMI8226增殖、凋亡和侵袭活性的影响[J].中国老年学杂志,2010,30:614 -617.
[4]成志勇,潘崚,牛志云等,PTEN基因转染对白血病细胞VEGF调控作用的影响[J].肿瘤,2010,30:815-821.
[5]Martelli AM,Tazzari PL,Evangelisti C,et al.Targeting the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin module for acute myelogenous leukemia therapy:from bench to bedside[J].Curr Med Chem,2007,14:2009-2023.
[6]孟艳,米蕊芳,赵春华.PI3K-AKT-mTOR信号通路在细胞分化中的作用[J].基础医学与临床,2007,27:1404-1408.
[7] Altman JK,Yoon P,Katsoulidis E,et al.Regulatory effects of mammalian target of rapamycin-mediated signals in the generation of arsenic trioxide responses[J].J Biol Chem,2008,283:1992 -2001.
[8]Tabellini G,Cappellini A,Tazzari PL,et al.Phosphoinositide 3-kinase/Akt involvement in arsenic trioxide resistance of human leukemia cells[J].J Cell Physiol,2005,202:623-634.
[9]Tabellini G,Tazzari PL,Bortul R,et al.Novel 2'-substituted,3'-deoxy-phosphatidyl-myo-inositol analogues reduce drug resistance in human leukaemia cell lines with an acti-vated phosphoinositide 3-kinase/Akt pathway[J].Br J Haematol,2004,126:574 -582.
[10] Zhou M,Gu L,Findley HW,et al.PTEN reverses MDM2-mediated chemotherapy resistance by interacting with p53 in acute lymphoblastic leukemia cells[J].Cancer Res,2003,63:6357 -6362.
[11]Montiel-Duarte C,Cordeu L,Agirre X,et al.Resistance to Imatinib Mesylate-induced apoptosis in acute lymphoblastic leukemia is associated with PTEN down-regulation due to promoter hypermethylation [J].Leuk Res,2008,32:709-716.
PTEN/Akt/mTOR pathway enhances drug sensitivity in K562/ADM cells
CHENG Zhi-yong1*,WANG Su-yun2,BIAN Yong-sheng1,WEN Xing-chu1,YANG Ning1,GAO Xiao-li1,HAN Ying1,PAN Ling3
(1.Dept.Hematology and Oncology,the First Hospital of Baoding,Baoding 071000;2.Dept.Hematology,Hebei General Hospital,Shijiazhuang 050000;3.West China Hospital,Sichuan University,Chengdu 610041,China)
ObjectiveTo investigate the influence of PTEN/Akt/mTOR pathway in drug sensitivity of K562/ADM cells.MethodsK562/ADM cells were divided into untrsfected group,transfected with PTEN group(Ad-PTENGFP),transfected with empty vector group(Ad-GFP).Each group was treated with rapamycin and or arsenic trioxide at different concentrations.The inhibited rate of K562/ADM cells from each group was measured by MTT assay;the apoptosis rate was assessed by flow cytometry(FCM).The mRNA expression ofPTEN,mTOR,BCL-2andBAXwere detected by real-time fluorescent relative-quantification reverse transcriptional PCR(FQ-PCR).PTEN,Akt and p-Akt protein levels were detected by western blotting.ResultsThe maximum growth inhibition rate was 32.3%after transfected withPTENgene.Compared with Ad-GFP group,after transfacted with Ad-PTENGFP into K562/ADM cells,p-Akt protein andmTORmRNA expression levels were down-regulated.RAPAmycin and arsenic trioxide had synergistic effect on growth inhibition of K562/ADM cells and the inhibition rate(28.61±1.46%)was higher than that in cells with single drug treatment(P<0.05).BCL-2mRNA was down-regulated butBAXmRNA up-regulated,especially in combination groups.ConclusionsPTEN/Akt/mTOR pathway can enhance the anti-leukemia effect of rapamycin and arsenic trioxide in K562/ADM cells.
Akt;PTEN;mTOR;RAPAmycin;arsenic-trioxide
R 733
A
1001-6325(2012)01-0049-07
2010-12-29
2011-06-15
保定市科技攻关计划(11ZF003)
