影响草地早熟禾愈伤组织诱导和分化的相关因子研究
2012-06-04张媛媛马晖玲
张媛媛,马晖玲,俞 玲
(甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
草地早熟禾(Poa pratensis)是一种优质的冷季型草坪草,主要分布于我国北方地区,也是这一地区需求量最大的建坪草种之一。但草地早熟禾具有生长缓慢、抗病虫害能力弱、耐高温和抗旱能力较差,在高温干旱的环境下叶片容易干枯变黄等缺点[1,2]。而草地早熟禾的一些改良品种,如午夜2号(MidnightⅡ)、新哥来德(Nuglade)、橄榄球2号(RugbyⅡ)等具有优良特性。其中,午夜2号的特点为绿期长、耐低修剪、抗旱耐寒性强、耐热耐阴性高、耐践踏、综合抗病力好;新格莱德耐热耐阴力出众、抗病性能高、植株低矮[3];橄榄球2号抗寒旱能力强,绿期长、返青好、抗病虫害能力强[4,5]。草地早熟禾的3个品种的综合评价较高,是目前草坪建植中优先选择的优异品种,同时也是良好的育种亲本材料。以草地早熟禾午夜2号、新格莱德和橄榄球2号为材料,进行愈伤组织诱导和植株再生的研究,为草地早熟禾的品种改良和新品种选育奠定基础。
1 材料和方法
1.1 试验材料
供试材料由北京克劳沃集团提供的草地早熟禾午夜2号、新格莱德和橄榄球2号3个品种的成熟种子为供试材料。
培养基所用的无机盐、蔗糖以及琼脂为国产分析纯;各种维生素和激素购自上海生工生物有限公司,实验用水均为蒸馏水。
1.2 实验方法
1.2.1 外植体处理 取每个品种的成熟种子适量,分成两份浸泡于清水,分别放置于4℃冰箱和25±1℃恒温培养箱中,处理时间分别为8、16和24h,取出后用清水冲去漂浮的干瘪种子并用纱布包裹,然后在超净工作台上先后用70%酒精和0.1%升汞溶液消毒2~10min,无菌水冲洗3~5次,放置在双层无菌滤纸上吸干水分[6]。
1.2.2 愈伤组织诱导和继代培养 将灭菌后的种子按每皿50粒接种于MS诱导培养基,置于25±1℃、黑暗条件下进行愈伤组织的诱导;6周后,将愈伤组织转接到继代培养基上,每15d继代1次[18]。附加的激素成分及含量见表1。
1.2.3 分化和植株再生 选取不同继代次数且胚性较好的愈伤组织接种到分化培养基(表1),置于人工气候箱培养,温度为25±1℃,16h光照,8h黑暗,光照强度为2 000lx。
1.3 统计与分析
(1)记录不同处理条件下种子由萌动到发芽再到愈伤组织形成的时间,计算平均出愈时间。
(2)接种约6周(第1次继代前),统计各品种不同处理条件下的总愈伤组织块数,计算出愈率。

表1 培养基激素含量Table 1 Hormone levels in the culture medium mg/L

(3)愈伤组织转移到分化培养基20d后,统计分化的绿芽数,并计算绿芽率。

(4)愈伤组织转接到分化培养基40d后,记录成苗数,并计算成苗率。

2 结果与分析
实验做了2种温度和3个浸种时间的预处理。不同条件处理的草地早熟禾成熟种子的诱导,愈伤组织在出愈时间和出愈率等方面有明显差异,而分化和再生过程差异不大(图1)。
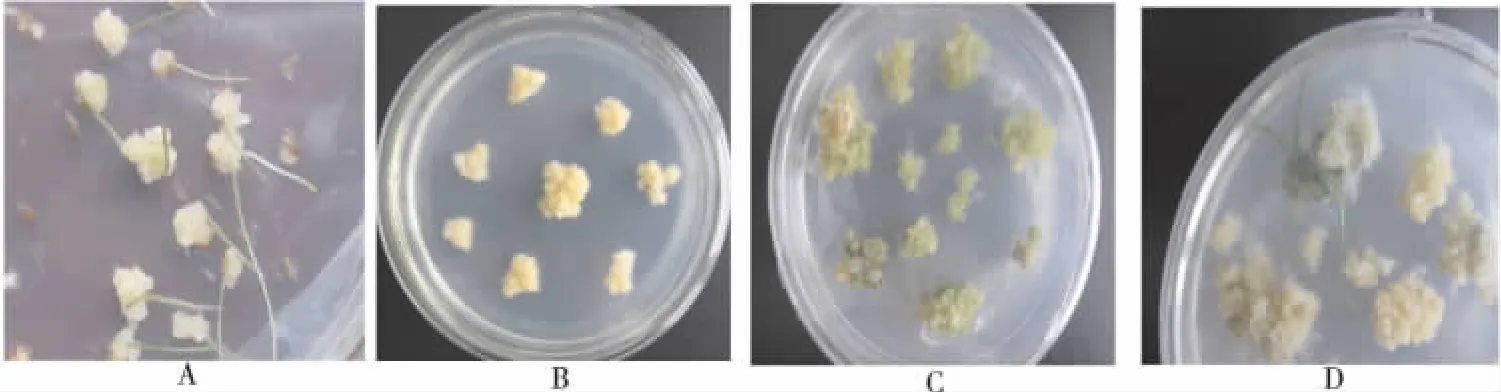
图1 4种愈伤组织生长状况Fig.1 A Callus induced;B Callus sub-culture;C Green shoot-buds;D Plantlets differentiated
2.1 不同处理对草地早熟禾种子出愈时间的影响
浸种时间相同,4℃下浸种较25℃下浸种,各品种的出愈时间显著缩短。而浸种温度相同条件下,各品种浸种8h较浸种16h和24h的出愈时间显著增加,而16h和24h间差异不显著(表2)。实验中,在25℃下浸种16h和24h,各品种4~5d萌动,7~8d发芽,平均26.26~38.79d形成愈伤组织,而在4℃下浸种16h和24h,进程明显提前,在16.27~28.95 d即形成愈伤组织,说明对草地早熟禾种子进行低温预处理能加快出愈时间,最佳浸种时间16~24h。
2.2 不同处理对草地早熟禾出愈率的影响
相同时间4℃较25℃浸种,各品种愈伤组织诱导率均有所提高(表4),在浸种16h和24h时,这2个温度处理的差异呈显著水平;相同温度条件下浸种8h的愈伤组织诱导率均明显低于16~24h。表明4℃浸种有利于提高草地早熟禾愈伤组织的诱导率,但浸种时间过短则不利于诱导愈伤组织。午夜2号浸种16~24h的愈伤组织诱导率略高,说明4℃下浸种16h有利于午夜2号愈伤组织诱导。新格莱德和橄榄球2号在4℃下浸种24h的愈伤组织诱导率比浸种16h略高,结合二者在此条件下的平均出愈时间,说明4℃下浸种24h有利于愈伤组织诱导。
2.3 继代次数对草地早熟禾愈伤组织分化的影响
分别选取继代1~6次,外表干燥、致密、呈颗粒状的愈伤组织接种到分化培养基上,每10d继代1次。约20d愈伤组织出现绿色芽点,40d形成绿苗(图2)。随着继代次数的增加,草地早熟禾愈伤组织的分化能力逐渐下降。午夜2号和橄榄球2号继代1次的愈伤组织分化能力最高,继代次数增加,分化率明显降低;新格莱德继代2次的愈伤组织有较强的组织分化能力,随后愈伤组织分化能力急剧下降。结果显示,草地早熟禾继代培养时间越长越不利于愈伤组织的分化,培养30d以内的愈伤组织胚性较好,分化能力强,继代培养60d以后的愈伤组织分化率明显降低,基本丧失分化能力。

图2 继代培养次数草地早熟禾愈伤组织的分化Fig.2 Effect of Sub-culture on the callus differentiation of Poa pretensis
3 讨论与结论
3.1 低温处理对草地早熟禾愈伤组织诱导的影响
关于低温预处理对愈伤组织诱导的影响,国内外学者的研究结果不尽相同。刘萍等[7]和廖祥儒等[8]在研究中发现,低温处理能够促进小麦成熟胚愈伤组织的形成;但曹原等[9]在研究中指出,低温预处理对愈伤组织形成率的影响取决于植物体的品种;贺杰等[10]在研究中报道,尽管低温预处理对不同小麦品种愈伤组织诱导率的促进效应在不同基因型间存在差异,但低温预处理有益于多数品种进行愈伤组织诱导;1984年McDonnell和Conger[11]的研究表明,种子在4℃下进行低温预处理可以有效提高肯塔基种子诱导愈伤组织的能力。此次研究发现,4℃低温预处理对3个供试草地早熟禾品种愈伤组织的诱导均有促进作用,加快了愈伤组织的形成并提高了愈伤组织的诱导率,可能是低温处理打破种子休眠,提高种子萌发率,从而提高了其愈伤组织诱导率。因此,低温预处理可以广泛用来改善草地早熟禾种子愈伤组织形成。
3.2 浸种时间对草地早熟禾愈伤组织诱导的影响
在对日本结缕草进行研究的结果表明,用水浸泡处理和综合处理的方法可以快速有效地促进日本结缕草成熟种子发芽,并且指出最佳浸泡时间为72h,但随着浸泡时间延长,种子萌发率降低,愈伤组织诱导率也相应下降[12,13];贺杰等[10]以小麦种子作为供试材料,研究了不同浸种时间对种子出愈率的影响,结果显示,16h为最佳浸种时间,同时还指出不同品种应采取不同浸种时间。试验发现,浸种8h的种子仍然较硬,很难剥离胚,不利于种子的萌发,愈伤组织诱导率也处于较低水平;浸种16~24h的种子胚易剥离,种子萌发率升高,有利于愈伤组织的形成。
3.3 继代培养时间对草地早熟禾再生的影响
对不同基因型早熟禾组织培养和植株再生的研究表明,早熟禾愈伤组织的继代时间对其分化影响较大,随着愈伤组织继代培养时间的增加,其再分化能力显著下降[11,14],培养超过3个月的愈伤组织基本丧失分化能力[15]。Ke等[14]研究结果表明,植株再生能力与愈伤组织的生长状态有关,颜色鲜黄、表面干燥、颗粒状,生长迅速的愈伤组织为胚性愈伤组织,Armstrong[16],佘建明等[17]认为选择胚性较好的愈伤组织有利于克服继代培养时间对再生能力产生的不良影响。研究结果显示,继代1~2次的愈伤组织保持较高分化能力,继代3次后愈伤组织分化能力明显降低,甚至丧失分化能力;不同基因型之间差异显著,午夜2号和橄榄球2号继代1次的愈伤组织分化能力最强,而新格莱德继代2次的分化率明显高于其他培养时间。
以草地早熟禾3个品种的成熟种子作为外植体,对种子作温度及浸种处理,进行愈伤组织的诱导,结果表明4℃浸种16~24h可以促进愈伤组织形成,不同品种差异不明显;对3个品种进行分化培养,午夜2号、橄榄球2号继代1次的愈伤组织胚性最好,分化能力强,新格莱德继代2次的胚性愈伤组织分化率最高。为了提高草地早熟禾愈伤组织诱导率并加快出愈时间,对种子应做4℃低温预处理,并且浸泡16~24h为宜;愈伤组织胚性的保持是进行植株再生的关键,因此,应挑选生长状态最好的愈伤组织进行植株再生,此次实验午夜2号和橄榄球2号继代培养15d、新格莱德继代培养30d。
[1]吕世海,张伟.亚热带气候区草地早熟禾品种适应性研究[J].中国草地,1998(2):45-47.
[2]李淑珍,王洪晶.我国草坪业现状分析[J].林业科技情报,2005,37(1):2-4.
[3]申忠宝,王建丽,钟鹏,等.15个草地早熟禾品种(系)萌发期对盐胁迫的抗性研究[J].黑龙江农业科学,2009(3):28-30.
[4]董丽华.草地早熟禾不同品种抗性研究[D].宁夏:宁夏大学,2005.
[5]蔺燕,白淑媛,车少臣.北京地区冷季型草坪草的品种筛选研究[J].北京园林,2003,19(64):31-36.
[6]赵小强,马晖玲,周万海,等.不同激素浓度和处理方法对草地早熟禾愈伤组织诱导的影响[J].草业学报,2008,25(5):92-95.
[7]刘萍,宋晓华,马惠萍,等.温度处理对春小麦花药愈伤组织诱导率影响初报[J].宁夏农学院学报,1996,17(1):52-56.
[8]廖祥儒,郭中伟.低温和PEG预处理对小麦愈伤组织形成及IAA氧化的影响[J].植物学通报,2000,17(3):257-259.
[9]曹原,刘志学,黄晔俊.冬小麦成熟胚愈伤组织诱导及分化[J].上海大学学报(自然科学版),2004,10(5):503-507.
[10]贺杰,王伟,胡海燕,等.小麦成熟胚诱导愈伤组织研究[J].江苏农业科学,2011,39(2):103-105.
[11]Mc Donnell R E,Conger B V.Callus induction and plantlet formation from Mature Embryo Explants of Kentucky bluegrass[J].Crop Science,1984,24:573-578.
[12]方文娟.日本结缕草(Zoysia japonica)悬浮再生体系的建立与超低温保存研究[D].北京:北京林业大学,2008.
[13]刘雅丽,费永俊.影响日本结缕草成熟种子愈伤组织诱导率和出愈时间的相关因子研究[J].长江大学学报,2010,7(1):63-66.
[14]Ke Shangqiang,Chi won W L.Plant Regeneration in Kentucky bluegrass(Poa pratensisL.)Via coleoptiles tissue culture[J].Plant Cell Report,1996(15):882-887.
[15]马忠华,张云芳,徐转祥,等.早熟禾的组织培养和基因枪介导的基因转化体系的初步建立[J].复旦学报,1999,38(5):540-544.
[16]Armstrong C L,Green C E.Establishment and maintenance of friable,embryogenic maize callus and the involvement of L-proline[J].Planta,1985,164:207-214.
[17]佘建明,张宝龙,陈志一,等.草地早熟禾成熟胚离体培养植株再生技术研究[J].草地学报,2003,11(1):58-62.
[18]赵小强.草地早熟禾原生质体培养及体细胞杂交[D].兰州:甘肃农业大学,2009.
[19]朱根发,余毓君.草地早熟禾的组织培养条件和分化能力研究[J].华中农业大学学报,1994,13(2):199-203.
[20]白生军,马祥,安惠惠.影响草地早熟禾原生质体生长和分裂的生理生化因素分析[J].甘肃农业大学学报,2011,46(6):99-103.
