鹰嘴豆肽抑制肿瘤作用和对免疫功能的影响
2012-06-01寇晓虹薛照辉
高 捷,王 华,寇晓虹,薛照辉*
(天津大学化工学院食品科学系,天津 300072)
鹰嘴豆肽抑制肿瘤作用和对免疫功能的影响
高 捷,王 华,寇晓虹,薛照辉*
(天津大学化工学院食品科学系,天津 300072)
目的:探讨鹰嘴豆肽抑制肝癌H22细胞移植瘤的效果及对免疫功能的影响。方法:将小鼠随机分为正常对照组、阳性对照组、肿瘤对照组和鹰嘴豆肽低、中、高剂量组(50、100、200mg/(kg·d)),除正常组外,其余各组小鼠均在皮下接种肝癌H22细胞,建立肝癌小鼠模型。建模后第2天开始灌胃给药,连续给药10d。末次给药24h后拉托颈椎处死小鼠,测体质量、肿瘤大小、抑瘤率、胸腺指数、脾指数、巨噬细胞吞噬能力、脾细胞吞噬能力等。 结果:鹰嘴豆肽低、中、高3个剂量均可抑制H22肿瘤的生长,且没有阻碍小鼠体质量和免疫器官的增长。与肿瘤对照组相比,鹰嘴豆高剂量组可以显著提高小鼠迟发型超敏反应(DTH)的能力、淋巴细胞和巨噬细胞吞噬能力(P<0.05),鹰嘴豆低、中剂量组对其也有一定的改善作用,但是没有表现出剂量依赖效应。 讨论:鹰嘴豆肽可能是通过增强H22肝癌小鼠的免疫功能来抑制肿瘤的生长,具体的作用机制还需要更深入的研究。
鹰嘴豆肽;抗肿瘤;H22肿瘤;免疫功能
肿瘤是一类严重危害人类身体健康的常见病、多发病,其中恶性肿瘤对人类的危害尤为严重。肝癌是严重威胁我国人民健康的恶性肿瘤之一,而且具有起病隐匿、恶化程度高、易转移复发和预后差的特点[1]。目前,化学药物治疗是治疗肝癌的主要手段,但临床常用的化疗药物具有严重的非特异性的细胞毒作用,在杀伤肿瘤细胞的同时对机体正常组织器官也会造成一定程度的损伤,在很大程度上限制了其应用,此外,许多肿瘤细胞对常规化疗有了多重耐药性[2]。因此,寻找对肿瘤细胞具有选择性杀伤作用,而且对正常细胞有相对低毒性的药物成为迫切的要求。
鹰嘴豆(Cicer arietinum L.)系豆科蝶形花亚科典型代表植物,原产于西亚土耳其一带,2500年前即已传入我国新疆,目前,在世界各地均有栽培,我国主要在西部、北部等干旱和半干旱地区种植[3]。鹰嘴豆是一种优良的植物蛋白质资源,其蛋白质含量占籽粒干基总量的15%~30%,含有人体所必需的8种氨基酸,含量高,组成均衡[4-5]。在我国它是一味维族民间药和传统中药,可清热解毒,主治消渴、肝炎、脚气。此外,鹰嘴豆还具有抗骨质疏松[6]、抗氧化[7]、降低血糖、血脂和调节胆固醇水平[8-9]等药理活性。鹰嘴豆异黄酮还可以防止癌细胞的增殖,促使癌细胞的死亡,尤其是与性腺相关的癌症细胞,如乳腺癌[10-11]、前列腺癌[12-13]等。本研究通过抑瘤率、淋巴细胞吞噬能力、免疫器官指数等免疫抑制指标,探讨鹰嘴豆肽抑制肝癌H22细胞移植瘤的效果及对免疫功能的影响,为鹰嘴豆肽的综合利用提供参考。
1 材料与方法
1.1 材料、试剂与仪器
小鼠肝癌H22细胞、KM小鼠(18~20g)购于中国放射性医学研究所;鹰嘴豆购于新疆市场;鹰嘴豆肽由实验室自制[14-15]。
RPMI-1640培养基 美国Gibco公司。刀豆蛋白A (Con A) 美国Sigma公司;四氮甲基偶氮唑盐(MTT) 美国Amresco公司;注射用环磷酰胺(Cy)(批号:10022321)江苏恒瑞医药股份有限公司;印度墨汁 北京化学试剂公司;胎牛血清 美国MD 公司;红细胞裂解液 碧云天生物技术研究所;其余试剂均为分析纯。
72862-415 CO2细胞培养箱 美国Forma Scientific公司;普通光学显微镜 日本Olympus公司;电子分析天平 赛多利斯科学仪器(北京)有限公司;台式高速离心机 上海安亭科学仪器厂;超净工作台 苏州净化设备有限公司;WH-1微型涡旋混合仪 上海沪西分析仪器厂有限公司;酶标仪 美国Thermo公司。
1.2 方法
1.2.1 接种方法
无菌获取肝癌H22细胞,以无菌生理盐水配制成细胞数为1×106个/mL 的细胞悬液,每只小鼠右腋皮下接种0.2mL。
1.2.2 动物分组与给药剂量
实验组动物随机分为正常组(NC)、阳性对照组(PC)、肿瘤对照组(TC)、鹰嘴豆肽低剂量组(CPe-LD)、鹰嘴豆肽中剂量组(CPe-MD)、鹰嘴豆肽高剂量组(CPe-HD)共6组。除正常组,其他各组小鼠均接种肝癌H22细胞液,接种后第2天,按表1设计方案连续灌胃10d。

表1 实验设计方案Table 1 Experimental design for mouse grouping
1.2.3 肿瘤抑制实验
从接种肝癌H22细胞后第4天开始测量肿瘤的长径和短径,每隔2d测1次,按照式(1)计算肿瘤体积。
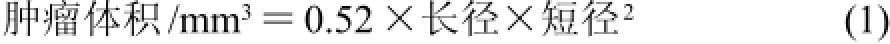
末次灌胃24h后,对小鼠眼窝取血,取血后拉托颈椎处死小鼠,并摘取肿瘤、胸腺和脾,经生理盐水洗涤后用滤纸吸干称质量,分别计算抑瘤率、胸腺指数和脾指数。

1.2.4 迟发型超敏反应(DTH)
接种肝癌H22细胞后第5天,小鼠腹部去毛,用1%二硝基氟苯(DNFB)丙酮麻油溶液在去毛处均匀涂抹致敏(每鼠25μL),24h后重复操作加强致敏一次。加强致敏后第4天,用10μL DNFB溶液均匀涂抹右耳(两面)进行攻击,对照组同样涂耳但未致敏。24h后处死小鼠,剪下左右耳壳,用打孔器在双耳相应部分各取下直径8mm的耳片,称质量,以左右两耳质量差表示肿胀程度。
1.2.5 巨噬细胞吞噬实验(碳粒廓清实验)
1)将稀释的印度墨汁(0.1mL/10g 以体质量计)经尾静脉注入体内,待墨汁注射完毕,立即计时。2)注入墨汁后的2min和10min,用血色素吸管分别从小鼠左右眼眶后静脉丛取血滴于载玻片上,用微量移液器吸取20μL于装有2mL 0.1% Na2CO3溶液的一次性塑料试管中,摇匀。3)以Na2CO3溶液为空白,于波长600nm处测光密度值(OD)。4)拉脱颈椎处死小鼠,取出脾脏和肝脏,用滤纸吸干其表面血液,称质量。按式(5)、(6)计算吞噬指数:

式中:OD1为t1=2min血标本的光密度值;OD2为t2=10min血标本的光密度值。

式中:α为吞噬指数;m体为体质量/g;m肝为肝质量/g;m脾为脾质量/g。
1.2.6MTT法淋巴细胞转化实验
1)脾淋巴细胞悬液:将小鼠拉托颈椎处死,用75%酒精浸泡5~10min,剪开腹部皮肤和腹膜,无菌取出脾脏,放入有5mL PBS(pH7.4)的平皿中,用5mL注射器抽取平皿中PBS液体缓缓注入脾脏内,使脾细胞冲洗出来。反复冲洗,直到脾脏变白为止(约冲洗2~3次),将细胞移入10mL无菌离心管中,1000r/min 5min离心,弃上清。加红细胞裂解液(细胞体积的3~5倍),裂解3min,1000r/min离心5min,弃去上清。用PBS重复洗脾细胞1次,以2mL 10%FCS-R/RPMI-1640培养液重悬细胞,台盼蓝染色检测细胞存活率>95%,调整细胞浓度至1×107个/mL。
2)孵育:每份细胞悬液按100μL/孔加入96孔培养板中,每个样品设3重复,实验组每孔加100μL 10μg/mL的ConA液,对照组加入100μL 10% FCS-R/ RPMI -1640培养液。置于37℃、5%CO2细胞培养箱中孵育72h。
3)MTT处理:培养结束前4h,每孔弃去上清100μL,加入MTT(5mg/mL)10μL/孔,继续培养4h。
4)测定:培养结束后,离心去上清,每孔中加入150μL DMSO,微型振荡器上800r/min振荡5min,使紫色结晶完全溶解。30min内在酶联检测仪波长490nm处比色。
5)结果表示及评价:结果以波长490nm处的光密度值来表示。用加ConA孔的光密度值减去不加ConA孔的光密度值代表淋巴细胞的增殖能力。若实验组的光密度值明显高于对照组的光密度值,说明该实验物对ConA刺激的淋巴细胞增殖功能有促进作用。
1.2.7 数据处理
应用SPSS 15. 0 for Windows 统计软件包进行统计分析。数据用±s表示,组间比较采用t检验。
2 结果与分析
2.1 小鼠及肿瘤外观表征
从整个实验期间看,正常组小鼠:身体匀称,生长旺盛、活跃、动作敏捷、反应灵活、被毛乳白色、浓密、整齐而且富有光泽。
肿瘤对照组小鼠:随着肿瘤的增大,小鼠逐渐表现出活动力低下,反应迟钝,喜欢蜷缩,毛发干枯、凌乱而且无光泽,个别小鼠表现出消瘦、发抖。
鹰嘴豆肽组小鼠:随着肿瘤的增大,部分小鼠逐渐出现活动迟缓,个别小鼠被毛稀疏蓬乱,第9天后大多数小鼠状态优于肿瘤对照组,且食欲有明显改善。
肿瘤对照组肿瘤体积较大、颜色红润、质脆,瘤块假膜不完整,部分浸润生长至腿部肌肉,剥离时容易出血,也有部分肿瘤成灰黑色,切开后可见坏死组织,还有部分肿瘤发生液化,肿瘤形态不完整;鹰嘴豆肽灌胃后的肿瘤组织体积相对较小,颜色略苍白、质韧,瘤块假膜完整,剥离时基本无出血。
2.2 接种后不同时间各组肿瘤体积及肿瘤生长体积曲线
随着实验的进行,鹰嘴豆肽组小鼠肿瘤的生长呈现不同程度的抑制状态(图1),其肿瘤体积与肿瘤对照组的差别逐渐增大,以鹰嘴豆肽中剂量组表现最明显,肿瘤体积的增长速度最为缓慢,实验结束时,鹰嘴豆肽中剂量组与肿瘤对照组肿瘤体积相比差异显著(P<0.05)。
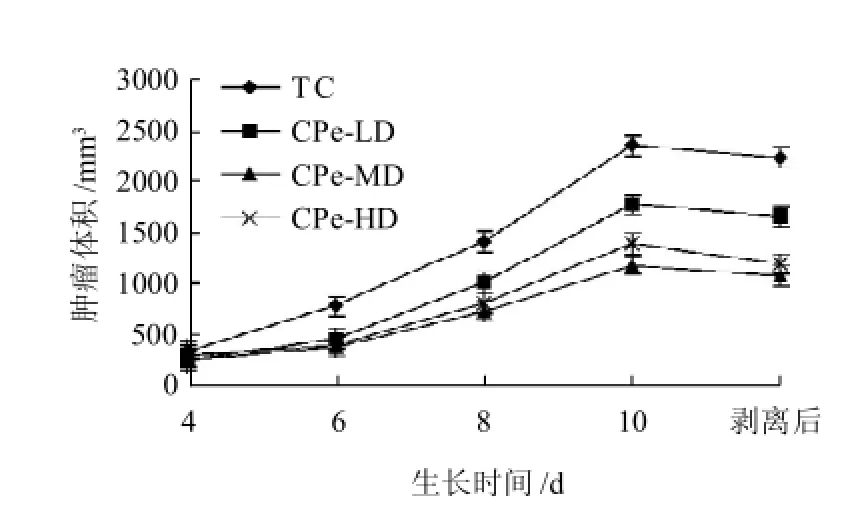
图1 接种后不同生长时间肿瘤生长体积曲线Fig.1 Effect of inoculation time on tumor growth
2.3 鹰嘴豆肽对H22肝癌小鼠的抑瘤作用和对小鼠免疫器官的影响
表2 鹰嘴豆肽对H22小鼠的抑瘤作用和对免疫器官的影响(±s,n=10)Table 2 Effect of chickpea peptides on tumor inhibition and immune organs in H22-bearing mice(±s,n=10)
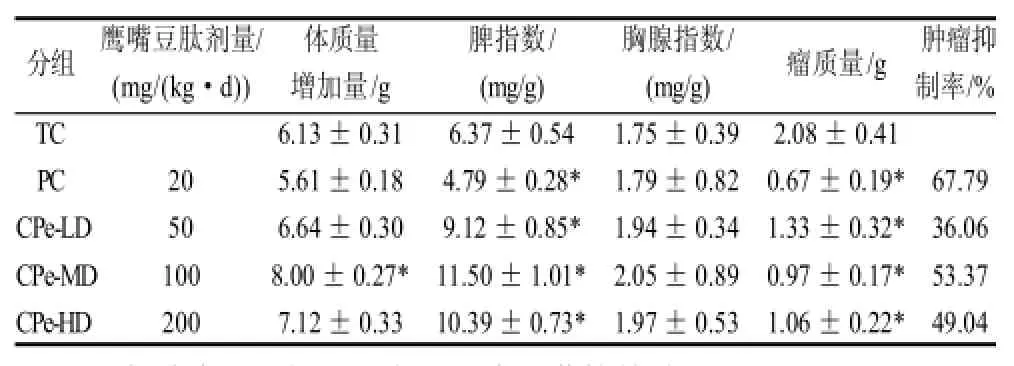
表2 鹰嘴豆肽对H22小鼠的抑瘤作用和对免疫器官的影响(±s,n=10)Table 2 Effect of chickpea peptides on tumor inhibition and immune organs in H22-bearing mice(±s,n=10)
注:*. 与肿瘤对照组(TC)相比,有显著性差异(P<0.05)。下同。
?
由表2可知,在饲喂期间,各组小鼠的体质量均表现出不同程度的增长趋势。鹰嘴豆中剂量组生长速度最快,与肿瘤对照组体质量差异显著(P<0.05),而鹰嘴豆低剂量组与肿瘤对照组差异不显著。阳性对照组小鼠体质量增加较少,个别小鼠的体质量还出现降低现象。肿瘤对照组的肿瘤平均质量为(2.08±0.41)g,H22肝癌小鼠经不同剂量鹰嘴豆肽灌胃后,平均质量均有所减轻,低、中、高剂量组分别降为(1.33±0.32)、(0.97±0.17)、(1.06±0.22)g,其中,低、中、高剂量组与肿瘤对照组相比均有显著性差异(P<0.05),而且中等剂量的效果最好,这表明可能存在抑制肿瘤生长的最佳浓度。另外,鹰嘴豆肽低、中、高剂量组的抑瘤率分别达到36.06%、53.37%、49.04%,但是均低于阳性对照组。
胸腺属于中枢免疫器官,是T淋巴细胞发育和成熟的场所。脾脏是最大的淋巴器官,含有大量的B淋巴细胞、T淋巴细胞和巨噬细胞,也是重要的外周免疫器官之一,另外也是对血源性抗原产生免疫应答的场所,可以通过多种机制发挥抗肿瘤作用。当受到肿瘤抗原刺激后,B及T淋巴细胞经克隆扩增,数目明显增多,致B及T淋巴细胞区体积扩大,这些免疫器官的体积和质量亦相应的增大。B淋巴细胞可以转化为浆细胞,继而分泌特异性抗肿瘤的免疫球蛋白,T淋巴细胞可以直接参与细胞免疫,并对外周血中T细胞亚群的分布有重要调节作用。因此,胸腺指数和脾指数可直接反应机体的免疫水平。鹰嘴豆肽各组与肿瘤对照组相比,脾脏指数显著升高(P<0.05),胸腺指数也有略微升高。而在环磷酰胺的治疗过程中,脾指数和胸腺指数均下降,表明环磷酰胺在治疗过程中,虽然有较高的抑瘤率,但是对免疫器官造成了一定损伤,致使脾脏和胸腺明显萎缩,导致免疫功能降低;而鹰嘴豆低、中、高3个剂量组,在抑制肿瘤的过程中均能促进脾脏和胸腺的生长,以提高机体的免疫功能。
2.4 鹰嘴豆肽对H22肝癌小鼠迟发型超敏反应的影响
二硝基氟苯(DNFB)是一种半抗原,与皮肤蛋白结合形成抗原,能刺激T淋巴细胞增殖成致敏淋巴细胞,再次攻击后会诱发迟发型超敏反应。
表3 鹰嘴豆肽对H22小鼠迟发型免疫(DTH)的影响(±s,n=10)Table 3 Effect of chickpea peptides on DTH of H22-bearing mice (±s,n=10)

表3 鹰嘴豆肽对H22小鼠迟发型免疫(DTH)的影响(±s,n=10)Table 3 Effect of chickpea peptides on DTH of H22-bearing mice (±s,n=10)
?
由表3可知,鹰嘴豆肽各剂量组均提高了肝癌小鼠DTH反应强度,与肿瘤对照组相比均有显著性差异(P<0.05)。其中,鹰嘴豆肽中剂量组效果最明显,其左右耳质量差为肿瘤对照组的1.7倍。
2.5 脾淋巴细胞转化实验

表4 鹰嘴豆肽对H22小鼠脾淋巴细胞的影响(χˉ±s,n=10) Table 4 Effect of chickpea peptides on splenic lymphocytes in H22-bearing mice (χˉ±s,n=10)
由表4可知,脾淋巴细胞的增殖能力为:CPe-HD>PC>CPe-MD>CPe-LD>TC,说明鹰嘴豆肽能显著提高脾淋巴细胞增殖能力,而且鹰嘴豆肽提高脾淋巴细胞的增殖能力呈明显的剂量效应关系,随着剂量的增加,脾淋巴细胞的增殖能力逐渐增强。实验中,相对于鹰嘴豆肽低剂量组,高剂量鹰嘴豆肽可将脾淋巴细胞增殖能力提高1.7倍。说明鹰嘴豆肽高剂量组可以显著提高H22肝癌小鼠的免疫功能。
2.6 碳粒廓清实验
机体免疫系统在抗肿瘤方面起着非常重要的作用,巨噬细胞是体内抗感染和抗肿瘤的主要效应细胞。当巨噬细胞受到异物、肿瘤等激活后可直接杀伤肿瘤细胞,而不伤害正常细胞,还可分泌NO、TNF-α等细胞因子发挥抗肿瘤效应并参与免疫调节[16]。一定浓度的印度墨汁经小鼠尾静脉注射进入血液,经血流带到肝、脾等处,而被这些部位的巨噬细胞及整个单核巨噬细胞系统的其他巨噬细胞迅速吞噬而从血液中廓清,在一定浓度范围内,碳粒的清除速率与其剂量成指数函数关系。因此,可借助测定血液中碳粒的消失速度来反映单核巨噬细胞系统吞噬异物的能力。
表5 鹰嘴豆肽对H22小鼠腹腔巨噬细胞吞噬能力的影响(±s,n=10)Table 5 Effect of chickpea peptides on peritoneal macrophage phagocytotic activity in H22-bearing mices,n=10)

表5 鹰嘴豆肽对H22小鼠腹腔巨噬细胞吞噬能力的影响(±s,n=10)Table 5 Effect of chickpea peptides on peritoneal macrophage phagocytotic activity in H22-bearing mices,n=10)
分组鹰嘴豆肽剂量/(mg/(kg·d))腹腔巨噬细胞吞噬指数TC3.082±0.200 PC204.007±0.310* CPe-LD503.919±0.658* CPe-MD1003.413±0.421 CPe-HD2004.258±0.581*
由表5可知,鹰嘴豆肽对H22小鼠巨噬细胞吞噬能力的影响:CPe-HD>PC>CPe-LD>CPe-MD>TC,鹰嘴豆肽高剂量组和低剂量组都与肿瘤对照组有显著性差异(P<0.05),其中鹰嘴豆肽高剂量组效果最好,巨噬细胞的吞噬能力约为肿瘤对照组的1.4倍,而且高于化疗药物环磷酰胺的作用效果。表明鹰嘴豆肽对H22小鼠巨噬细胞的吞噬能力有促进作用,可以促进H22小鼠非特异性免疫功能,从而发挥抗肿瘤的作用。
3 讨 论
免疫治疗在抗肿瘤过程中有着特殊的地位和作用。一般认为,机体免疫机能的降低有利于肿瘤的形成和发展,而癌症患者常有免疫机能受抑制及免疫器官萎缩[17]。现代医学在恶性肿瘤的防治过程中,把增强机体免疫功能作为非常重要的防病策略和治病目标。但是,化疗药物如本实验中环磷酰胺的使用,引起了机体免疫机能严重下降,脾脏明显萎缩,胸腺指数也较肿瘤对照组有所下降。
本研究中,鹰嘴豆肽对H22肝癌小鼠的活动力、反应能力以及被毛的色泽和浓密情况等有一定的改善作用。与肿瘤对照组相比,鹰嘴豆肽低、中、高3个剂量组均可以显著抑制H22肿瘤的生长,与阳性对照组相比,没有阻碍小鼠体质量的增长,对免疫器官也没有造成损伤,并在一定程度上促进了免疫器官脾脏和胸腺的增长。鹰嘴豆肽各剂量组均提高了肝癌小鼠DTH反应强度,与肿瘤对照组相比差异显著;同时,鹰嘴豆肽亦能显著提高脾淋巴细胞的增殖能力,增强肝癌小鼠腹腔巨噬细胞吞噬能力,鹰嘴豆肽低剂量组和高剂量组与肿瘤对照组相比差异显著。
综上所述,鹰嘴豆肽对H22小鼠的细胞免疫功能、非特异性免疫功能均有一定的促进作用,提示鹰嘴豆肽可作用于免疫系统的多个环节,明显改善机体的免疫功能,逆转因肿瘤生长而造成的免疫抑制状态,这可能是其抑制H22肿瘤生长的重要机制之一。因此可以认为,鹰嘴豆肽在发挥抑癌作用时,并不损坏机体的免疫功能,可以作为一种天然的抗肿瘤成分。另外,鹰嘴豆肽3个剂量组均有不同程度的调节H22小鼠的免疫功能,但是免疫功能并没有随着鹰嘴豆肽剂量的增加而增加,高剂量时效果并不一定比低、中剂量好,因此是否更大剂量的使用会出现免疫抑制或双向调节的作用,其关系机制还需进一步研究阐明。
近些年,国内外对鹰嘴豆肽的研究已经非常多,但都集中在体外实验,包括鹰嘴豆肽的分离纯化[14]、抗菌能力[18]、抗氧化活性评价[19]、ACE抑制肽[20]等。本研究是利用动物模型对鹰嘴豆肽的抗肿瘤作用进行体内评价,具有较高的说服力。为进一步将鹰嘴豆肽开发成为一种新型的功能性基料或食品添加剂应用于食品工业和医药行业奠定了基础。
[1]TREVISANI F, CANTARINI M C, WANDS J R, et al. Recent advances in the natural history of hepatocellular carcinoma[J]. Carcinogenesis, 2008, 29(7): 1299-1305.
[2]KRISHNA R, MAYER L D. Multidrug resistance (MDR) in cancer. Mechanisms, reversal using modulators of MDR and the role of MDR modulators in infiuencing the pharmacokinetics of anti-cancer drugs[J]. Eur J Pharm Sci, 2000, 11(4): 265-283.
[3]姚正良, 刘秦. 鹰嘴豆种质资源鉴定及开发利用前景[J]. 甘肃农业科技, 2001(8): 17-18.
[4]KAUR M, SINGH N. Characterization of protein isolates from different Indian chickpea(Cicer arietinum L.)cultivars[J]. Food Chemistry, 2007, 102(1): 366-374.
[5]ZIA-UL-HAQ M, IQBAL S, AHMAD S, et al. Nutritional and compositional study of Desi chickpea (Cicer arietinum L.) cultivars grown in Punjab, Pakistan[J]. Food Chemistry, 2007, 105(4): 1357-1363.
[6]曾虹燕, 周朴华, 候团章. 红车轴草有效成分的研究进展[J]. 中草药, 2001, 32(2): 189-190.
[7]LI Yanhong, JIANG Bo, ZHANG Tao, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106(2): 444-450.
[8]肖辉, 张月明, 于亚鹭. 鹰嘴豆精粉对高脂大鼠的血脂代谢的影响[J]. 中国公共卫生, 2005, 21(7): 843-844.
[9]王玉芹, 陈娜, 阿吉艾克拜尔, 等. 维药鹰嘴豆及活性部位降血糖作用研究[J]. 中成药, 2007, 29(12): 1832-1834.
[10]MOON Y J, SHIN B S, AN G, et al. Biochanin A inhibits breast cancer tumor growth in a murine xenograft model[J]. Pharmaceutical Research, 2008, 25(9): 2158-2163.
[11]CAMPOS-VEGA R, LOARCA-PIN~A G, OOOMAH B D. Minor components of pulses and their potential impact on human health[J]. Food Research International, 2010, 43(2): 461-482.
[12]AUERBACH L. Complementary and alternative medicine in the treatment of prostate cancer[J]. The Journal of Men,s Health & Gender, 2006, 3(4): 397-403.
[13]RICE L, SAMEDI V G, MEDRANO T A, et al. Mechanisms of the growth inhibitory effects of the isoflavonoid biochanin A on LNCaP cells and xenografts[J]. The Prostate, 2002, 52(3): 201-212.
[14]薛照辉, 刘珊娜, 李勇, 等. 鹰嘴豆蛋白的制备及其抗氧化活性[J].中国油脂, 2008, 33(8): 24-26.
[15]KOU Xiaohong, YU Wancong, WANG Yifan, et al. Antihyperlipidemic effect of hydrolysates of chickpea protein isolate in hyperlipidemic rats [C.]// International Conference of Natural Products and Traditional Medicine, Xi,an, 2009.
[16]张静, 单保恩. 中药抗肿瘤的免疫学调节作用和作用机制研究进展[J]. 中国免疫学杂志, 2006, 22(4): 385-388.
[17]ISKENDER A, AHMET Y. Antioxidant activity of protein extracts from heat-treated or thermally processed chickpeas and white beans[J]. Food Chemistry, 2007, 103(2): 301-312.
[18]CHU K T, LIU K H, NG T B. Cicerarin, a novel antifungal peptide from the green chickpea[J]. Peptides, 2003, 24(5): 659-663.
[19]ZHANG Tao, LI Yanhong, MIAO Ming, et al. Purification and characterisation of a new antioxidant peptide from chickpea(Cicer arietium L.) protein hydrolysates[J]. Food Chemistry, 2011, 128(1): 28-33.
[20]BARBANA C, BOYE J I. Angiotensin I-converting enzyme inhibitory activity of chickpea and pea protein hydrolysates[J]. Food Research International, 2010, 43(6): 1642-1649.
Antitumor and Immune-Enhancing Activity of Chickpea Peptides in Hepatoma H22-Bearing Mice
GAO Jie,WANG Hua,KOU Xiao-hong,XUE Zhao-hui*
(Department of Food Science, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China)
Objective: To find out whether chickpea peptides has antitumor and immune-enhancing activity in hepatoma H22-bearing mice. Methods: KM mice were randomly divided to normal control group, positive control group (PC), tumor control group and chickpea peptide groups at the doses of 50, 100 mg/(kg·d) and 200 mg/(kg·d). The H22-bearing mice were treated with chickpea peptide and Cy by gavage at the volume of 0.2 mL/mouse per day for 10 consecutive days. Distilled water was used for the normal control group. The body weight, tumor growth, tumor inhibitory rate, thymus index, spleen index, cellmediated immune functions including lymphocyte proliferation, peritoneal macrophage phagocytosis and splenic lymphocytes were detected at 24 h after the last administration. Results: An inhibitory tend of tumor growth was observed in the chickpea peptide group. Compared with the tumor control group, a significant increase in relative spleen weight, delayed-type hypersensitivity (DTH), peritoneal macrophage phagocytotic activity and splenic lymphocyte in the chickpea groups was also observed. However, no dose-dependent effect was achieved. Conclusion: Peptides derived from chickpea have anti-tumor activity probably by enhancing immune functions in hepatoma H22-bearing mice. The detailed mechanism remains to be further studied.
chickpea;anti-tumor;hepatoma-H22;immune function
TS255.1
A
1002-6630(2012)03-0215-05
2011-03-07
天津大学创新基金项目(2010XJ-0216)
高捷(1986—),女,硕士研究生,研究方向为天然产物化学及活性。E-mail:gaojie_950814@163.com
*通信作者:薛照辉(1973—),男,副教授,博士,研究方向为天然产物化学及活性。E-mail:zhhxue@tju.edu.cn
