镰刀菌(Fusarium sp. B158)色素的提取及其理化性质
2012-06-01曾祥龙蔡宇杰廖祥儒曾祥康李枝玲张大兵
曾祥龙,蔡宇杰,*,廖祥儒,曾祥康,李枝玲,张大兵
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江苏汉邦科技有限公司,江苏 淮安 223001)
镰刀菌(Fusarium sp. B158)色素的提取及其理化性质
曾祥龙1,蔡宇杰1,*,廖祥儒1,曾祥康1,李枝玲2,张大兵2
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江苏汉邦科技有限公司,江苏 淮安 223001)
从一株新型镰刀菌(Fusarium sp. B158)液态发酵菌丝体提取色素,并对其理化性质进行研究。结果表明:该色素的最佳提取溶剂是酸性乙醇(pH2)。色素的全波长扫描显示,该色素在324nm和360nm波长处均有吸收峰,实验,选择360nm作为色素的最大检测波长。色素的稳定性研究表明,色素对热、光、甜味剂以及常见食品添加剂表现稳定,对溶剂的pH值以及氧化剂和还原剂敏感。大部分的金属离子(Cu2+和Fe3+除外)对色素的稳定性影响不大。
色素;提取;稳定性;镰刀菌
色素,又称着色剂,作为食品添加剂被广泛应用在食品行业中,是决定食品质量的关键因素之一,此外在印染、化妆品和医药行业也有所应用。按照其来源,可以分为人工合成色素和天然色素[1]。长期以来,人工合成色素因其毒副作用,而使用受限[2],不少人工合成色素相继从各国许可使用的名单中删除。天然色素因其安全无毒,色泽自然同时兼具营养价值和药理功能等优越性而日益受到关注和青睐。随着人们消费观念的改变和对自身健康关注的增加,对于天然色素的研究和开发投入增长迅速[2]。
产天然色素的微生物种类繁多,目前已经报道的有原核生物、细菌、真菌、酵母和藻类等,色素颜色包括红、黄、蓝、绿、黑、棕、紫等。产天然色素的微生物开发过程[3-5]主要包括以下几个部分:产天然色素微生物的筛选和鉴定[6];天然色素的提取和分离纯化鉴定[7-8];天然色素的理化性质和应用开发研究[9-13];天然色素的微生物发酵生产[14-17]。
镰刀菌作为一类在自然界中广泛存在和分布的真菌微生物,对其产天然色素的报道早已有之,具有良好的天然色素生产潜力,但对其早期的研究主要集中在致病机理上[18-19]。近年来,随着人们对于天然色素需求的增加,对镰刀菌产天然色素的开发利用逐渐增加[20]。基于对镰刀菌发酵产天然色素应用前景的看好,本实验从一株产天然色素的镰刀菌(Fusarium sp. B158)液态发酵菌丝体中提取色素粗品,并对其理化性质进行研究,以探究该色素在工业生产中的应用前景和价值。
1 材料与方法
1.1 菌种与培养基
镰刀菌(Fusarium sp. B158),本实验室筛选并保藏。
PDA培养基(g/L):土豆200、葡萄糖20、琼脂20,pH值自然;种子培养基(g/L):土豆200、葡萄糖20,pH值自然;液态发酵培养基(g/L):土豆200、葡萄糖20、酵母膏2.5、KH2PO40.005,pH值自然。
1.2 试剂与仪器
甲醇、正丙醇、异丙醇、正丁醇、正己烷、丙酮、氯仿、无水乙醇、乙酸、乙酸乙酯、石油醚、二甲基亚砜、葡萄糖、蔗糖、柠檬酸、苯甲酸钠、山梨酸钾、亚硫酸钠、双氧水等均为分析纯。
CR22GⅡ高速冷冻离心机 日本Hitachi公司;YXQLS-50SII立式压力蒸汽灭菌锅 西安常仪生化仪器有限公司;UV-3000紫外-可见分光光度计 深圳市凯铭杰仪器有限公司;PB-10 pH计 赛多利斯科学仪器有限公司;EZ585Q冷冻干燥机 美国FTS公司;SW-CJ-1F超净工作台 河南天驰仪器设备有限公司;HZC-250回转式恒温摇床 常州诺基仪器有公司;5BG-7000气升式发酵罐 上海保兴生物设备工程有限公司。
1.3 方法
1.3.1 镰刀菌的培养及色素提取
从斜面上挑取一小块菌落转接到种子培养基中(250mL三角瓶,装液量50mL),于26℃、200r/min旋转式摇床中培养36h后,接到4L发酵罐中(装液量3.5L,接种量5%),发酵72h。发酵液经10000×g离心10min,收集红色菌体冷冻干燥,加入4倍体积的酸性乙醇(pH2)浸提4h,10000×g离心10min得黄色色素提取液,向提取液中加入1mol/L NaOH溶液到色素溶液颜色褪尽出现暗红色沉淀为止,10000×g离心10min得暗红色沉淀,即为色素粗品。
1.3.2 提取溶剂对色素提取的影响
分别加入10mL的水、无水乙醇、酸性乙醇(pH2)、甲醇、正丙醇、异丙醇、正丁醇、正己烷、丙酮、氯仿、乙酸、乙酸乙酯、石油醚、二甲基亚砜溶液到干质量为0.1g的菌丝体中,室温条件下浸提4h。
1.3.3 物理和化学处理对色素颜色的影响
对色素溶液进行物理和化学(光照、化学试剂、缓冲液)处理,观察色素溶液颜色变化。取10mL色素酸性乙醇溶液分别放置在日光灯与紫外灯下照射1h。在10mL色素酸性乙醇溶液中分别加入200μL质量浓度为1g/100mL的中性醋酸铅、三氯化铁、碳酸钠溶液及氨水、浓硫酸和浓盐酸,反应5min后观察色素溶液变化情况。
1.3.4 色素的稳定性研究
1.3.4.1 温度对色素稳定性的影响
取5mL色素酸性乙醇溶液分别置于4、20、30、40、50、60、70、80、90、100℃的水浴锅中加热1h,迅速冷却至室温,测吸光度。
1.3.4.2 光照对色素稳定性的影响
取10mL色素酸性乙醇溶液倒于平皿中(用保鲜膜封口),分别置于黑暗、太阳光和紫外灯下24h,每隔3h测1次吸光度。
1.3.4.3pH值对色素稳定性的影响
在1mL色素酸性乙醇溶液中加入pH1~12缓冲液,静置1h,观察色素溶液颜色的变化。
1.3.4.4 金属离子对色素稳定性的影响
在5mL色素酸性乙醇溶液中分别加入500μL浓度为0.005、0.05、0.1mol/L的各种金属离子(Mg2+、Ca2+、Cu2+、Fe3+、Na+、K+、Al3+、Zn2+)溶液。振荡摇匀后黑暗中静置24h,测吸光度。
1.3.4.5 氧化剂与还原剂对色素稳定性的影响
分别取1mL质量浓度为0、0.2、0.4、0.6、0.8g/100mL的Na2SO3溶液和H2O2溶液加入到5mL色素酸性乙醇溶液中,振荡摇匀后静置4h,测吸光度。
1.3.4.6 葡萄糖和蔗糖对色素稳定性的影响
分别取1mL质量浓度为0、2.5、5、7.5、10g/100mL的葡萄糖和蔗糖溶液加入到5mL色素酸性乙醇溶液中,振荡摇匀后静置4h,测吸光度。
1.3.4.7 食品添加剂对色素稳定性的影响
取200μL质量浓度为 1g/100mL的苯甲酸钠、柠檬酸和山梨酸钾溶液加入到5mL色素酸性乙醇溶液中,振荡摇匀后在暗处静置24h,定时测吸光度。
2 结果与分析
2.1 测定色素含量最佳波长的确定
取10mg色素粗品溶于4mL的酸性乙醇(pH2),以酸性乙醇(pH2)溶液作为空白,在200~700nm波长范围内扫描,结果见图1。在200~700nm波长范围内,该色素在324nm和360nm波长处均有吸收峰,考虑到提取液中可能存在的核酸和蛋白质类物质在紫外区均有吸收,而该色素在可见光区基本没有吸收峰出现,因而选取更靠近可见光区的360nm作为最大检测波长用于测定色素溶液的吸光度,以提高色素含量测定的灵敏度和稳定性。

图1 色素吸收光谱图Fig.1 Absorption spectrum of the pigments
2.2 提取溶剂对色素提取的影响

表1 色素在不同溶剂中的溶解情况Table 1 Solubility of the pigments in different solvents
在选择用溶剂萃取法提取天然色素时,应当考虑色素来源和性质的不同。较常使用的溶剂是乙醇、水、丙酮、氯仿、石油醚等。由表1可知,Fusarium sp. B158所产色素易溶于酸性乙醇和乙酸乙酯,微溶于二甲基亚砜。在酸性条件中显黄色,二甲基亚砜中显红色。从安全与经济上来考虑,选用酸性乙醇(pH2)作为最佳提取溶剂。
2.3 物理和化学处理对色素颜色的影响

表2 物理和化学处理对色素颜色的影响Table 2 Effect of physical and chemical treatments on the color of the pigments
由表2可知,该色素经不同的物理和化学处理后,其颜色会发生变化。在可见光和紫外线下,色素颜色不会发生变化,而氨水和碳酸钠因能改变溶液的pH值而造成色素颜色发生变化,并且有沉淀生成。中性醋酸铅能使色素形成白色沉淀,可能是因为该色素中含有能与中性醋酸铅反应形成络合物的邻二酚羟基或其他基团。氯化铁会使色素生成绿色沉淀,说明色素中含有游离酚羟基[21]。经过浓盐酸和浓硫酸处理后,色素颜色并未发生变化,是因为色素在酸性条件下能稳定存在。
2.4 色素的稳定性
天然色素本身存在着很多缺陷,其中主要为稳定性差。在提取和应用的过程中,热、光、空气、金属离子、pH值和其他成分的存在会导致色素的变质或变色。因而,在天然色素的研究中,对其稳定性进行研究是很有必要的。
2.4.1 温度对色素稳定性的影响
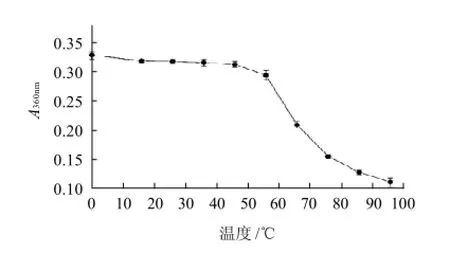
图2 温度对色素稳定性的影响Fig.2 Effect of temperature on the stability of the pigments
由图2可知,在60℃以下加热色素时,吸光度变化不大;在60℃以上加热时,吸光度明显降低。说明该色素具有一定的热稳定性,当温度超过60℃时,其对温度变化变得较为敏感。这可能是因为色素在加热时,不仅会氧化分解,有时还能够引起分解或聚合反应,特别是当色素中的其他杂质较多时,如胶质过多时,加热会引起色素与其聚合成不溶物[22]。
2.4.2 光照对色素稳定性的影响如图3所示,在室内避光放置24h,该色素不会变化,在太阳光直射和紫外灯下照射24h后,色素有些褪色,但不明显;吸光度有所下降,但变化不大。说明该色素具有较好的光稳定性。但仍应尽量避免在加工和使用过程中长时间的日光和紫外线直射。
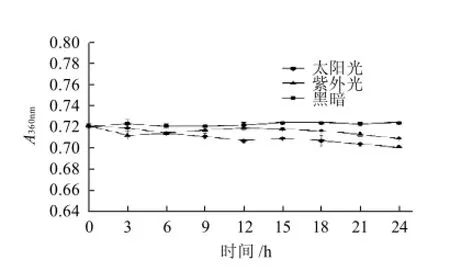
图3 光照对色素稳定性的影响Fig.3 Effect of light on the stability of the pigments
2.4.3pH值对色素稳定性的影响
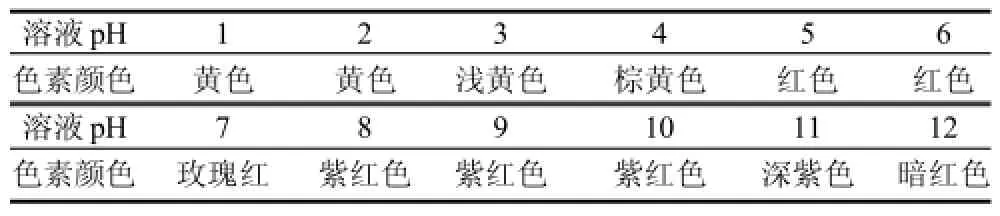
表3 pH值对色素稳定性的影响Table 3 Effect of pH on the stability of the pigments
由表3可知,色素的颜色特征会随着缓冲液pH值的不同而发生变化,这与前期实验相符合,即该色素在酸性条件下能够稳定存在并且显黄色,在中性和碱性条件下,色素的颜色和稳定性都会受到影响。
2.4.4 金属离子对色素稳定性的影响
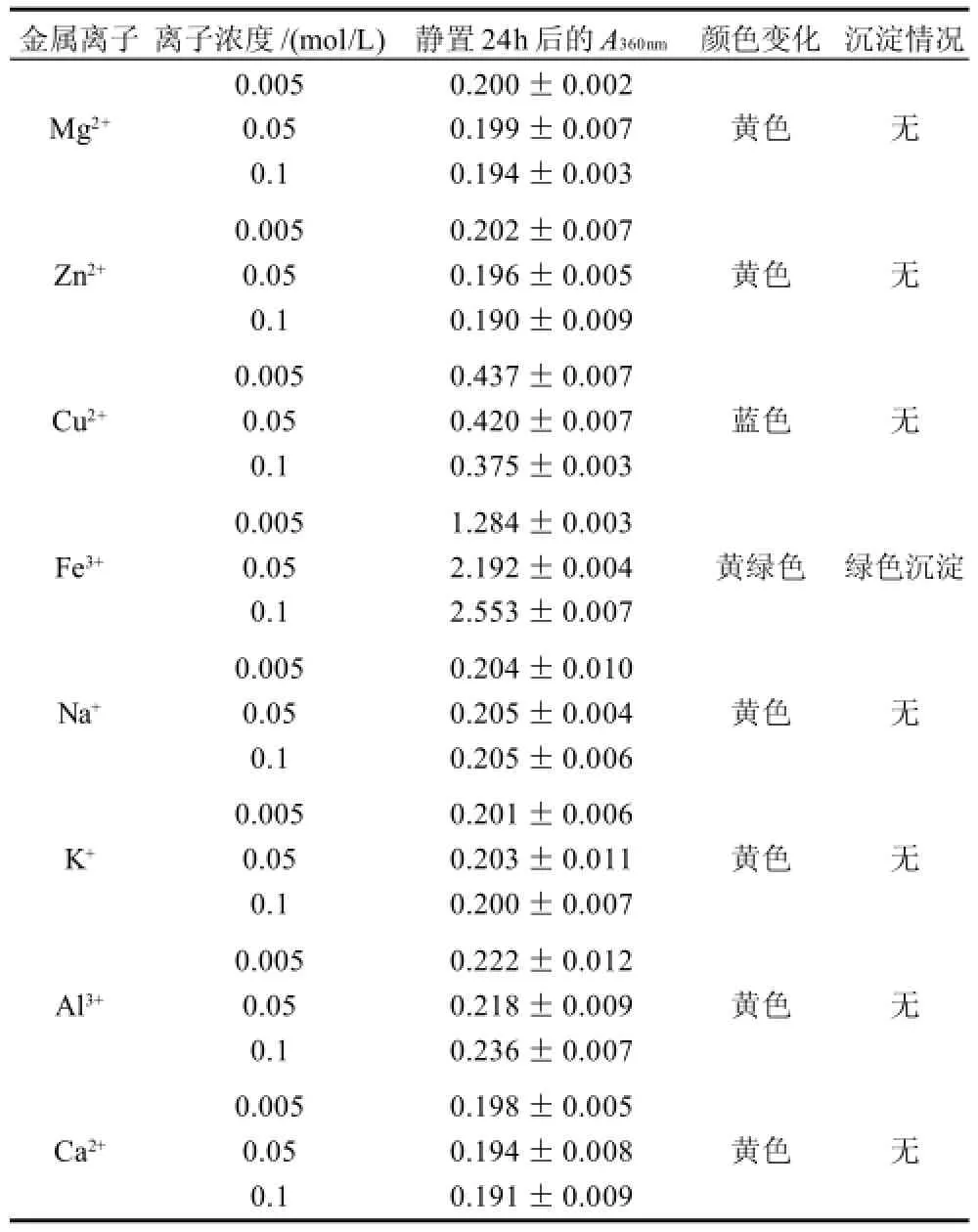
表4 金属离子对色素稳定性的影响Table 4 Effect of metal ions on the stability of the pigments
由表4可知,Ca2+、Al3+、K+、Na+、Zn2+、Mg2+对色素的稳定性影响不大,静置24h后色素的吸光度变化不大。Cu2+的存在使得色素的吸光度增加,同时色素颜色变为蓝色,这是由于Cu2+溶液本身的颜色是蓝色,覆盖和遮掩了色素溶液原有的黄色,从而引起其吸光度和颜色的变化。Fe3+本身有很深的黄色,因而可以增加色素溶液的吸光度,绿色沉淀的产生可能是由于色素的某些基团能够与Fe3+发生络合作用,形成络合物[21]。
2.4.5 氧化剂与还原剂对色素稳定性的影响
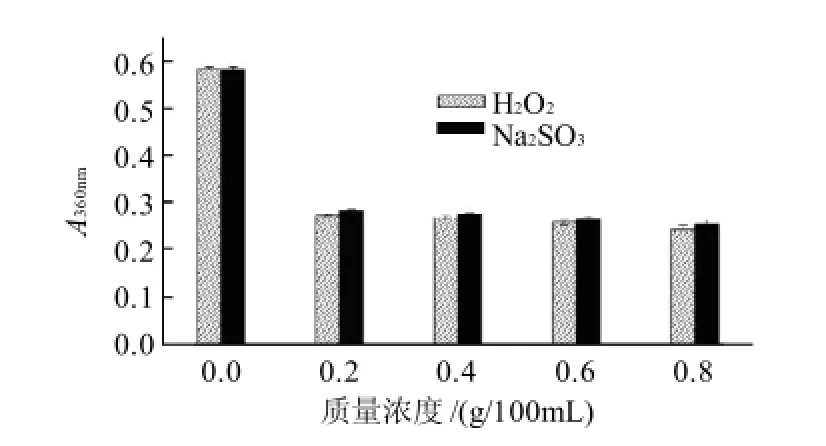
图4 氧化剂与还原剂对色素稳定性的影响Fig.4 Effect of oxidizing and reducing reagents on the stability of the pigments
选用常见的氧化剂H2O2和还原剂Na2SO3为代表,研究其对色素稳定性的影响。结果如图4所示,氧化剂和还原剂的存在会对色素的稳定性造成影响,但这种影响并未随着氧化剂和还原剂质量浓度的增加而发生明显的变化。
2.4.6 葡萄糖和蔗糖对色素稳定性的影响
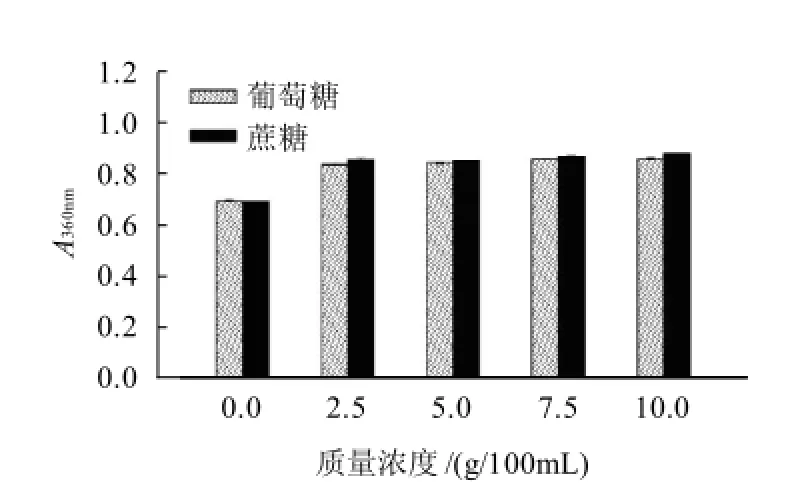
图5 葡萄糖和蔗糖对色素稳定性的影响Fig.5 Effect of sugars on the stability of the pigments
由图5可知,葡萄糖和蔗糖对色素都有一定的增色效应,色素的吸光度有所增加。但是随着糖质量浓度的增加,色素吸光度的升高不太明显,说明色素的耐糖性比较高。因此,食品行业中经常使用的甜味剂可能对色素的稳定性有影响。
2.4.7 食品添加剂对色素稳定性的影响
实验中配制质量浓度为1g/100mL的苯甲酸钠、柠檬酸和山梨酸钾溶液,添加到色素酸性乙醇溶液中处理一段时间。表5表明,苯甲酸钠、柠檬酸和山梨酸钾的存在对色素具有增色作用。

表5 食品添加剂对色素稳定性的影响Table 5 Effect of food additives on the stability of the pigments
3 结 论
以酸性乙醇(pH2)为提取溶剂,从一株新型镰刀菌(Fusarium sp. B158)液态发酵菌丝体中提取得到色素,随后对色素进行理化性质研究。色素全波长扫描显示,色素在波长200~700nm范围内有两个吸收峰,分别为324nm和360nm,考虑到核酸和蛋白质类物质的影响,选择360nm作为色素的最大检测波长,用于色素含量的测定。色素的理化性质研究表明,色素在紫外和可见光下都能稳定存在并显示其本色。中性醋酸铅因能与色素结构中的某些基团发生络合反应而生成白色沉淀。经氨水和碳酸钠处理后,色素颜色发生变化,这可能与色素溶液的酸碱性的改变有关。浓盐酸和浓硫酸因能增加色素溶液的酸性而对其颜色造成影响。色素在酸性条件下对热、光以及甜味剂(葡萄糖、蔗糖)和常见食品添加剂(苯甲酸钠、柠檬酸、山梨酸钾)具有良好的稳定性;大部分的金属离子(Mg2+、Ca2+、Na+、K+、Al3+、Zn2+)对于该色素的稳定性影响不大,Cu2+和Fe3+的存在因能造成色素结构的改变而影响其稳定性和颜色,FeCl3和色素反应有绿色沉淀生成,说明色素中含有游离酚羟基。色素溶液pH值的改变以及氧化剂H2O2和还原剂Na2SO3的存在对于色素的稳定性影响较大。
[1]王君, 张宝善. 微生物生产天然色素的研究进展[J]. 微生物学通报, 2007, 34(3): 580-583.
[2]DUFOSSE L. Microbial production of food grade pigments[J]. Food Technology and Biotechnology, 2006, 44(3): 313-321.
[3]DUFOSSE L, GALAUP P, YARON A, et al. Microorganisms and microalgae as sources of pigments for food use: a scientific oddity or an industrial reality[J]. Trends in Food Science & Technology, 2005, 16 (9): 389-406.
[4]MAPARI S A, NIELSEN K F, LARSEN T O, et al. Exploring fungal biodiversity for the production of water-soluble pigments as potential natural food colorants[J]. Current Opinion in Biotechnology, 2005, 16 (2): 231-238.
[5]MAPARI S A, THRANE U, MEYER A S. Fungal polyketide azaphilone pigments as future natural food colorants[J]. Trends in Biotechnology, 2010, 28(6): 300-307.
[6]DHARMARAJ S, ASHOKKUMAR B, DHEVENDARAN K. Foodgrade pigments from Streptomyces sp. isolated from the marine sponge Callyspongia diffusa[J]. Food Research International, 2009, 42(4): 487-492.
[7]BAKER R A, TATUM J H. Novel anthraquinones from stationary cultures of Fusarium oχysporum[J]. Journal of Fermentation and Bioengineering, 1998, 85(4): 359-361.
[8]MUKHERJEE G, SINGH S K. Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation[J]. Process Biochemistry, 2010, 46(1): 188-192.
[9]赵婷, 林孔亮, 惠伯棣. 微生物源类胡萝卜素研究进展[J]. 食品科学, 2010, 31(23): 461-467.
[10]李一苇, 张明. 链霉菌2ZLT产生的蓝色素性质研究[J]. 激光生物学报, 2008, 17(2): 202-205.
[11]NAGIA F A, El-MOHAMEDY R S R. Dyeing of wool with natural anthraquinone dyes from Fusarium oχysporum[J]. Dyes and Pigments, 2007, 75(3): 550-555.
[12]KOMBOONCHOO S, BECHTOLD T. Natural dyeing of wool and hair with indigo carmine (CI Natural Blue 2), a renewable resource based blue dye[J]. Journal of Cleaner Production, 2009, 17(16): 1487-1493.
[13]VELMURUGAN P, KAMALA-KANNAN S, BALACHANDAR V, et al. Natural pigment extraction from five filamentous fungi for industrial applications and dyeing of leather[J]. Carbohydrate Polymers, 2010, 79 (2): 262-268.
[14]UNAGUL P, WONGSA P, KITTAKOOP P, et al. Production of red pigments by the insect pathogenic fungus Cordyceps unilateralis BCC 1869[J]. Journal of Industrial Microbiology and Biotechnology, 2005, 32(4): 135-140.
[15]BABITHA S, SOCCOL C R, PANDEY A. Solid-state fermentation for the production of Monascus pigments from jackfruit seed[J]. Bioresource Technology, 2007, 98(8): 1554-1560.
[16]YANG Hailong, XIAO Caixia, MA Wenxin, et al. The production of hypocrellin colorants by submerged cultivation of the medicinal fungus Shiraia bambusicola[J]. Dyes and Pigments, 2009, 82(2): 142-146.
[17]VELMURUGAN P, LEE Y H, VENIL C K, et al. Effect of light on growth, intracellular and extracellular pigment production by five pigment-producing filamentous fungi in synthetic medium[J]. Journal of Bioscience and Bioengineering, 2010, 109(4): 346-350.
[18]McLEAN M. The phytotoxicity of Fusarium metabolites: an update since 1989[J]. Mycopathologia, 1996, 133(3): 163-179.
[19]BERESTETSKIY A. A review of fungal phytotoxins: from basic studies to practical use[J]. Applied Biochemistry and Microbiology, 2008, 44 (5): 453-465.
[20]MEDENTSEV A, ARINBASARVA A Y, AKIMENKO V K. Biosynthesis of naphthoquinone pigments by fungi of the genus Fusarium[J]. Applied Biochemistry and Microbiology, 2005, 41(5): 503-507.
[21]龚盛昭. 天然食用色素的化学结构和稳定性的关系[J]. 广州化工, 2002, 30(4): 11-13.
[22]周立国, 李连之. 天然色素的变质原因及其提取应用中应注意的问题[J]. 聊城师院学报: 自然科学版, 1994, 7(3): 67-71.
Extraction and Physico-chemical Properties of Pigments from Liquid-Cultured Mycelia of Fusarium sp. B158
ZENG Xiang-long1,CAI Yu-jie1,*,LIAO Xiang-ru1,ZENG Xiang-kang1,LI Zhi-ling2,ZHANG Da-bing2
(1. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China;2. Jiangsu Hanbon Science and Technology Co. Ltd., Huai’an 223001, China)
In this work, pigments from the liquid-cultured mycelia of Fusarium sp. B158 were extracted and their physico-chemical properties were investigated. The best solvent for extracting pigments from the liquid-cultured mycelia of Fusarium sp. B158 was found to be acidified ethanol (pH = 2). The extract obtained showed maximum absorption at 324 nm and 360 nm. To facilitate further investigations, 360 nm was chosen as maximum absorption wavelength. The pigments were stable to heat, light, sugars and common food additives, but sensitive to pH, oxidizers and reductants. Most of the investigated metal ions (except Cu2+and Fe3+) revealed little effect on the pigments.
pigment;extraction;stability;Fusarium sp. B158
TS202.3
A
1002-6630(2012)03-0131-05
2011-03-09
中央高校基本科研业务费专项资金资助项目(JUSRP21120);国家自然科学基金项目(21045007);江苏省科技创新与成果转化(重大科技支撑与自主创新)专项引导资金项目(BY2010117)
曾祥龙(1987—),男,硕士研究生,研究方向为生物化学与分子生物学。E-mail:xianglongceng@gmail.com
*通信作者:蔡宇杰(1973—),男,副教授,博士,研究方向为工业微生物。E-mail:yu_jie_cai@yahoo.com.cn
