Aes对肝癌细胞恶性生物学行为的影响
2012-05-30李明星袁丹丹陈亮李黎博陈柳李荣惠庞晓辉夏洪伟冷卫兵唐秋琳毕锋
李明星 袁丹丹 陈亮 李黎博 陈柳 李荣惠庞晓辉 夏洪伟 冷卫兵 唐秋琳 毕锋
四川大学华西医院生物治疗国家重点实验室,
信号转导及分子靶向治疗研究室,△腹部肿瘤科,四川 成都 610041
肝癌是我国最常见的恶性肿瘤之一,其复发转移是影响预后的主要因素[1],因此研究与肝癌细胞侵袭、转移的相关分子机制是该领域的一大热点。Aes(amino-terminal enhancer of split,Aes)是转录因子Groucho/TLE家族成员,能与转录因子结合调控转录,但不具有DNA结合位点[2]。近期的研究表明Aes能够通过抑制notch信号通路抑制结肠癌的转移,且Aes的表达缺失能够促进结肠癌的血行转移[3-4],提示Aes在肿瘤转移中扮演着重要角色。为进一步探讨Aes在肝癌转移中的作用,我们检测了Aes在不同肝癌细胞系中的表达情况,通过构建Aes表达载体,转染其低表达的肝癌细胞系HepG2,观察其对肝癌细胞的增殖、侵袭和迁移能力的影响。
1 材料和方法
1.1 材料
1.1.1 细胞系
人肝癌细胞系HepG2、SMMC-7721为本实验室保存。
1.1.2 试剂
细胞培养基RPMI-1640、小牛血清,转染试剂LipofectamineTM2000、Opti-MEM均购自美国Invitrogen公司,兔抗人Aes多克隆抗体购自美国Sigma公司,鼠抗人β-actin单克隆抗体购自武汉博士德公司,CCK-8试剂盒购自日本Dojindo公司,RT-PCR试剂盒购自TaKaRa,质粒pEGFP-N1为本实验室保存。
1.2 方法
1.2.1 质粒的构建和细胞转染及实验分组
通过Primer Premier 5.0设计Aes(NM_001130)的引物,上游引物HindⅢ5’-CCCAAGCTTCCGCGATTGACATGAT-3’、下游引物KpnⅠ 5’-GGGGTACCGTATCCGACTTC TCGCCAT-3’,以cDNA为模板扩增Aes片段,双酶切目的片段,将其连到pEGFP-N1的HindⅢ和KpnⅠ位点,通过酶切鉴定以及测序验证。依照说明书,通过LipofectamineTM2000分别将pEGFP-N1和pEGFP-Aes转入肝癌细胞系HepG2,实验分pEGFP-N1(对照组)和pEGFPAes(实验组)。
1.2.2 RT-PCR检查Aes mRNA的表达
设计A e s上下游引物,上游引物:5’-CACCAGGAGGATGATGGCGAG-3’,下游引物:5’-GGCGTGGAGGTGTCTGGAACTA-3’,扩增产物为560 bp。以GADPH为内参,其上游引物序列为5’-AGAAGGCTGGGGCTCATTT G-3’,下游引物序列为5’-AGGGGCCAT CCACAGTCTTC-3’。TRIzol试剂提取待测细胞的总RNA,取一定量的RNA逆转录获得cDNA后,进行半定量PCR扩增,扩增条件为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环,72 ℃延伸5 min,4 ℃保存。
1.2.3 蛋白质印迹法(Western blot)检测不同细胞系中Aes的表达及外源Aes的表达
收集对数期生长的待测细胞及转染48 h之后的细胞,RIPA裂解液重悬细胞并反复吹打,超声破碎后,4 ℃,134 00×g,离心15 min。取上清液作为细胞总蛋白,BCA法测定蛋白浓度。取一定量的蛋白样品40 μg,进行12%SDSPAGE;260 mA湿转90 min至PVDF膜,5%脱脂奶粉封闭2 h,一抗4 ℃温育过夜,TBST洗涤3次,加入二抗避光温育,摇床2 h,Odyssey红外激发扫描成像系统扫描成像结果。
1.2.4 荧光显微镜观察蛋白定位
转染pEGFP-N1和pEGFP-Aes的细胞在Nikon荧光显微镜蓝光激发下,绿色荧光蛋白发绿光。
1.2.5 细胞增殖能力检测实验
将细胞以每孔1×103接种于96孔板中,LipofectamineTM2000转染,每天每组取3孔,每孔避光加10 μL CCK-8,37 ℃温箱温育2~4 h,Micro-ELISA仪读取光密度,选择490 nm波长,测定各孔吸光值(A),连续5 d,记录结果,以时间为横坐标,A490nm值为纵坐标绘制细胞生长曲线。实验重复3次。
1.2.6 划痕实验检测细胞迁移能力
以每孔2×105个细胞接种对数生长期细胞于6孔板中,第2天分别用LipofectamineTM2000转染pEGFP-N1和pEGFP-Aes,用移液枪头分别在培养板底部呈一字形划痕,每天观察并拍照,镜下记录划痕区细胞的迁移情况,软件分析划痕区的相对距离,并计算其相对迁移率:(第0天记录的相对距离-第3天记录的相对距离)/第0天记录的相对距离×100%。实验重复3次。
1.2.7 Transwell小室检测细胞侵袭能力
将BD hanging cell culture inserts置入24孔板中,将BD Matrigel Basement Membrance Matrix 按1∶3的比例用无血清培养基稀释,取35 μL铺入小室底层,37 ℃放置2 h使其凝固;收集转染48 h的细胞,用无血清培养基重悬,将1×104个细胞250 μL加入小室,下层培养板中加入700 μL含小牛血清20%的RPMI-1640培养基。培养48 h后用棉签拭去小室上层细胞,HE染色,显微镜下观察侵袭的细胞数目,分15个视野对细胞进行计数。实验重复3次。
1.3 统计学处理
实验数据通过SPSS 18.0统计学软件分析,用表示,样本间均数比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
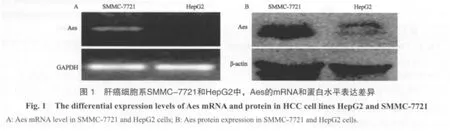
2.1 Aes在不同肝癌细胞系中的表达情况
通过RT-PCR和Western blot检测肝癌细胞系HepG2和SMMC-7721中Aes的mRNA和蛋白表达(图1),发现相对于SMMC-7721,Aes在HepG2中的表达明显降低。因此,我们在随后的试验中选择HepG2作为研究对象,观察了Aes对HepG2恶性生物学行为的影响。
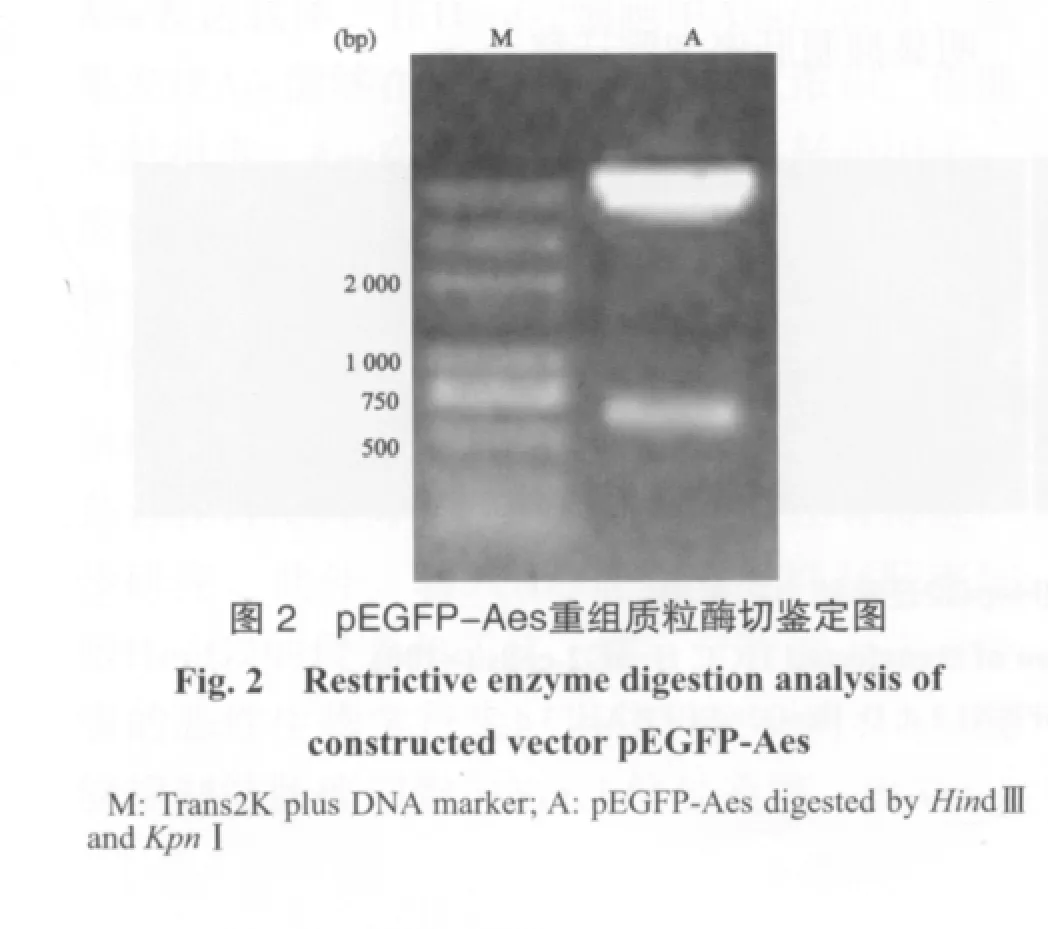
2.2 pEGFP-Aes重组蛋白表达载体构建、酶切鉴定
将构建好的pEGFP-Aes分别经HindⅢ和KpnⅠ酶切后电泳,可见593 bp(Aes编码区片段大小)的片段(图2)。
2.3 pEGFP-Aes在HepG2细胞中的表达鉴定
通过Western blot检测转入的pEGFP-Aes的表达,在荧光显微镜下观察Aes在细胞中的定位,发现Aes在细胞核和细胞质中都有表达,并且能在细胞核中形成点状浓积(图3)。
2.4 Aes对肝癌细胞HepG2生物学行为的影响
2.4.1 Aes对肝癌细胞HepG2增殖的影响
将pEGFP-N1、pEGFP-Aes分别转染HepG2细胞后,CCK-8检测细胞增殖活性,发现与pEGFP-N1组相比,pEGFP-Aes对肝癌细胞HepG2的增殖并无显著影响(图4)。
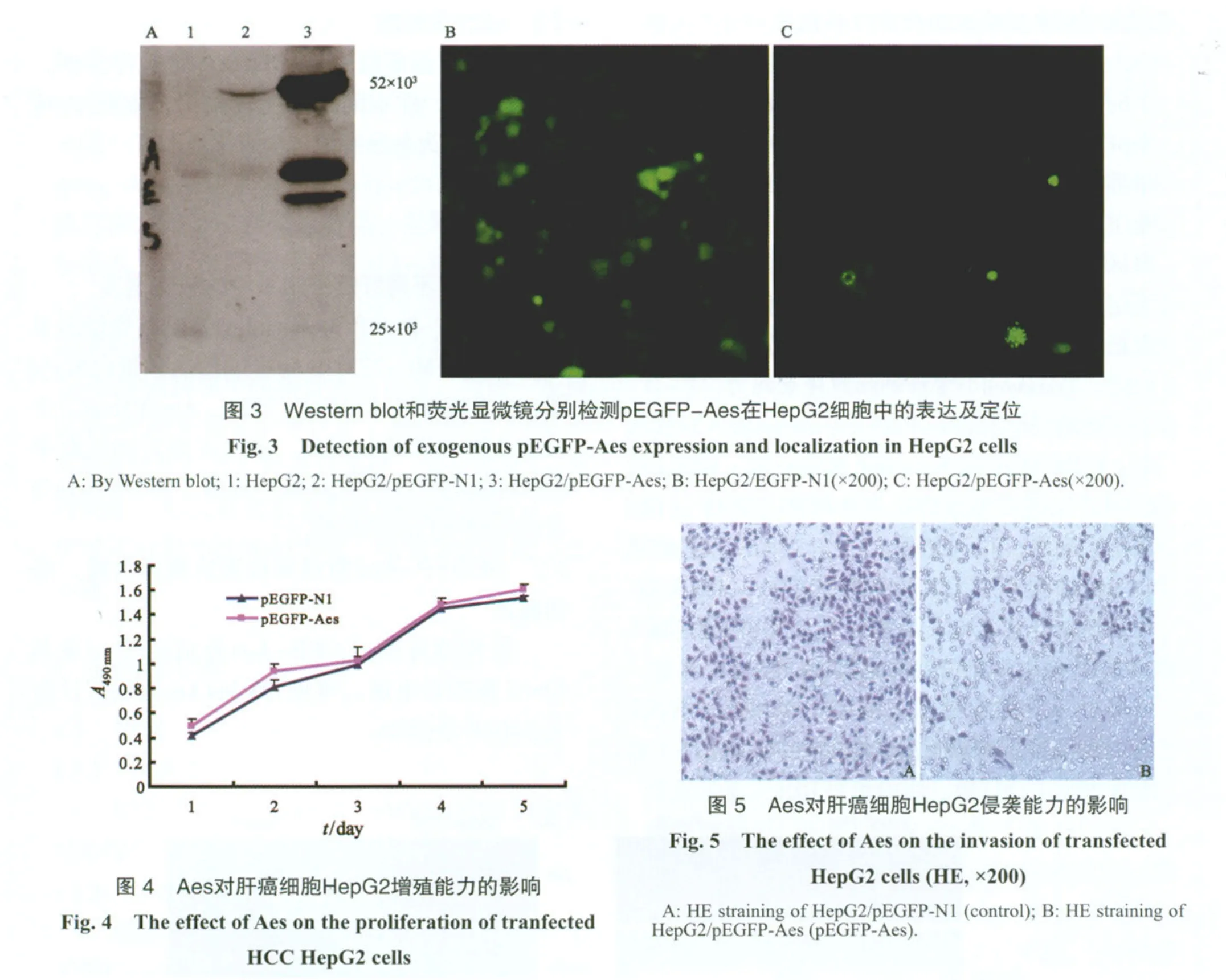
2.4.2 Aes抑制肝癌细胞HepG2的侵袭能力
同pEGFP-N1组相比,转染了pEGFP-Aes的肝癌细胞HepG2发生侵袭的细胞数目明显减少,差异有统计学意义(P<0.05,图5,表1)。
2.4.3 Aes抑制肝癌细胞HepG2的迁移能力
pEGFP-N1组划痕区明显变窄,而pEGFPAes组肿瘤细胞划痕间距离基本没有变化,迁移率明显降低(P<0.05,图6,表1),说明Aes能够明显抑制肝癌细胞迁移。


表 1 pEGFP-Aes对HepG2侵袭迁移能力的影响Tab.1 The effect of pEGFP-Aes on the invasion and migration of transfected HepG2 cells
3 讨 论
Groucho/TLE家族主要是通过与转录因子结合来调控下游基因的表达,Aes是该家族的重要成员之一,但其本身并不具有DNA结合位点,在成骨、神经及眼的发育过程中起重要作用[5-7]。早期的研究表明,Aes能够通过调节TCF/LEF-1的活性来激活Wnt信号通路,从而进一步参与调控发育[8]。
目前,关于Aes的报道较少,其在肿瘤发生、发展和转移过程中所起的作用尚不明确。有研究发现,在细胞质中,Aes能与线粒体蛋白Bit1结合诱导线粒体途径的细胞凋亡[9],近期的研究表明,Aes在结肠癌转移中扮演重要角色,Aes的表达缺失可能是导致结肠癌发生转移的重要因素,但Aes不参与调控结直肠肿瘤的生长[4]。
Aes是否在肝癌转移中也起着至关重要的作用目前尚不清楚。本研究首先检测了不同肝癌细胞系HepG2和SMMC-7721中Aes的表达水平,发现无论是mRNA水平还是蛋白水平,Aes在HepG2中都比较低,由此我们构建pEGFPAes表达载体,在HepG2细胞中Aes过表达,结果发现Aes能够在细胞核中形成点状浓积。根据文献报道,Aes在细胞核内可以募集转录因子,形成难溶的转录抑制复合物,抑制下游基因的转录[3]。我们在荧光显微镜下看到的点状浓积可能是Aes与其他转录因子相互结合抑制基因转录的复合物,但Aes结合的是哪些转录因子,是否在行使其抑制转录因子的功能还有待进一步研究。此外,转入Aes能够明显抑制肝癌细胞HepG2的侵袭和迁移,在一定程度上逆转肿瘤的恶性生物学行为。以往研究证明,Aes能够抑制结肠癌细胞中Notch信号通路,而Notch信号通路与肿瘤的侵袭和迁移有很大联系,例如Notch通路中的配体Notch1表达下调将会抑制NF-κB的活性,进而抑制VEGF和MMP-9的表达[10-11],但此种推断尚需要进一步的实验 证实。总之,研究Aes在抑制肝癌细胞的侵袭和迁移方面所起的重要作用,能够为肝癌的治疗和预后提供一个新的靶点。
[1]AKRIVIADIS E A, LLOVET J M, EFREMIDIS S C, et al.Hepatocellular carcinoma [J].Br J Surg, 1998, 85(10):1319-1331.
[2]BEAGLE B, JOHNSON G V W.AES/GRG5: More than just a dominant-negative TLE/GRG family member [J].Dev Dyn,2010, 239(11): 2795-2805.
[3]SONOSHITA M, AOKI M, FUWA H ,et al.Suppression of colon cancer metastasis by Aes through inhibition of Notch signaling [J].Cancer Cell, 2011, 19(1): 125-137.
[4]CHRISTOFORI G.Metastatic colon cancer cells negotiate the intravasation Notch [J].Cancer Cell, 2011, 19(1): 6-8.
[5]ZHU C C, DYER M A, UCHIKAWA M, et al.Six3-mediated auto repression and eye development requires its interaction with members of the Groucho-related family of co-repressors[J].Development, 2002, 129(12): 2835-2849.
[6]ZHANG X, CHEN H M, JARAMILLO E, et al.Histone deacetylase-related protein inhibits AES-mediated neuronal cell death by direct interaction [J].J Neurosci Res, 2008,86(11): 2423-2431.
[7]GHOSH-DASTIDAR S, NARAYANAN S, STIFANI S, et al.Transducin-like enhancer of split-1 (TLE1) combines with forkhead box protein G1 (FoxG1) to promote neuronal survival[J].J Biol Chem, 2012, 287(18): 14749-59.
[8]ROOSE J, MOLENAAR M, PETERSON J, et al.The xenopus Wnt effector XTcf-3 interacts with Groucho-related transcriptional repressors [J].Nature, 1998, 395(6702):608-612.
[9]JAN Y, MATTER M, PAI J T, et al.A mitochondrial protein,Bit, mediates apoptosis regulated by integrins and Groucho/TLE corepressors [J].Cell, 2004, 116(5): 751-762.
[10]WANG Z, BANERJEE S, LI Y, et al.Down-regulation of notch-1 inhibits invasion by inactivation of nuclear factorkappaB, vascular endothelial growth factor, and matrix metalloproteinase-9 in pancreatic cancer cells [J].Cancer Res, 2006, 66(5): 2778-2784.
[11]WANG Z, LI Y, BANERJEE S, et al.Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth,migration and invasion, and induces apoptosis via inactivation of Akt, mTOR, and NF-kappaB signaling pathways [J].J Cell Biochem, 2010, 109(4): 726-736.
