改良后盆腔脏器切除在卵巢癌初次肿瘤细胞减灭术中的应用
2012-05-30汤洁刘东丽臧荣余李子庭吴小华
汤洁 刘东丽 臧荣余 李子庭 吴小华
复旦大学附属肿瘤医院妇科,复旦大学上海医学院肿瘤学系,上海 200032
肿瘤细胞减灭术是目前晚期卵巢癌治疗的核心方法之一,术后残余肿瘤直接影响患者的预后[1]。要清除盆腔内相互融合、浸润或包绕子宫附件、盆腔腹膜、子宫直肠窝以及乙状结肠粘连成的巨块状肿瘤,对于妇瘤科医生是一个严峻的挑战[2]。为此进行了经腹膜外整块切除子宫附件、盆腔腹膜和部分结直肠并同时行结肠直肠吻合的手术探索[2-5],复旦大学附属肿瘤医院也于2004年在国内率先报道此术式治疗9例晚期卵巢癌和2例复发妇科恶性肿瘤,手术并发症极少[6],随后逐渐在初治的晚期卵巢癌中开展了此类改良后的盆腔脏器切除术。现将结果总结如下。
1 资料和方法
1.1 一般资料
回顾性分析复旦大学附属肿瘤医院妇瘤科2006年1月—2010年12月初次卵巢癌手术患者1 126例,其中50例(4.4%)因肿瘤广泛累及乙状结肠或直肠而将其与盆腔肿瘤连同子宫附件一并切除,同时行乙状结肠和直肠吻合术。患者平均年龄57岁 (37~85岁),术前新辅助化疗(紫杉醇+铂类方案1~2个疗程)4例(8.0%)。术前血红蛋白浓度为114.5 g/L(93~137 g/L),血清CA125浓度为2 578.6 U/mL(21.3~15 125 U/mL)。FIGO分期:Ⅱc期1例(2.0%),Ⅲc期40例(80.0%),Ⅳ期9例(18.0%)。
1.2 改良后盆腔脏器切除方法
手术均由复旦大学附属肿瘤医院妇瘤科医生完成。如术中探查盆腔内肿瘤融合蔓延到生殖器官、盆腔腹膜、乙状结肠或直肠前壁,或肿瘤填塞子宫直肠陷凹,则翻转腹膜包裹盆腔肿瘤连同子宫附件和受累直肠乙状结肠整块切除[6]。最后吻合远端直肠和近端乙状结肠,采用手工端端吻合或吻合器(CEEA,US Surgical或Ethicon公司)端端吻合或端侧吻合。不常规行预防性回肠造瘘或结肠造瘘。满意的细胞减灭术定义为术后肉眼残余肿瘤的单个病灶最大径≤1 cm。
1.3 观察指标
收集改良后盆腔脏器切除卵巢癌患者的临床病理资料,包括手术时间、术中出血量、输血、术后进食时间、术后住院天数及术后病理检查肠管累及情况。同时评价手术安全性,包括术后并发症和手术相关死亡。手术有效性评价则采用手术达肿瘤满意减灭程度和初步生存分析指标。
1.4 统计学处理
采用SPSS 20.0软件包进行统计学分析,生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结 果
2.1 手术情况
乙状结肠直肠吻合方法为手工端端吻合20例(40.0%),吻合器吻合30例(60.0%),其中吻合器端端吻合25例,端侧吻合5例。26例(52.0%)患者行除大网膜切除外的1个或多个其他的腹部手术,其中回盲部切除3例(6.0%),其他肠段切除5例(10.0%),部分小肠切除1例(2.0%),腹膜后淋巴结切除术9例(18.0%),脾切除8例(16.0%),膈面肿瘤切除6例(12.0%)。平均手术时间224 min(150~320 min),腹水平均1 866 mL(0~7 000 mL),估计术中出血量平均1268 mL(100~3 000 mL),49例患者需要输血,平均输红细胞900 mL(0~2 200 mL)。有42例(84.0%)患者术后残余肿瘤最大径≤1 cm,其中19例(38.0%)患者术后无肉眼残余肿瘤。
2.2 术后病理结果
浆液性腺癌占72.0%,86.0%肿瘤分化为3级,88.0%的患者术后病理证实肿瘤累及肠管,84.0%的肠管切缘未见肿瘤累及(表1)。
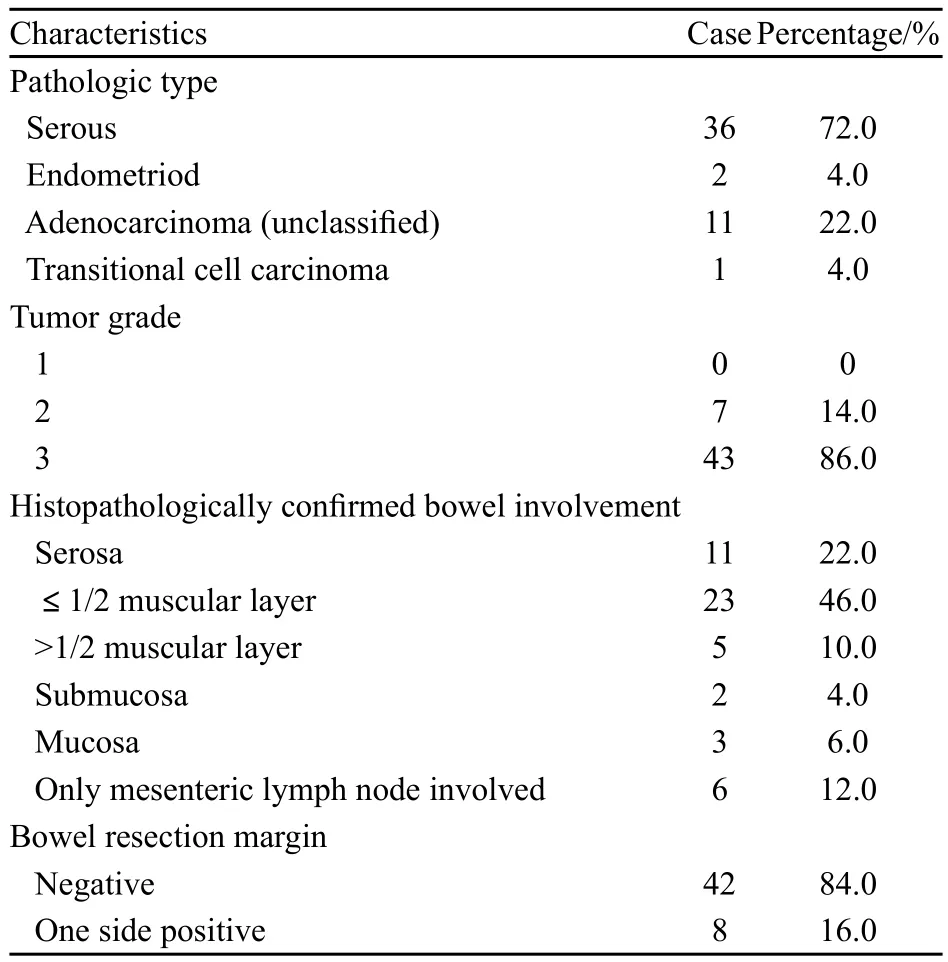
表 1 改良后盆腔脏器切除的病理结果Tab.1 Pathological results of modif i ed posterior pelvic exenteration
2.3 术后情况及并发症
患者术后采用常规广谱抗生素抗炎及静脉营养支持治疗,术后平均7 d(4~18 d)进食流质,术后放置引流管平均为12d(5~21 d),术后住院时间平均为16 d(9~42 d)。有13例(26.0%)术后出现并发症(表2),无围手术期死亡。吻合口漏和直肠阴道瘘各1例(4.0%),前者行横结肠造瘘,后者行抗炎和局部冲洗后好转。术后无造瘘率达98%。
2.4 术后化疗
术后2例患者拒绝化疗,48例接受紫杉醇+铂类化疗,平均化疗6次(1~10次),其中36例完成化疗≥6次。接受化疗者中37例获得临床缓解,9例病情进展,2例疗效不详。
2.5 随访结果
随访截止至2012年6月15日,有5例患者分别于出院后0.2、8、10.8、11.8和21.5个月失访。平均随访时间24.9个月(1.9~57.5个月)。死亡20例,无瘤生存20例,带瘤生存10例。中位生存时间33.8个月(95%CI:28.1~39.5个月)。至末次随访日,41例可评估患者中,17例临床复发或进展(35%),其中有5例患者以盆腔为最早肿瘤进展部位(12.2%)。
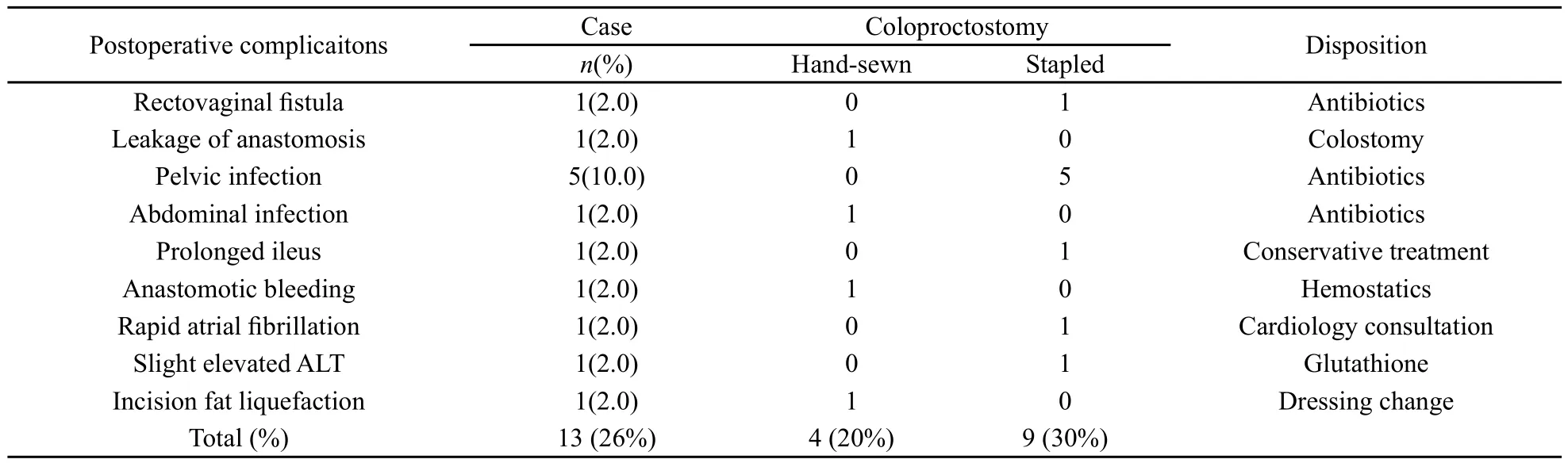
表 2 改良后盆腔脏器切除术后并发症Tab.2 Postoperative complications of modif i ed posterior pelvic exenteration
3 讨 论
由于肿瘤直接蔓延和浆膜种植,卵巢癌常累及直肠、结肠。Hoffman等[7]总结了1 640例卵巢癌患者的临床资料,其中约26%在初次肿瘤细胞减灭术中行结肠切除术。肠切除部位以乙状结肠最常见(56%),其次是回盲部[8]。乙状结肠是卵巢癌最容易累及的器官,并常填塞子宫直肠陷凹。如肿瘤浸润直肠陷凹,仅剥离腹膜而不切除肠管,则多数患者的乙结肠或直肠肠壁上会有残留肿瘤细胞[9],故结直肠也是在常规全子宫、双附件切除之后,肿瘤最易复发的部位。因此作为肿瘤细胞减灭术的一部分,常需要将受累的部分结直肠一并切除。临床研究表明,经腹膜外整块切除子宫附件、部分直肠结肠和盆腔肿瘤的改良后,盆腔脏器及盆腔腹膜切除可达到更满意的盆腔肿瘤减灭效果[5,10]。与以往传统后的盆腔脏器清除术不同的是,此改良的后盆腔脏器切除术在手术切除盆腔肿瘤、子宫附件和结直肠后再行原位结肠直肠吻合,类似于直肠癌的直肠前切除,避免了肠造瘘影响患者术后的生活质量,减轻患者的心理创伤。由于外科医生对于卵巢癌肿瘤细胞减灭意义的不甚理解,故此类手术往往由妇肿瘤科医生独立完成或术中请外科协助手术。研究显示,由妇瘤科医生行结肠手术的并发症发生率要明显低于普外科医生(2.7%vs23.1%)[11]。因此,妇瘤科医生必须熟练掌握此技能,尽最大努力达到最大程度的肿瘤减灭。
通常术前很难评估肿瘤累及肠道情况,难以预测哪些患者需行肠切除手术。术前的纤维结肠镜检查,有助于排除肠道原发性肿瘤,但对于判断卵巢癌累及肠道的意义有限,除了少数卵巢癌转移浸润至肠道黏膜层的患者,或部分显示直肠呈外压性改变。在Park等[5]的研究中,46例行直肠前切的卵巢癌患者术前均进行肠镜检查,结果只有2例发现肠腔狭窄而提示需要行低位直肠切除。此外,由于盆腔肿瘤浸润或包绕子宫附件、子宫直肠窝以及乙状结肠粘连成的巨块状肿瘤,盆腔内正常解剖结构紊乱,脏器界限不清,只有经腹膜后途径,翻转盆腔腹膜才可将盆腔肿瘤与子宫附件、结直肠一并整块切除,因此术中肉眼难以准确判断肿瘤浸润肠管程度。Hertel等[9]分析了100例卵巢癌行直肠切除术后病理结果,有73%术后病理证实肿瘤浸润到肠壁浆膜或更深的肌层、黏膜。另有作者报道,直肠累及的组织病理学吻合率为80.0%(37/46)[5]。在本研究中,88.0%的患者术后病理证实肿瘤浸润肠管(其中66.0%的患者累及肠壁肌层或黏膜),其余6例(12%)患者术后病理诊断结果显示,切除的肠段没有肿瘤侵袭,但伴有肠系膜淋巴结转移。肠系膜切除范围应随相应的肠管切除范围而改变,可以切断直肠上动脉和乙状结肠动脉,但不应影响肠管的血供。由此看来,为达到满意的肿瘤减灭目的,医生应根据术中探查和肿瘤分离情况判定肠管切除术与否可靠,无须等待病理诊断结果而明确直肠侵犯范围。
卵巢癌手术若涉及多器官切除,则会出现手术时间长、出血多、术后并发症较为复杂的情况,尤其是结直肠切除的患者,术后各种并发症的发生率为21.7%~48.8%[2-3,5],常见的有出血、感染、尿潴留、深静脉血栓、肠梗阻、吻合口瘘等。就手术操作而言,吻合口并发症是手术医生最为担忧的问题。Mourton等[4]报道,卵巢癌吻合口瘘的发生率低,仅为4%左右。即便伴有大量腹水(平均2 500 mL),吻合口瘘的发生率也仅为3.2%[7]。本组患者术后并发症发生率为26%,50%患者腹水超过1 500 mL,吻合口并发症为4%,吻合口瘘和直肠阴道瘘各1例,无手术相关死亡。分析本组行手工和吻合器两种吻合的手术情况,前者有更多患者行膈面肿瘤切除(25%vs3.3%,P=0.032),后者则有更高比率的脾切除(26.6%vs0%,P=0.015)。两种吻合方法的手术时间、术中出血量、术后住院天数以及术后并发症发生率等差异均无统计学意义(P>0.05),提示卵巢癌术中使用吻合器进行结场直肠吻合是安全的,方便医生手术操作,缩短手术时间,尤其是低位直肠、乙状结肠吻合。
卵巢癌术中行结直肠切除虽在腹膜返折水平以下,但多数病例肠管下切端距离肛门仍有将近7 cm,可以行直肠结肠吻合术,也不必行预防性回肠造瘘[13]。对1 102例卵巢癌结直肠吻合手术资料分析,在没有预防性造瘘的情况下,平均吻合口瘘的发生率为2.1%,死亡率为0.8%[7]。为保留肠管的血供,可在左结肠动脉起始干以下结扎乙状结肠动脉,而不必像直肠癌手术那样高位结扎肠系膜下动脉以涵盖淋巴引流区。Park等[5]认为,卵巢癌行直肠前切除时,无张力吻合比保留肠系膜下动脉更为重要。除了手术技巧外,发生肠吻合并发症的其他相关因素有腹水、肿瘤病灶广泛、低白蛋白血症和低体重指数等[4-5,7,14]。患者的营养状态与术后并发症有关,已有营养不良而计划行肠道手术的患者应在术前给予肠道外营养,这对于缩短手术时间和减少术中出血也很重要。
研究证实,在卵巢癌初次肿瘤细胞减灭术中作结直肠切除并同时行肠吻合是可行的(表3)[2-5,12-13]。此改良后的盆腔脏器切除术式有助于提高盆腔内肿瘤减灭程度,可使63.6%~87.1%的病例达到满意减瘤(术后残余肿瘤最大径≤1 cm),甚至有报道满意减瘤率为98%。更有25.7%~61.3%的患者达到术后无肉眼残余肿瘤。本组患者平均手术时间224 min,短于文献报道的240~450 min;术中出血量、输血量、平均术后住院时间与文献报道相仿;术后有84.0%的患者残余肿瘤最大径≤1 cm,其中38.0%无肉眼残留肿瘤,显示了较为理想的减瘤效果。本研究属回顾性研究,卵巢癌行改良后盆腔脏器除切术并完成常规化疗的病例数有限,随访时间短,尚难以评判直肠前切对于患者预后的影响作用。目前多数回顾性研究支持包含肠切的满意细胞减灭术对延长患者生存是有积极影响作用的[7,15-16]。Scarabelli等[15]进行多因素研究发现,残余肿瘤的大小是预测肿瘤复发的最强有力的预后因子,行乙状结肠直肠切除术且达满意减瘤的患者(残瘤<1 cm), 其5年生存率与不需行乙状结肠直肠切除术的患者相似。也有报道显示,卵巢癌的预后与肿瘤的生物学特性有关,乙状结肠、直肠切除并不影响患者的生存期[17]。与未行直肠前切术的患者相比,直肠前切术可达到更好的肿瘤减灭效果(P=0.035),且不影响患者的总生存期和无瘤生存期[5]。
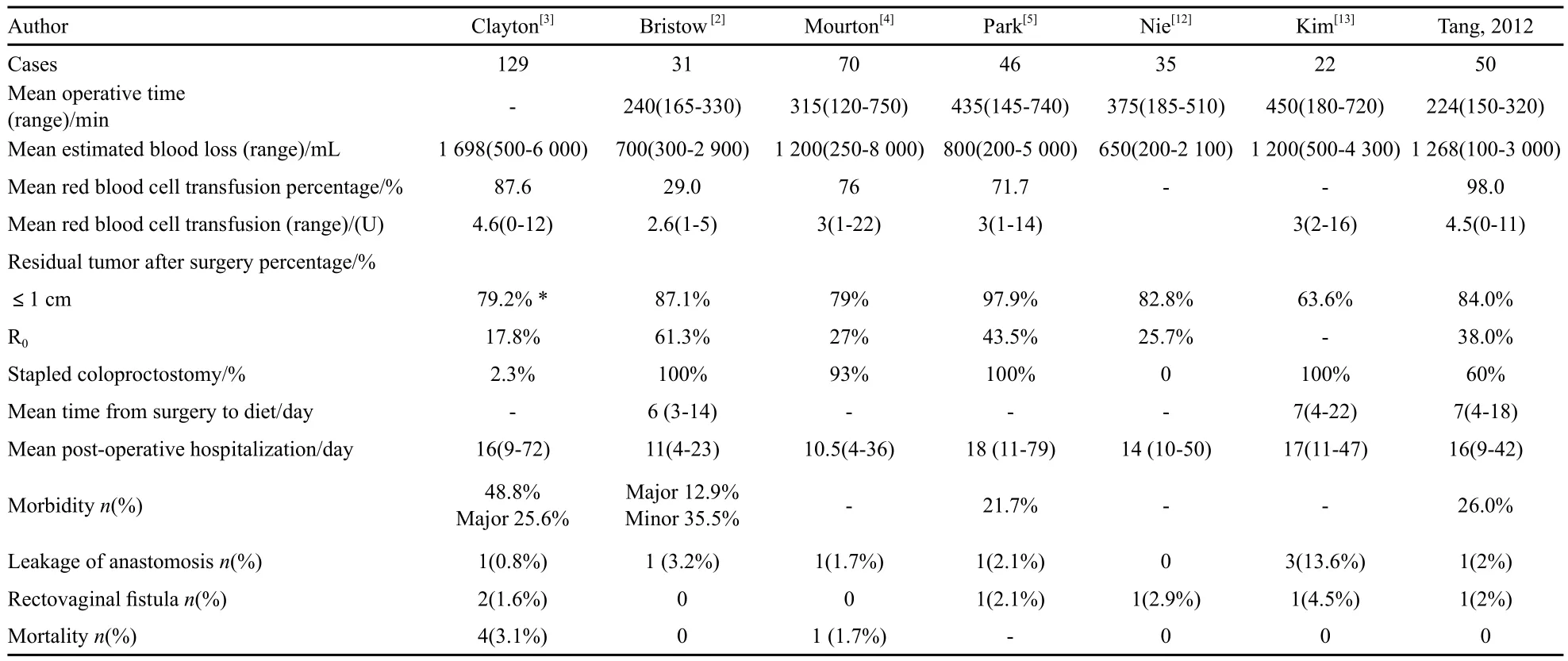
表 3 卵巢癌初次肿瘤细胞减灭术中结直肠切除并行肠吻合手术结果Tab.3 The results of rectosigmoid colectomy with coloproctostomy at primary cytoreduction in patients with ovarian cancer
总之,改良后的盆腔脏器切除术有助于达到理想的盆腔内肿瘤清除,降低并发症发生率和死亡率。该术式可行、安全,有利于提高患者的生存质量。目前尚难以在术前预测是否需要行结直肠切除,所以还是建议由手术医生术中决定。改良后盆腔脏器切除术只是肿瘤减灭术的一部分,在此基础之上,还要尽可能清除上腹部和(或)腹膜后的转移肿瘤。美国Memorial Sloan-Kettering肿瘤中心自20世纪90年代中期开展改良后的盆腔脏器切除术之后,盆腔脏器切除(伴或不伴盆腔腹膜切除)以完全清除盆腔内可见肿瘤,使得Ⅲc期卵巢癌细胞减灭术的满意率由25%提高到50%。2001年以后又开展了更为广泛的上腹部手术,肿瘤减灭的满意率由20世纪90年代中期的50%上升到75%[10]。期待前瞻性研究结果证实广泛盆腹腔手术能使晚期卵巢癌患者有延长生存期的获益。
[1]BRISTOW R E, TOMACRUZ R S, ARMSTRONG D K, et al.Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis[J].J Clin Oncol, 2002, 20: 1248-1259.
[2]BRISTOW R E, DEL CARMEN M G, KAUFMAN H S, et al.Radical oophorectomy with primary stapled colorectal anastomosis for resection of locally advanced epithelial ovarian cancer [J].J Am Coll Surg, 2003, 197: 565-574.
[3]CLAYTON R D, OBERMAIR A, HAMMOND I G, et al.The Western Australian experience of the use of en bloc resection of ovarian cancer with concomitant rectosigmoid colectomy[J].Gynecol Oncol, 2002, 84: 53-57.
[4]MOURTON S M, TEMPLE L K, ABU-RUSTUM N R, et al.Morbidity of rectosigmoid resection and primary anastomosis in patients undergoing primary cytoreductive surgery for advanced epithelial ovarian cancer [J].Gynecol Oncol,2005, 99: 608-614.
[5]PARK J Y, SEO S S, KANG S, et al.The benefits of low anterior en bloc resection as part of cytoreductive surgery for advanced primary and recurrent epithelial ovarian cancer patients outweigh morbidity concerns [J].Gynecol Oncol,2006, 103: 977-984.
[6]吴小华, 李子庭, 赵广法, 等.吻合器低位直肠结肠吻合在妇科肿瘤盆腔根治性手术中的应用[J].上海医学,2004, 27: 629-632.
[7]HOFFMAN M S, ZERVOSE E.Colon resection for ovarian cancer: intraoperative decision [J].Gynecol Oncol, 2008,111(Suppl): 56-65.
[8]HOFFMAN M S, GRIFFIN D, TEBES S, et al.Sites of bowel resected to achieve optimal ovarian cancer cytoreduction:implications regarding surgical management [J].Am J Obstet Gynecol, 2005, 193: 582-586.
[9]HERTEL H, DIEBOLDER H, HERRMANN J, et al.Is the decision for colorectal resection justified by histopathologic findings: a prospective study of 100 patients with advanced ovarian cancer [J].Gynecol Oncol, 2001, 83: 481-484.
[10]ZIVANOVIC O, ALDINI A, CARLSON J W, et al.Advanced cytoreductive surgery: American perspective [J].Gynecol Oncol, 2009, 114(Suppl): 3-9.
[11]GOFF B A, MATTHEWS B J, WYNN M, et al.Ovarian cancer: patterns of surgical care across the United States [J].Gynecol Oncol, 2006, 103: 383-390.
[12]聂继跃, 郭天棋, 王桂荣, 等.卵巢癌肿瘤细胞减灭术中整块切除盆腔肿瘤与受累之直、乙状结肠的研究[J].中华实用诊断与治疗杂志, 2008, 22: 892-894.
[13]KIM H S, KIM E N, JEONG S Y, et al.Comparison of the efficacy of low anterior resection with primary anastomosis and Hartmann’s procedure in advanced primary or recurrent epithelial ovarian cancer [J].Eur J Obstet Gynecol Reprod Biol, 2011, 156: 194-198.
[14]RICHARDSON D L, MARIANI A, CLIBY W A.Risk factors for anastomotic leak after recto-sigmoid resection for ovarian cancer [J].Gynecol Oncol, 2006, 103: 667-672.
[15]SCARABELLI C, GALLO A, FRANCESCHI S, et al.Primary cytoreductive surgery with rectosigmoid colon resection for patients with advanced epithelial ovarian carcinoma [J].Cancer, 2000, 88: 389-397.
[16]SPIRTOS N M, EISENKOP S M, SCHLAERTH J B, et al.Second-look laparotomy after modified posterior exenteration:patterns of persistence and recurrence in patients with stageⅢ and stage Ⅳ ovarian cancer [J].Am J Obstet Gynecol,2000, 182: 1321-1327.
[17]EISENKOP S M, SPIRTOS N M.Procedures required to accomplish complete cytoreduction of ovarian cancer: is there a correlation with “biological aggressiveness” and survival?[J].Gynecol Oncol, 2001, 82: 435-441.
