HPLC测定奥美沙坦酯氢氯噻嗪片含量和有关物质
2012-05-30赵建峰
赵建峰
(北京万生药业有限责任公司,北京 101113)
奥美沙坦酯氢氯噻嗪片是治疗高血压新药,2010年在我国上市,临床用于治疗高血压、充血性心力衰竭。奥美沙坦酯与氢氯噻嗪有互补的作用机制,两者合用既能协同降压,又可以减少氢氯噻嗪的应用剂量,具有快速起效、强效降压和持久降压的特点,适于国内众多高血压患者使用。由于该产品上市时间短,目前文献少见对该产品有关物质测定方法的报道,本研究建立了该产品含量和关物质的HPLC测定方法,简单快速,结果准确。
1 仪器与试药
安捷伦1200高效液相色谱仪及其色谱工作站(安捷伦公司);奥美沙坦酯对照品(原中国药品生物制品检定所,批号100864-200601);氢氯噻嗪对照品(原中国药品生物制品检定所,批号100309-200702);奥美沙坦酸对照品(自制);氯噻嗪对照品(中国药品生物制品检定所,批号101129-201101);奥美沙坦酯氢氯噻嗪片(自制,规格:奥美沙坦酯 20 mg,氢氯噻嗪 12.5 mg);乙腈、甲醇为色谱纯,其余试剂均为分析纯。
2 含量测定研究[1]
2.1 色谱条件[2]
C18色谱柱 (Kromasil,5μm,4.6 mm×250 mm);流动相:A液:0.02 mol/L磷酸二氢钠溶液(用磷酸调节 pH 至 3.0),B 液:甲醇 - 乙腈(100∶900);梯度洗脱,0~17 min,流动相A的体积分数从85%降至20%;17~20 min流动相A的体积分数从20%增加至85%;20~25 min流动相A的体积分数保持85%不变。检测波长为272 nm;柱温为30℃。理论塔板数按奥美沙坦酯峰和氢氯噻嗪峰计应均不低于3 000。奥美沙坦酯峰和奥美沙坦酸峰的分离度应符合要求,氢氯噻嗪峰和氯噻嗪峰的分离度应符合要求。
2.2 线性关系考察
分别精密取奥美沙坦酯对照品20.26 mg,氢氯噻嗪对照品12.65 mg,精密称定,置100 mL量瓶中,加稀释液[0.02 mol/L磷酸二氢钠溶液(调节 pH 至 3.0)-乙腈(50∶50)]超声溶解后并稀释至刻度,摇匀。在上述色谱条件下检测,结果见图1。

图1 奥美沙坦酯氢氯噻嗪片含量HPLC图A对照品 B供试品 C阴性对照
精 密 量 取 1、5、10、15、20 mL 上 述 溶 液 置100 mL量瓶中,用稀释液稀释至刻度,摇匀。精密量取各20μL注入液相色谱仪,测定峰面积。根据奥美沙坦酯浓度C与峰面积A绘制标准曲线,并求得线性回归方程:
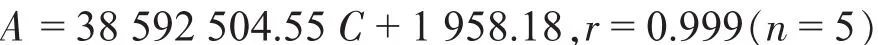
奥美沙坦酯浓度在0.002 026~0.040 52 mg/mL之间呈良好的线性关系;根据氢氯噻嗪浓度C与峰面积A绘制标准曲线,并求得线性回归方程:
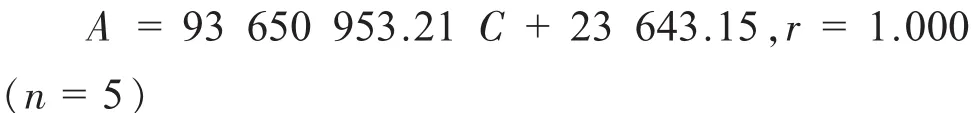
氢氯噻嗪浓度在0.001 265~0.025 30 mg/mL之间呈良好的线性关系。
2.3 回收率试验
按处方量称取辅料,另取奥美沙坦酯对照品20 mg和氢氯噻嗪对照品12.5 mg各3份,分别置100 mL量瓶中,加稀释液超声溶解并稀释至刻度摇匀,滤过,精密量取5 mL置50 mL量瓶中,用稀释液稀释至刻度摇匀,得中浓度供试品溶液(100%)3份,同法制得低浓度供试品溶液(80%)和高浓度供试品溶液(120%)各3份。按色谱条件进样,并按外标法以峰面积计算回收率,结果奥美沙坦酯平均回收率为99.8%,RSD为0.59%(n=9);氢氯噻嗪平均回收率为99.5%,RSD为0.68%(n=9)。
2.4 精密度试验
取奥美沙坦酯氢氯噻嗪片1批(自制),于同1日内及不同日内分别按上述方法测定含量5次,日内奥美沙坦酯的平均含量为99.8%,RSD为0.35%,氢氯噻嗪的平均含量为99.6%,RSD为0.30%;日间奥美沙坦酯的平均含量为99.6%,RSD为0.46%,氢氯噻嗪的平均含量为99.5%,RSD为0.58%。
2.5 溶液的稳定性和重现性试验
取含量测定项下的溶液,分别在 0、1、2、4 h进样,测得奥美沙坦酯峰面积的RSD值为0.55%,氢氯噻嗪峰面积的RSD值为0.52%。表明本品4 h内稳定,进样重现性良好。
3有关物质研究[3]
3.1 色谱条件
检测波长为225 nm;其他色谱条件同含量测定项。
3.2 实验方法
取本品20片,研细,精密称取适量(约含奥美沙坦酯20 mg),置100 mL量瓶中,用稀释液超声溶解并稀释至刻度,振摇均匀,用0.45μm微孔滤膜滤过,续滤液作为供试品溶液。取供试品溶液用稀释液稀释100倍作为对照溶液;量取对照溶液20μL注入液相色谱仪,调节检测灵敏度,使氢氯噻嗪峰高约为满量程刻度的20%;再精密量取供试品溶液和对照溶液各20μL,分别注入液相色谱仪。供试品溶液如显杂质峰,扣除空白溶剂峰,在氢氯噻嗪主峰相对保留时间0.86处的杂质不得大于对照溶液中氢氯噻嗪主峰面积(1.0%),在奥美沙坦酯主峰相对保留时间0.92处的杂质不得大于对照溶液中奥美沙坦酯主峰面积(1.0%),其他单个杂质不得大于对照溶液中奥美沙坦酯和氢氯噻嗪两主峰面积和的50%(0.5%),总杂质不得大于对照溶液中奥美沙坦酯和氢氯噻嗪两主峰面积和的1.0倍(1.0%)。检测结果见图2。
3.3 溶液稳定性考察
按要求配制供试液和对照液,于 0、1、2、3 h分别注入液相色谱仪,证明本品溶液放置2 h,相对奥美沙坦酯0.92处的杂质峰明显增加。
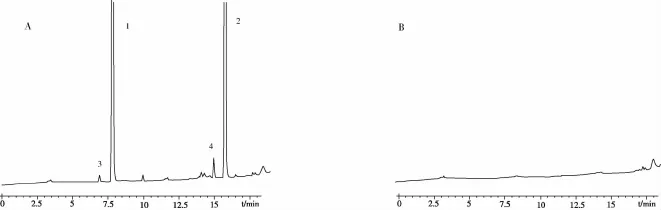
图2 奥美沙坦酯氢氯噻嗪片有关物质的HPLC图A供试品 B阴性对照
3.4 专属性考察
高温破坏试验(120℃放置 2 h),光照破坏试验(4 500 lx放置10 d),强酸破坏试验(加1 mol/L HCl溶液 5 mL,于 60℃水浴放置 0.5 h),强碱破坏试验(加 1 mol/L NaOH溶液 5 mL,于 60℃水浴放置0.5 h)和氧化破坏试验(加6%双氧水溶液 5 mL,于60℃水浴放置 1 h),上述条件下均有新杂质产生,主成份峰有不同程度的降解,总杂质明显增大,主峰与杂质峰能够完全分离。
4 讨论
有关物质检查溶液稳定性考察表明,溶液放置2 h,杂质奥美沙坦酯酸峰明显增大,故本品应临用新配。
经反复试验选定色谱条件,该条件下,氢氯噻嗪主峰相对保留时间0.86处的杂质为氯噻嗪,二者分离度为3.0;奥美沙坦酯主峰相对保留时间0.92处的杂质为奥美沙坦酸,二者分离度为5.5,主峰和杂质峰能够很好的分离。测定方法研究结果表明,该方法精密度高,重现性好,可用于奥美沙坦酯氢氯噻嗪片的含量和有关物质测定。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:附录194.
[2]陈敏,周斌,魏大鹏.HPLC法测定复方奥美沙坦氢氯噻嗪片的含量[J].中国新药杂志,2006,15(23):2050-2052.
[3]张玉琥.仿制药有关物质研究的特点及研究思路[J].中国执业药师,2009,6 (6):31-34.
