PI3K蛋白和mRNA在鼻咽癌组织中的表达及意义
2012-05-30兰桂萍张名霞王振霖张秋航
齐 岩,黄 波,兰桂萍,张名霞,严 波,王振霖,张秋航*
(1.首都医科大学宣武医院 耳鼻咽喉头颈外科,北京100053;2.广西壮族自治区人民医院 耳鼻咽喉头颈肿瘤科,广西 南宁530021)
鼻咽癌(Nasopharyngeal carcinoma,NPC)是源于鼻咽部上皮组织的一种恶性肿瘤,具有显著的种族及地区聚集性和复杂的病因学,其病因尚未完全明了,发生部位隐蔽,又与周围重要器宫毗邻,具有易于向邻近器官直接浸润或淋巴结转移的生物学行为,症状隐蔽且多变,早期常被误诊。鼻咽癌生物学行为最大的特点就是易转移,其颈淋巴结转移率达到75%以上[1]。且转移在发病早期即有发生,45%-50%的患者是以颈部肿块为首发症状就诊的[2]。这一特点严重影响了鼻咽癌患者的预后。尽管近年来诊断手段、放射治疗设备和技术的不断更新,但其该病的5年总生存率仍徘徊于50%-60%[3]。因此,寻找鼻咽癌相关特别是与侵袭和转移相关的分子标志物以判断其生物学特性和预后,寻找临床治疗有效的分子靶向,对积极诊断、治疗恶性肿瘤,提高鼻咽癌患者的生活质量,延长生存时间都具有重要意义。PI3K是与肿瘤侵袭和转移相关的生物学指标。本研究首次在核酸水平检测PI3K在鼻咽癌组织中的表达水平并探讨其信号分子与鼻咽癌临床特征的关系。
1 材料与方法
1.1 一般资料 所有组织标本均来自2003年9月至2004年9月于广西壮族自治区人民医院耳鼻喉头颈外科二区门诊就诊的病人,共102例,所有患者初诊时经病理组织学检查确诊,均未经治疗。20例对照组为门诊要求体检的正常人群鼻咽部活检组织,病理诊断均鼻咽正常上皮组织。经广西壮族自治区人民医院伦理委员会通过,所有参与实验的患者均签署知情同意书。组织标本活检后生理盐水冲洗洁净分为两部分,其中一部分在活检后10min内置入液氮内,取其中28例随后放入-80℃冰箱保存用于Q-RT-PCR;另一部分置于10%中性福尔马林液中固定用于免疫组化。
1.2 试剂与方法
1.2.1 免疫组化的试剂为PI3K鼠抗人单克隆抗体(Cell Signaling#4249工作浓度1∶75)。采用免疫组化方法,所有新鲜标本经中性福尔马林固定,48小时内取材,石蜡包埋,连续4μm切片,HE染色。采用链霉抗生物素蛋白-过氧化酶(SP)免疫组织化学染色方法检测PI3K的表达。用PBS代替一抗作空白对照。用已知的肝癌组织的PI3K阳性切片作阳性对照。
1.2.2 QRT-PCR检测 首先用 Trizol试剂一步法提取组织总RNA,进行重组标准品质粒的制备,使用AMV逆转录试剂盒(加拿大BBI公司)制备cDNA第一链,引物由上海生物工程技术公司合成,应用GAPDH为内参,基因引物序列及扩增片段如下表1,根据测得的A260值和重组质粒的分子质量换算成质粒的拷贝浓度(copy/μl),将母液浓度调整至1×1011copy/μl作为原液,取部分原液作10倍系列稀释成108-103copy/μl的梯度浓度标准品。Chromo 4实时荧光定量PCR仪上扩增。反应条件:94℃5min;94℃20s、58℃30s、读板,40个循环。染料为SYBR GreenⅠ(BBI)反应结束后,联机生成标准曲线。自动计算出曲线的斜率(slope),并根据公式E=10[-1/slope]计算出扩增效率(1.0≤E≤2.0)。检测引物和反应条件按标准曲线,反应完成得到的记录点曲线,计算出临界循环数(Ct值)。根据陈剑英[4]的方法,以GAPDH mRNA的量为内参照,计算目的基因mRNA的相对量。计算公式为:

1.3 结果判定
免疫组化结果判断标准参照陈丰霖[5]等的方法:采用双盲法,观察切片至少5个以上具有代表性的高倍视野,不少于1000个细胞,对免疫组化结果进行评估[5]。根据染色程度及染色细胞百分率进行分析评定:基本不着色为0分,着色淡为1分,着色较深为2分;着色细胞占计数细胞百分率:≤5%为0分,6%-25%为1分,26%-50%为2分,≥51%为3分,以每张切片染色程度和染色细胞百分率得分相乘的积为最后得分。得0-1分者判为阴性(-),得2分者判为弱阳性(+),得3-4分者判为中等阳性 (++),5-6分者判为强阳性 (+++)。
1.4 统计学处理
应用SPSS11.0分析软件,免疫组化的数据采用χ2检验及四格表确切概率法。计量资料采用t检验,分类变量资料以相对数表示。P<0.05表示差异有统计学意义。
2 结果
2.1 免疫组化染色显示 SP法免疫组化染色所有切片染色背景清晰,阴性对照不着色。PI3K阳性反应呈棕黄色,主要存在于细胞浆。

表1 PCR引物
2.2 102例鼻咽癌中,PI3K阳性表达86例(84.3%),染色呈棕褐色弥漫性分布。其中25例(24.5%)弱阳性表达,61例(59.8%)强阳性表达,阴性表达16例(15.7%),见表2、图1。

图1 A所示PI3K在鼻咽癌组织中的表达,PI3K阳性反应呈棕黄色,主要存在于细胞浆,图中标尺代表50μm。B所示PI3K在鼻咽部正常上皮组织中的表达呈阴性,图中标尺代表75μm。
2.3 分析发现鼻咽癌组织中PI3K表达与鼻咽部正常上皮组织相比有显著差异,鼻咽正常上皮组PI3K表达显著低于鼻咽癌组,两者差异有统计学意(P=0.013),见表2。

表2 PI3K在鼻咽癌组织和鼻咽部正常上皮中的表达
2.4 鼻咽癌中PI3K表达与临床病理的关系
结合患者的临床资料,反映PI3K表达率的临床意义。我们看到PI3K与患者的年龄、性别均无关,而在分化程度、浸润深度等临床病理指标之间的差异比较则显示统计学意义非常显著,见表3。
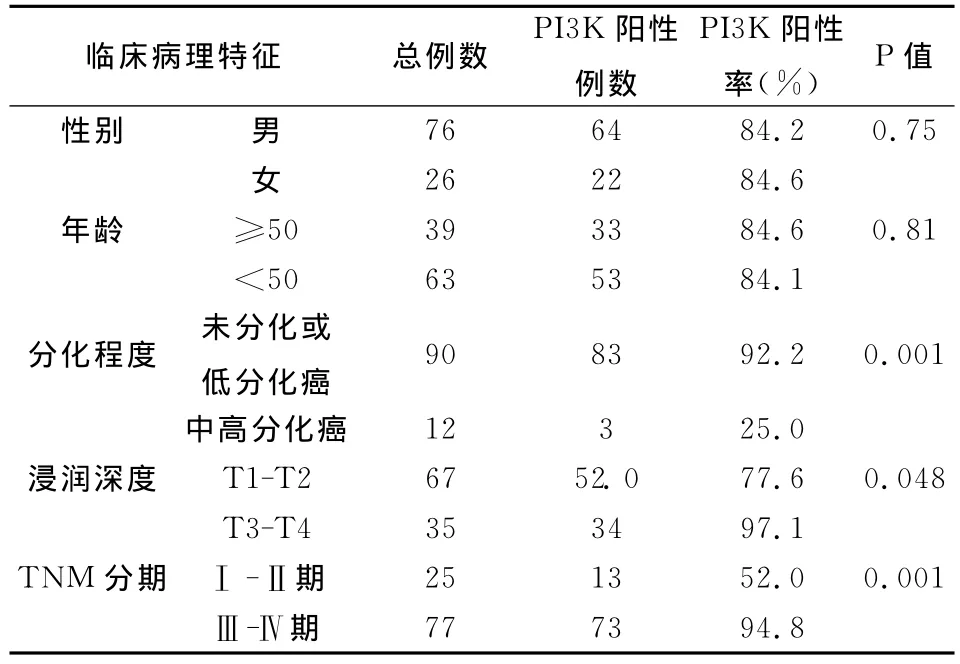
表3 鼻咽癌中PI3K表达与临床病理的关系
2.5 在鼻咽癌组织中,PI3K的mRNA表达量明显高于鼻咽部正常上皮组织组,差异有统计学意义(P=0.0424)见图2。
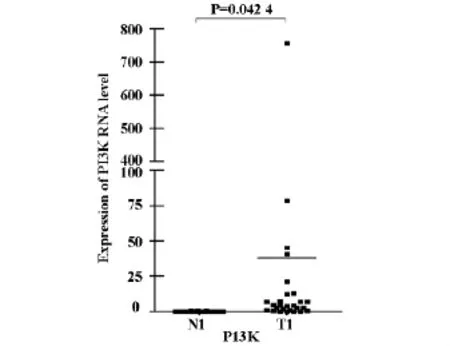
图2 Q-RT-PCR检测PI3K的mRNA表达量
3 讨论
目前的研究表明,PI3K是磷脂激酶家族中的一个重要成员[6],有研究者在前列腺癌患者中发现多种生长因子(如胰岛素样生长因子和转化生长因子)及其受体可以刺激P I3K/mTOR信号通路的过表达[7]。此通路的活化在肝癌、肺癌、胰腺癌等许多肿瘤中均有报道[8]。还有研究表明,抑制PI3K通路可以提高对肿瘤细胞的放疗与化疗效果[9]。本论文以免疫组化SP法和Q-RT-PCR的方法分别从蛋白和mRNA水平来检测鼻咽癌组织和鼻咽部正常上皮组织中PI3K的表达,其在102例鼻咽癌组织中表达阳性率为84.3%,而对照组表达阳性率为30%。癌组织PI3K的阳性率远高于对照组,差异明显(P<0.05)。目前有学者通过免疫组化法研究发现PI3K在鼻咽癌组织中的蛋白表达增高[10],这与本文的结果相似。而本研究采用免疫组化和实时荧光定量PCR技术使得其结果更为准确。在实时荧光定量PCR的结果中,我们观察到PI3K量作为衡量表达水平的参数,鼻咽癌组织中PI3K的表达水平显著升高,大多超过104数量级,可以定义为超表达。而其超表达与肿瘤的恶性表型、分化程度、浸润深度都密切相关,并可能成为预测肿瘤侵袭和转移的依据之一。
而且,在对表2进行分析时,我们定义,(-)和(+)为低水平表达,(++)和(+++)为高水平表达,鼻咽癌标本中PI3K的表达大多数属于高水平表达。实际上,这与临床资料也是非常吻合的。在本论文检测和分析的102例患者中,发现淋巴结转移者达到90例之多,而只有12例没有淋巴结转移的征象。
总的来说,我们发现鼻咽癌PI3K的表达水平的改变表现下述特点:(1)表现为mRNA和蛋白表达增加;(2)PI3K表达水平与肿瘤的恶性表型相关,例如细胞低分化和淋巴结转移;其高表达是与鼻咽癌恶性表型相关的重要指标,它们的高表达可以作为判断鼻咽癌患者肿瘤恶性程度的必要参考指标。
[1]夏云飞,钱剑扬,张恩黑.实用鼻咽癌放射治疗学[M].北京:北京大学医学出版社,2003:86-87.
[2]董志伟,谷铣之.临床肿瘤学[M].北京:人民卫生出版社,2002:463.
[3]Chan ATC,Teo PML,Ngan RKet al.Concurrent chemotherapyradiotherapy compared with radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma:Progression-free survival analysis of a phase III randomized trial[J].J Clin Oncol,2002,20:2038.
[4]陈剑英,胡成进,赵苗青.大鼠TGF2βmRNA表达水平的SYBR GreenⅠ荧光定量RT-PCR方法的建立[J].中国实验诊断学,2005,9:279.
[5]陈丰霖,王小众,李建英,等.胃癌组织中cox-2与 NF-KB的表达及关系[J].临床消化病杂志,2003,15:109.
[6]Sander EE,van Delft S,ten KloosterJ P,et al.Matrix-dePendent Tiam1/Rac1signaling in epithelial cells promotes either cell-cell adhesion or cell migration and is regulated by phosphatidylinositol3-kinase[J].J Cell Biol,1998,143(5):1385.
[7]Murillo H,Huang H,Schmidt LJ,et al.Role of PI3Ksignaling in survival and progression of LNCaP prostate cancer cells to the androgen refractory state[J].Endocrinology,2004,142:4795.
[8]David A,David M.An Expanding role for mTor in cancer[J].TRENDS in Molecular Medicine,2005,11:354.
[9]Fleming IN,Gray A,Downes CP,et al.Regulation of the Rac1-spcific exchange factor Tiam1involves both phosphoinositide3-kinase-dependent and -independent components[J].Biochem J,2000,352(Pt 1):173.
[10]陈英杰,刘 健,陶雅君,等.PTEN、PI3K和mTOR在鼻咽癌中的表达及意义[J].现代肿瘤医学,2009,(01):41.
