口服枸杞多糖对实验性食管癌大鼠免疫功能影响的研究
2012-05-30杨书良郝玉栓单铁英胡素红
杨书良,郝玉栓*,单铁英,胡素红
(1.河北工程大学医学院,河北 邯郸056029;2.邯钢职工医院)
枸杞多糖(lycium barbarum polysaccharides,LBP)作为枸杞子的主要活性成分已日益得到临床医生的高度重视。研究表明,LBP有增强机体的免疫功能和显著的抗肿瘤效应,它能从调动机体自身的抗病能力出发,在提高机体免疫力的同时杀伤肿瘤细胞[1];它能促进骨髓有核细胞数和粒/巨噬细胞集落数量的增加(CFU-GM);它还能诱导体内多种细胞因子的产生,而这些因子均有促进免疫活性细胞增殖、分化和成熟的作用。所以临床上普遍认为LBP有较强的免疫活性,是有效的免疫增强剂,在细胞免疫和体液免疫中具有十分重要作用[2]。LBP的抗肿瘤作用是否与机体在肿瘤发生过程中,免疫效应细胞(如CD4+T,CD8+T)和细胞因子(如IL-2、IL-10)增减有关,目前报道较少。本研究以NMBA诱导大鼠食管癌为对象,观察LBP在诱癌过程中对CD4+T、CD8+T细胞和血清IL-2、IL-10水平的影响,探讨其防癌、抗癌作用的免疫学机制,为进一步开发免疫增强剂的抗肿瘤药物提供参考。
1 材料与方法
1.1 实验动物
5~6周龄清洁级健康雄性F-344大鼠96只,购于上海斯莱克实验动物中心。
1.2 试剂与仪器 LBP由华北制药集团新药研究开发中心分离纯化,纯度>90%。NMBA(Osaka,Japan),纯度 >98%。IL-2ELISA 试 剂 盒、IL-10 ELISA试剂盒(ADL)。小鼠抗大鼠CD4-FITC单抗(Caltag)。小鼠抗大鼠CD8-PE单抗(BD)。流式细 胞 仪 (FACS Vantage,Becton Dickin Son)。SCR20B型低温高速离心机(日本HITACHI公司)。-80℃超低温冰箱(SANYO)。双目光学显微镜、显微照像机(Olympus)。切片机(Leica)。
1.3 方法
1.3.1 动物实验 大鼠恒温(22~25℃)、恒湿(40~60%),灭菌饲料饲养。两周后随机将大鼠分为对照组、LBP组、NMBA诱癌组和诱癌+LBP组,每组24只。对照组大鼠生理盐水灌胃5ml/kg/次/日;LBP组大鼠 LBP灌胃5ml/10mg/kg/次/日;NMBA诱癌组大鼠每周3次皮下注射NMBA(0.5 mg/kg/次);诱癌+LBP组大鼠在每周3次皮下注射 NMBA(0.5mg/kg/次)的同时LBP灌胃5ml/10mg/kg/次/日,所有大鼠用药时间共6周。分别在第6、12和18周时从各组大鼠中取8只麻醉后解剖,取食管进行病理学观察;采外周血做CD4+和CD8+T细胞数,ELISA检测技术检测血清IL-2、IL-10水平。
1.3.2 病理学观察 将大鼠食管纵行剖开平铺,肉眼观察食管癌前病变发生情况,并对发生瘤体测量大小和计数;取食管黏膜,常规石蜡包埋、制片,HE染色,在双盲情况下光镜观察。
1.3.3 外周血CD4+T、CD8+T细胞检测 取不同荧光标记的单克隆抗体各10μl,分别加入100μl肝素抗凝的全血,室温下孵育15min,加入红细胞裂解液,PBS洗涤2次,用流式细胞仪检测。测定5000个细胞,记录CD4+T、CD8+T细胞分别占淋巴细胞的百分比。
1.3.4 血清IL-2、IL-10含量检测 按照说明书测定。
1.4 统计学分析
所有实验数据用SPSS17.0软件进行统计学处理,实验结果以均数±标准差(x—±s)表示,各组均数的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般状况
实验期间各组大鼠体重呈正常生理性增长,各组间平均体重变化差异无统计学意义,第4周后,诱癌组大鼠出现皮毛蓬松,活动减少,弓背卷缩现象,但体重仍在增长。
2.2 病理变化
对照组、LBP组大鼠各时间点肉眼观察,食管黏膜光滑,色泽正常,未发现肿瘤生长;诱癌组大鼠食管黏膜出现肉眼可见的多发或单发的隆起性病变(最大径≥1mm为标准)。镜下观察对照组、LBP组大鼠食管黏膜上皮细胞无异常表现;诱癌组大鼠食管黏膜上皮表现为基底层细胞大小不一、核浆比例失调、核染色加深、核膜增厚等上皮内瘤变表现(以Ⅲ级为计算标准);诱癌+LBP组大鼠食管黏膜上皮细胞变化明显减轻(表1)。实验结果充分说明NMBA诱发大鼠食管模型可靠,LBP对食管黏膜癌变的发生有一定的抑制作用。
2.3 外周血CD4+T、CD8+T细胞
各组测定结果见表2。
2.4 血清IL水平
见表3。
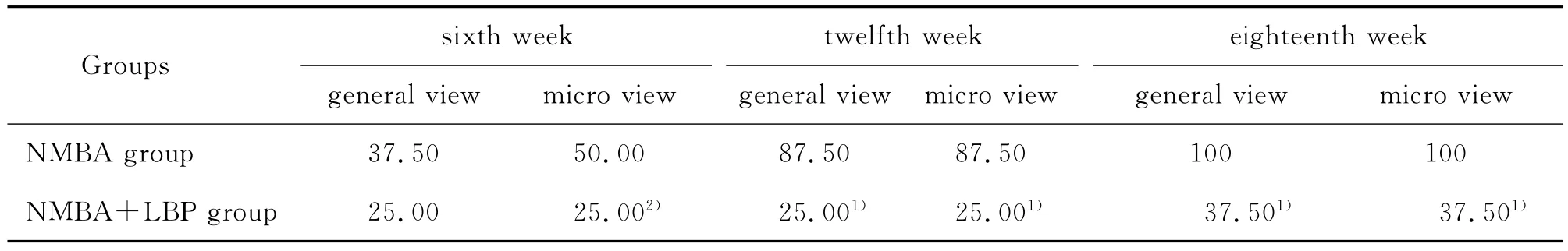
表1 不同组别大鼠食管肿瘤发生率和食管黏膜上皮内瘤变Ⅲ级发生率(%,n=8)
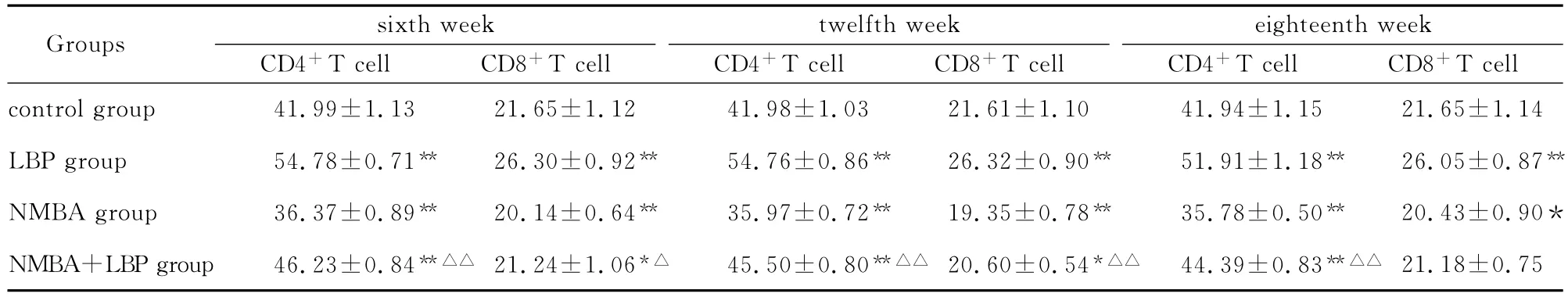
表2 不同组别大鼠外周血CD4+T细胞、CD8+T细胞(%,n=8,x—±s)

表3 不同组别大鼠血清IL-2、IL-10水平(pg/ml,n=8,x—±s)
3 讨论
传统中草药以低毒、价廉、有效、易于接受等优点在肿瘤防治研究领域越来越受到人们的关注[3]。枸杞子性平、味甘,具有滋补肝肾、益精明目的功效,LBP是枸杞子经脱脂、水提、反复醇析所得。LBP具有较强的免疫活性,是有效的免疫增强剂,在细胞免疫和体液免疫中具有十分重要作用[4]。本研究以NMBA诱发食管癌大鼠为实验模型,探讨LBP在其诱癌过程中抗肿瘤作用的免疫学机制,为开发以免疫增强剂为主的防治肿瘤药物提供参考。
外周血CD4+、CD8+T细胞数量的多少及血清细胞因子水平的高低,可直接反映出机体的免疫状态,研究发现肿瘤患者外周血中CD4+、CD8+T细胞数量减少,导致机体抗肿瘤免疫反应降低,最终发生肿瘤。LBP作为一种“植物疫苗”进入肠道后,可通过抗原递呈细胞上的“MHC-肽”与T细胞受体(TCR)聚合。CD4或CD8的存在可稳定TCR和MHC-肽之间的相互作用可使免疫受体酪氨酸激活基序 (ITAM)发 生 磷 酸 化 从 而 激 活 T 细 胞[5-8]。CD4+T细胞是一群具有调节体液和细胞介导免疫功能的细胞,他们的分化受许多因素的影响,其中最重要的因素就是细胞因子。IL-2在机体免疫调节网络中处于中心地位,IL-2能促进外周血单核细胞产生TNF,从而增强抗肿瘤的作用。由于IL-2的含量与机体的免疫功能相关,尤其是与细胞免疫功能密切相关,因此可将IL-2的产生作为细胞免疫效应的主要指标。静止的自然杀伤细胞(NK细胞)表达IL-2受体的β链,一种70kDa的中等亲和力受体,IL-2可直接将其激活,NK细胞激活后能释放γ干扰素(IFNγ)和其他细胞因子杀伤瘤细胞[9-11]。所有这些细胞都能对IL-2产生反应,获得非特异细胞毒功能,这些细胞统称为淋巴因子活化的杀伤细胞(LAK细胞)。LAK细胞与NK细胞相比,它不但能杀伤新鲜的肿瘤细胞,而且对许多不同谱系的肿瘤细胞也有杀伤作用。本研究显示,LBP具有增加外周血CD4+、CD8+T细胞和增加细胞因子IL-2的分泌的作用,可形成较强的免疫活性,是有效的免疫增强剂,在细胞免疫和体液免疫中具有十分重要作用。
人体肿瘤的发生发展与免疫功能的改变有着密切的关系,由于机体免疫监视的缺陷,导致免疫逃逸的发生,使肿瘤发生率增高。肿瘤发生时肿瘤细胞本身也可分泌IL-10,IL-10通过抑制单核/巨噬细胞、Th细胞、CTL细胞和NK细胞等来抑制机体对肿瘤的免疫作用,使肿瘤细胞发生逃逸现象。在恶性肿瘤病人中血清IL-10大多数情况下是增高的,且IL-10的高低与肿瘤病人的治疗效应和病情相关,血清IL-10增高的肿瘤患者在经手术或化疗后明显下降[13-15]。本研究显示,诱癌组大鼠血清IL-10水平在第6周明显升高,随着时间的推移虽然有所下降,但下降并不明显。诱癌+LBP组大鼠血清中IL-10水平明显低于诱癌组大鼠,但高于对照组和LBP组。12周前血清IL-10水平显著下降,12周下降不明显,与诱癌组各时间点比较差异有统计学意义,但与对照组各时间点比较差异无统计学意义。研究结果说明NMBA诱癌过程中,大鼠的抗肿瘤免疫状态是受抑制的,血清IL-10水平可反映出肿瘤患者抗肿瘤免疫状态。
[1]王晓华,单铁英,侯永超et al.枸杞多糖增强效应T细胞增殖和杀瘤活性机制的研究[J].中国实验诊断学,2010,14(5):699.
[2]许忠新,单铁英,苏安英et al.枸杞多糖对人外周血巨噬细胞活性的影响[J].重庆医学,2010;39(16):2177.
[3]李海波,梅之南,朱 帆.枸杞多糖抗肿瘤作用免疫学机理的探讨[J].中国医院药学杂志,2005;25(2):115.
[4]陶大勇.枸杞多糖的免疫调节作用[J].安徽农业科学,2007,35(22):6816.
[5]Seder RA,Ahmed R.Similarities and differences in CD4+and CD8+effector and memory T cells generation[J].N at Imm unol Rev,2003,4(9):835.
[6]Wang R,Epstein J,Charoenvit Y et al.Induction in humans of CD8+and CD4+T cell and antibody responses by sequential immunization with malaria DNA and recombinant protein[J].Immunol,2004,172(2):5561.
[7]Lee BN,FollenM,Shen DY,et al.Dep ressed type 1cytokine synthesis by superantigen-activated CD4+T cells of women with human pap illomavirus-related high-grade squamous intraep ithelial lesions[J].Clin D iag Lab Imm unol,2004,11(2):239.
[8]Diederichsen AC,Hjelmborg JB,Christensen PB,et al.Prognostic value of the CD4+/CD8+ratio of the tumour infiltrating lymphocytes in colorectal cancer and HLA-DR expression on tumour cells[J].Cancer Immunol Immunother,2003,52(7):423.
[9]宋 丁,王燕云.CD8+CD28—T细胞在原发性肝癌患者外周血的表达及意义[J].中国实验诊断学,2009,13(4):493.
[10]徐文莲,李秀珍,李 捷.IgA肾病患者扁桃体切除前后血、尿IL-2、IL-6的变化[J].中国实验诊断学,2010,14(7):1087.
[11]Zimmerli SC,HarariA,Cellerai C,et al.H IV-1-specific IFN-γ/IL-2-secreting CD8Tcells support CD4-independent p roliferation of H IV-1-specific CD8Tcells[J].ProcN atlAcad SciUSA,2005,102(20):7239.
[12]姜 燕,吕昌龙.口服Ag85A脂质体DNA诱导T细胞亚群应答效应研究[J].中国免疫学杂志,2009,25(10):883.
[13]欧阳杰,张金龙,李方都,et al.消化道肿瘤化疗病人血清IL-10水平的初步探讨[J].放射免疫学杂志,2007,20(1):77.
[14]Staples KJ,Bergmann M,Barnes PJ,Newton R.Stimulus-specific inhibition of IL-5by cAMP-elevating agents and IL-10reveals differential mechanisms of action[J].Biochem Biophys Res Commun,2000,273:811.
[15]齐法莲,徐 军,武翠华,et al.慢性肾衰患者血清 L-18.IL-10.SL-2R、TNF-a水平变化[J].放射免疫学杂志,2006,19(3):178.
