平顶山烟区主要种植烤烟品种光合生理特性研究
2012-05-25顾少龙史宏志张国显刘清华刘国顺李延涛
顾少龙,史宏志*,张国显,钱 华,刘清华,刘国顺,李延涛
(1.河南农业大学烟草学院,郑州 450002;2.河南中烟工业公司,郑州 450000;3.平顶山烟草公司,河南 平顶山 467000)
光合作用是作物生长发育和产量形成的基础,是研究植物生长生理过程的基本内容之一,作物生产的实质是光能驱动的一种生产体系,作物产量和品质形成依赖于光合作用产生的有机物质,提高作物产量和品质的根本途径就是改善作物的光合性能。研究表明,作物生物学产量的90%~95%来自于光合作用产物,只有 5%~10%来自于根系吸收的营养成分。在烤烟生产和种植过程中,叶片是收获的最终产品,而烤烟叶片既是光合作用的场所和光合作用产物的生产者,又是那些与烟叶品质有关的各种化学物质的储藏场所,烟株的生长发育和产量品质的形成,最终决定于烟草植株个体与群体的光合作用[1-3]。此外,光合作用的某些生理参数:如净光合速率、光补偿点、光饱和点等,已成为制定栽培措施的科学依据[4]。因此,研究烤烟叶片的光合生理参数对探讨烤烟叶片的产质至关重要。
目前,有关不同烤烟品种产量、品质变化、干物质积累动态、品种区域试验等方面的研究较多,而对不同品种的需光特点,如光补偿点、光饱和点以及光能利用效率等的研究却少见报道。本研究选择豫中浓香型烟区主栽烤烟品种中烟 100、NC89和新引烤烟品种NC297为试验材料,研究3个品种的光合生理特性,为科学制定配套栽培技术提供理论依据。
1 材料与方法
1.1 材料
供试品种为NC297、NC89、中烟100。试验于2009年在平顶山市郏县进行,3月6日播种,采用漂浮育苗,5月7日移栽,行株柜为120 cm×50 cm,自然光照。试验地前茬为烤烟,土壤碱解氮含量78.36 mg/kg,速效磷含量18.54 mg/kg,速效钾含量105.79 mg/kg,有机质含量14.49 g/kg,pH 6.69。施纯氮 52.5 kg/hm2,m(N)∶m(P2O5)∶m(K2O)=1∶2∶3,各品种处理施肥和田间管理同常规措施。所用肥料为芝麻饼肥、烟草复合肥(10-12-18)、重过磷酸钙、硝酸钾。其他栽培管理措施及病虫害防治均按照当地优质烟生产技术方案要求进行。
1.2 测定项目及方法
1.2.1 光合作用的光响应曲线 用美国LI-COR公司的LI-6400型便携式光合测定仪测定不同品种烟株自上而下第8~10片叶,用LI-6400-02B红蓝光源设定叶室中的有效光强为0、20、50、80、100、200、400、800、1200、1500 μmol/(m2·s)。测定叶片在每一光强下的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间 CO2浓度(Ci)。通过曲线拟合得到光合参数:最大净光合速率、表观量子效率、光饱和点、光补偿点。光合测定仪连接缓冲瓶,空气流量为(500±1)μmol/s,叶室温度为30 ℃,叶室 CO2摩尔分数为(375±5)μmol/mol,压强为0.97×105Pa,空气相对湿度(70±2)%,空气温度(30±1) ℃。测定时间为 7月 16日上午9:00~11:00。表观量子利用效率是用光响应曲线中光强在200 μmol/(m2·s)以下时的初始直线部分的斜率表示。叶片表观量子效率(AQY)的计算以光响应曲线中 0~200 μmol/(m2·s)之间的净光合速率(Pn)对 PARi做直线回归,得回归方程:Pn=Rd+AQY×PARi
当 Pn=0时,PFD即为光合作用的光补偿点LCP,Rd为暗呼吸速率[5]。
1.2.2 光合色素的测定 同步取测定完光合作用的叶片,用96%乙醇研磨提取,用UV-754型分光光度计(上海亚研电子科技有限公司)测定 665、649和470 nm处的OD值,然后计算单位面积叶绿素a、b及类胡萝卜素含量。
2 结 果
2.1 不同烤烟品种光合因子的光响应曲线
图1是以净光合速率(Pn)为纵轴,以光照强度(PARi)为横轴拟合的光合速率PARi-响应曲线,可以看出,光照强度对光合速率有显著影响,不同烤烟品种对光照的响应也不相同,其光合速率变化在强光和弱光下均有差异。当光照强度在 0~200 μmol/(m2·s)左右时,烤烟叶片的净光合速率随光照强度的增加而迅速增大,光合速率几乎呈线性增长。随着光照强度的继续增加,Pn的增长速度减缓,当光照强度达到光饱和点以后,Pn的增长处于极缓慢状态,甚至有下降的趋势。NC297和NC89在光照强度 1200 μmol/(m2·s)左右达到最大净光合速率分别为 22.6、21.0 μmol CO2/(m2·s),中烟 100 在 1500 μmol/(m2·s)以内未达到完全饱和(图1),说明其潜在的光合能力很大。NC297和NC89在光照强度为1500 μmol/(m2·s)时净光合速率降低,出现光抑制现象,NC297下降幅度大于NC89。
由图2,图3可知,3个品种的蒸腾速率和气孔导度都随光照强度增加而增加,变化趋势与净光合速率相同,光照度为 0~100 μmol/(m2·s)时,气孔导度和蒸腾速率随光照强度的增加而急剧增加,在1500 μmol/(m2·s)达到最大值,稍大于达到最大净光合速率时的光照强度,与黄一兰等[6]的研究结果不同。NC89的蒸腾速率和气孔导度都高于NC297,中烟100最低。由图4可知,胞间CO2浓度变化趋势与净光合速率相反,NC297、NC89和中烟 100的胞间 CO2浓度在光照强度为 0 μmol/(m2·s)时最大,随着光照强度的增强,气孔迅速张开,光合作用增强,使得胞间CO2浓度急剧下降,随着光照强度的增大,胞间CO2浓度下降减缓,随后基本保持稳定。
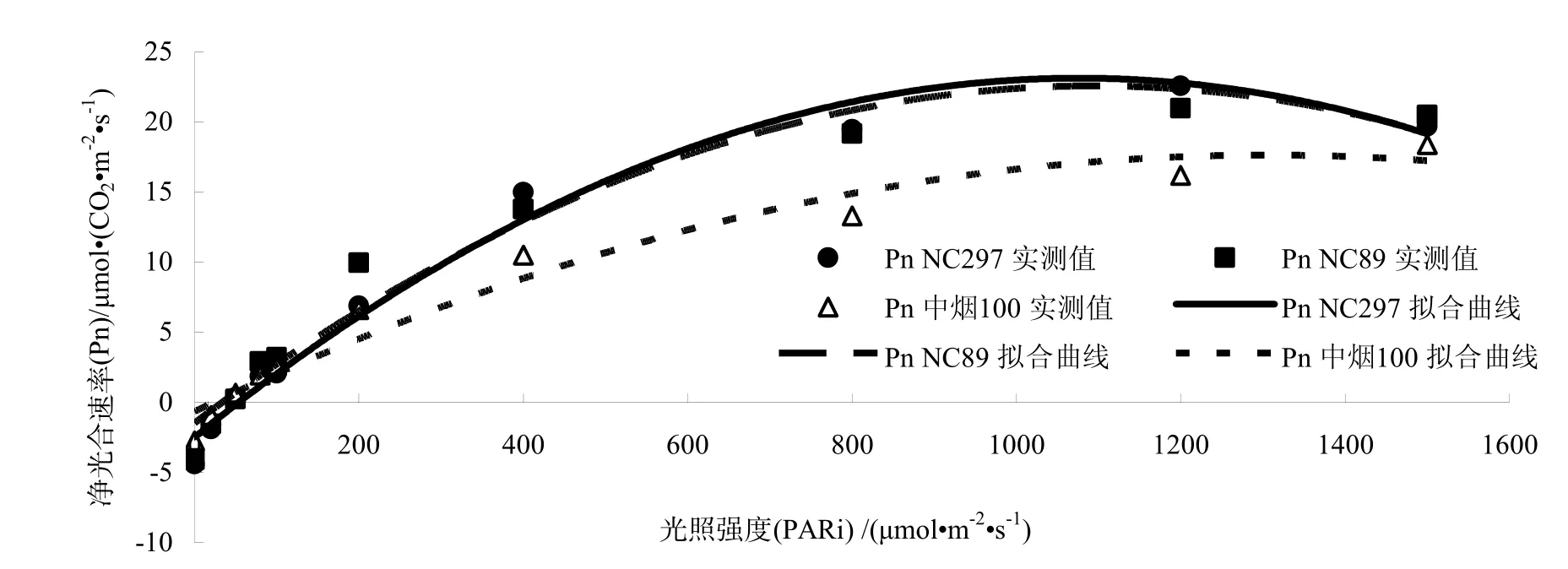
图1 不同烤烟品种净光合速率(Pn)的光响应(点为实测值,曲线由回归所得)Fig.1 Responses of Pn to light in different flue-cured tobacco varieties (the symbols referred to the measured values and lines were fitted by equation)
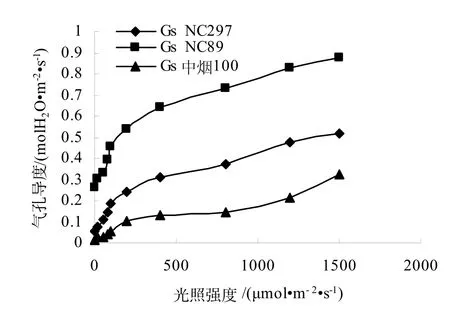
图2 不同烤烟品种气孔导度(Gs)的光响应Fig.2 Responses of Gs to light in different flue-cured tobacco Varieties
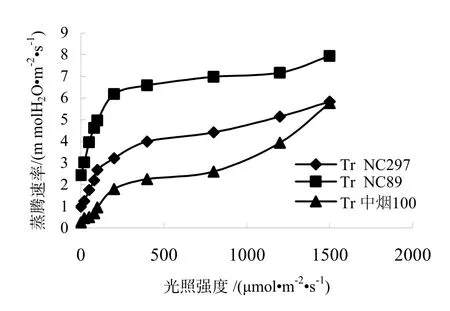
图3 不同烤烟品种蒸腾速率(Tr)的光响应Fig.3 Responses of Tr to light in different flue-cured tobacco varieties
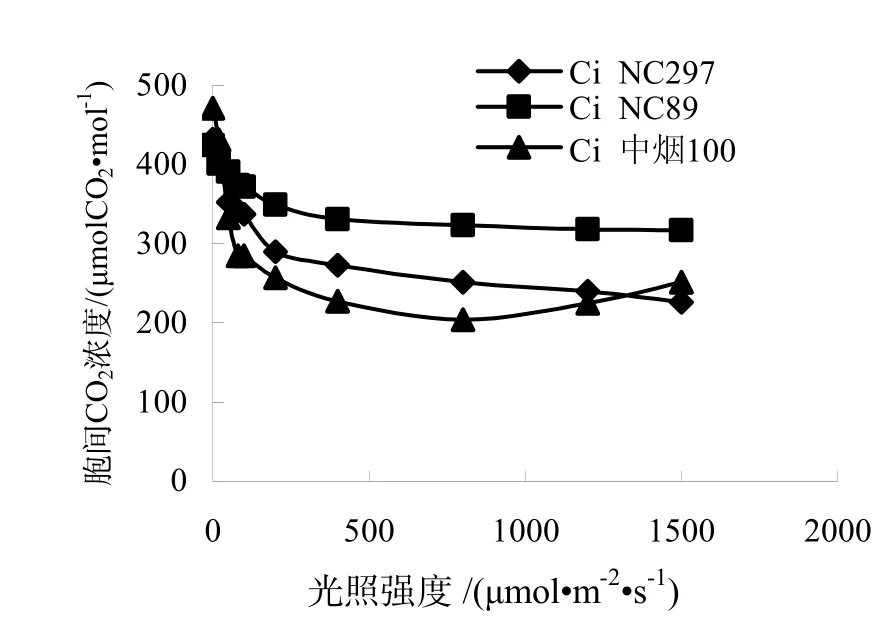
图4 不同烤烟品种胞间CO2浓度(Ci)的光响应Fig.4 Responses of Ci to light in different flue-cured tobacco varieties
2.2 不同烤烟品种光响应曲线特征参数
通过对光照强度(x)和净光合速率(y)进行二次多项式逐步回归,得到NC297、NC89和中烟100的光响应曲线方程(1~3),这3个方程的相关系数分别为0.9854、0.9658和0.9632,说明方程有效,能很好地反映3个品种旺长期在不同光照强度下净光合速率的变化。对方程(1~3)计算可得,3个品种旺长期中部叶的光饱和点(LSP)和光饱和最大净光合速率(Pn max)(表1)。
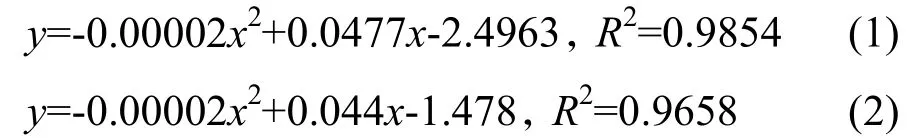
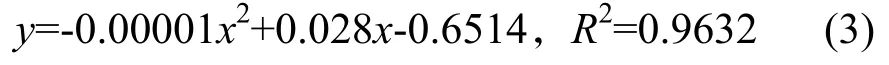
对 3个烤烟品种在低光合有效辐射[(即 PARi小于 200 μmol/(m2·s)]范围内测定净光合速率 Pn,作净光合速率-光响应的散点图(图5)可知,3个烤烟品种的 Pn与 PARi之间存在较好的线性回归y=A+Bx(x 自变量为弱光照小于 200 μmol/(m2·s)范围内给定光强PARi,y因变量为对应光强下的净光合速率(Pn),回归后所得方程(图5)。这3个方程的相关系数分别为0.9564、0.9863和0.9801,说明方程有效,可求得光补偿点、表观量子产额等光合参数见表1。NC297、NC89和中烟100在光照强度为 0时的净光合速率分别为-4.39、-4.11和-2.73 μmol CO2/(m2·s),此时因为光合速率为零,净光合速率即为呼吸速率(Rd)。
2.3 不同烤烟品种叶片光合色素含量与相对组成
表2表明,NC89的叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素含量都极显著高于NC297和中烟100,NC297和中烟100之间没有显著差异,叶绿素a/b三个品种之间没有达到显著差异。从总体上看,光合色素含量以NC89最高,NC297居中,中烟100最低。

表1 NC297、NC89和中烟100的光响应曲线特征参数Table1 The characteristic parameters for light response of net photosynthetic rate of NC297, NC89 and zhongyan 100
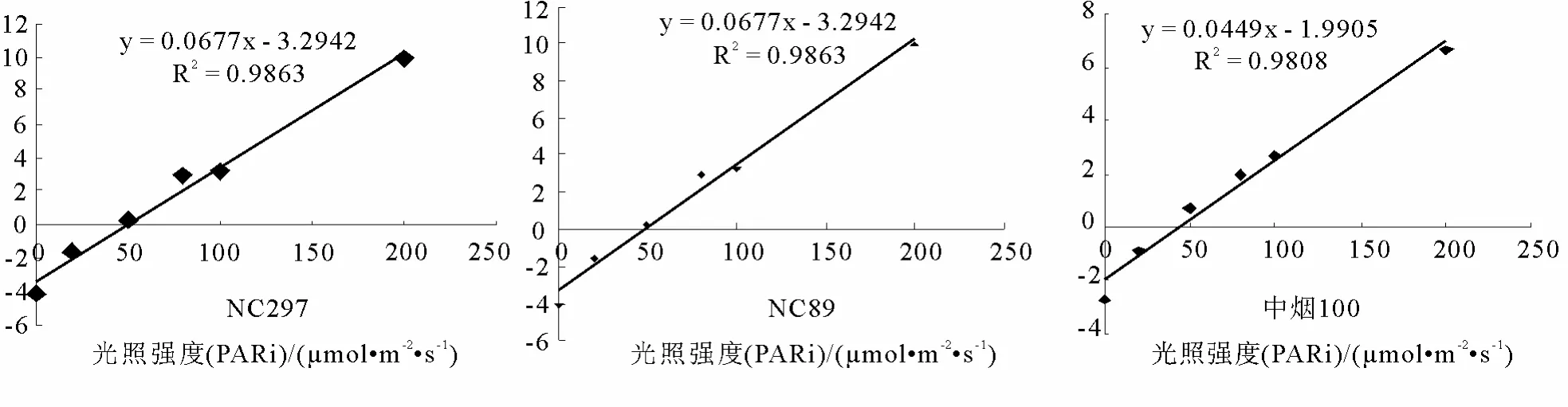
图5 NC297、NC89和中烟100的表观量子效率(点为实测值,直线由线性回归所得)Fig.5 The apparent quantum efficiency (AQY) of leaves of NC297, NC89 and zhong yan 100 (The symbols referred to the measured values and lines were fitted by linear)
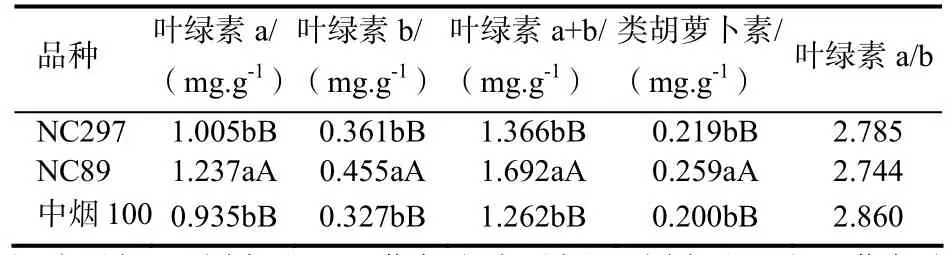
表2 不同烤烟品种叶片光合色素含量与相对组成Table2 Relative composition and photosynthetic pigment content of different leaves combinations
3 讨 论
本试验研究结果表明,随着光照强度的增加,3个烤烟品种的净光合速率、气孔导度和蒸腾速率明显增加,而胞间CO2浓度降低。在植株旺长期烤烟品种间叶片净光合速率、气孔导度、胞间CO2浓度和蒸腾速率对光照强度的响应不同,表明不同烤烟品种的生理活性对光强的适应性亦不同,烤烟叶片在较低光强刺激下,能够很快地使其气孔打开,蒸腾速率快速增加,从而使光合速率也迅速增加。品种NC89和NC297在达到光饱和点时继续增加光照强度,其气孔导度继续增加,净光合速率反而下降,说明造成这一现象的原因可能是强光使解联的电子传递活性受抑制,导致一些光合碳代谢酶活性下降而形成光抑制现象[7],但只依靠气孔导度的大小来判断对光合速率的限制是不全面的,还有一些非气孔限制因素,如很多研究已经表明RUBP羧化酶是非常重要的非气孔限制因素[8-10],具体原因还需要进一步研究。而中烟100则表现出较强的适应能力,未出现光抑制现象。
3个烤烟品种的光合作用参数有较大的差异,一般地,光补偿点越低的植物利用弱光的能力越强,光饱和点高的植物能更有效地利用全日照的强光,同时光饱和点高的植物生长较快[11]。比较各烤烟品种的光合参数,中烟100的光补偿点最低,光饱和点最高,且在光照强度为 0~200 μmol/(m2·s)时的净光合速率略高,说明中烟100利用弱光的能力最强,对环境光照强度的适应范围更广。NC297的最大净光合速率最高,NC89的表观量子效率最高。中烟100的呼吸速率小于NC297和NC89,这说明中烟100的分解代谢能力弱于NC297和NC89,更能积累光合产物。具有相对较高的光饱和点,较低的光补偿点和呼吸速率的光合特性,可能是中烟100生长速度快,生物学产量较高的原因。
光合色素尤其是叶绿素,在植物的光合作用中对光能的吸收、传递和转化起着极为重要的作用。类胡萝卜素是植物光合作用色素蛋白复合体不可缺少的组分,它们可以作为捕光色素,并且在保护光合器官免受单线态氧的伤害中起重要作用[12-15]。较高的叶绿素a/b值(即具有相对较低的叶绿素 b含量),对于避免因吸收过量光能而导致光抑制具有重要意义,而相对较高含量的叶绿素b可以引起明显的光抑制现象[16]。本试验研究发现,中烟100的叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素含量最低,可能与净光合速率较低有一定的联系;中烟100具有高的叶绿素a/b值(即具有相对较低的叶绿素b含量),这与中烟100在本试验所设置的高光强下,没有发生光抑制现象可能有关。以上分析和讨论可以看出,在平顶山烟区,3个烤烟品种的光合特性存在较大的差异,但其具体生理机制尚需进一步研究。
[1]江力,曹树青,戴新宾,等.光强对烟草光合作用的影响[J].中国烟草学报,2000,6(4):17-20.
[2]刘贞琦,刘劲松,刘振业.高海拔区烟草光合作用的日变化[J].中国烟草学报,1995,2(4):34-39.
[3]潘瑞炽,董愚得.植物生理学[M].北京:高校出版社,1995:107-108.
[4]萧浪涛,王三根.植物生理学[M].北京:中国农业出版社,2003:158-159.
[5]Bassman J,Zwier J C.Gas exchange characteristics of Populus trichocarpa,Populus deltoids and Populus trichocarpa × P.deltoids clone[J].Tree Physiol,1991, 8:145-149.
[6]黄一兰,李文卿,林毅,等.光强对烤烟光合作用影响的初步研究[J].烟草科技,2000(9):36-38.
[7]许大全,张玉忠,张荣铣.植物光合作用的光抑制[J].植物生理学通讯,1992,28(4):237-243.
[8]Farquhar D G, Sharkey T D.Stomatal conductance and photosynthesis[J].Ann.Rev.Plant Physiol, 1982, 33:317-355.
[9]江力,张荣铣.烟草叶片CO2传导与碳同化参数的研究[J].合肥工业大学学报:自然科学版,2001,24(4):598-601.
[10]陆佩玲,罗毅,刘建栋,等.华北地区冬小麦光合作用的光响应曲线的特征参数[J].应用气象学报,2000,11(2):236-241.
[11]Eamus D.The interaction of rising CO2and temperatures with water use efficiency[J].Plant Cell and Environment,1991, 14: 843-852.
[12]Siefernann-Harms.Carotenoids in photosynthesis.I.Location in photosynthetic membranes and lightharvesting function[J].Biochimica et Biophysica Acta,1985, 811: 325-355.
[13]Siefernann-Harms.The light-harvesting and protective functions of the carotenoids in photosynthetic membranes[J].Physiologia Plantarum, 1987, 69:561-568.
[14]张其德,卢从明,刘丽娜,等.CO2倍增对不同基因型大豆光合色素含量和荧光诱导动力学参数的影响[J].植物学报,1997,39(10):946-950.
[15]Dutton H J.Carotenoid-sensitized photosynthesis:quantum efficiency, fluorescence and energy transfer[J].Photosynthesis Research, 1997, 52: 175-185.
[16]Lichtenthaler H K.Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J].Methods in Enzymology, 1987, 148: 351-383.
