油菜农杆菌介导转化体系的建立
2012-05-22赵万千史团省沙琰琰张志杰
刘 品, 赵万千, 史团省, 沙琰琰, 张志杰, 朱 墨
(郑州大学 生物工程系 生物多样性与生态学研究所 河南 郑州 450001)
0 引言
通过基因工程手段改良油菜的产量、品质及抗逆性,建立良好的油菜转化体系至关重要.油菜的遗传转化始于20世纪80年代后期,利用转基因技术已经培育出抗病[1]、抗虫、抗除草剂及品质改良[2]的转基因材料.
2004年文献[3]第一次克隆了WIN1基因,目的是通过基因工程技术将SHN1/WIN1基因插入甘蓝型油菜中油821,使其角质膜厚度和成分有所改变,主要是防止自身体内水分过度蒸腾散失,保持体内水分的平衡[4-5],以此来提高油菜的抗旱、抗寒和抗病等性能,为提高油菜抗逆性,特别是为抗旱和抗寒性育种奠定基础.该项研究不仅对认识和揭示植物角质膜的结构功能具有重要理论意义,而且对应用植物基因工程技术改良和培育抗逆性强的作物优良品种和农业生产都具有重要的应用价值[6-7].
本研究以甘蓝型油菜中油821为实验材料,对影响农杆菌介导法转化效率的主要因素进行了探讨,采用根癌农杆菌方法将控制角质膜厚度和成分的SHN1/WIN1基因转化到甘蓝型油菜中,目的是防止油菜自身体内水分过度蒸腾散失,保持体内水分的平衡,提高油菜抗旱、抗寒和抗病能力,提高油菜抗逆性.
1 材料和方法
1.1 材料
1.1.1植物材料 试验材料为甘蓝型油菜中油821,种子由中国农业科学院油料作物研究所馈赠.播种出苗后,取苗龄为4~5 d的无菌叶柄作为转化外植体.
1.1.2菌株和质粒 植物表达载体PBI121-SHN1/WIN1和根癌农杆菌均由郑州大学生物工程系植物生理与营养实验室构建和保存.植物表达载体PBI121-SHN1/WIN1带有NptII抗Kan基因[8].
1.1.3培养基 试验所用培养基主要有以下几种:
YEB培养基:牛肉膏(5 g/L),酵母抽提物(1 g/L),蛋白胨(5 g/L),蔗糖(5 g/L),MgSO4(2 mmol/L),pH 7.2,固体培养基含琼脂15 g/L.
重悬培养基:1/2(MS)+1 mg/L(2,4-D)+500 mg/L(MES)+200 μmol/L(AS).
基本培养基:MS+0.7%琼脂,pH 5.8.
共培养培养基:MS+1 mg/L(2,4-D)+500 mg/L(MES)+200 μmol/L(AS),pH 5.8.
滤菌培养基:MS+0.1 mg/L(NAA)+3 mg/L(6-BA)+5 mg/L(AgNO3)+400 mg/L(Car),pH 5.8.
分化筛选培养基:MS+0.1 mg/L(NAA)+3 mg/L(6-BA)+5 mg/L(AgNO3)+400 mg/L(Car)+Kan ,pH 5.8.
生根培养基:MS+0.2 mg/L(NAA)+400 mg/L(Car)+Kan, pH 6.0.
所有培养基如没有特殊说明,均为121 ℃条件下,高温高压灭菌20 min,现用现配.
琼脂、蛋白胨、酵母提取物和抗生素均为Solarbio分装,其他生化试剂和常规试剂均为国产或进口分析纯.
1.2 方法
1.2.1无菌苗的获得
(1) 首先进行种子消毒,选取籽粒饱满、大小均一的油菜种子放于三角瓶内,用0.1% HgCl2消毒7 min,无菌水清洗4次,用灭过菌的吸水纸将水分吸干;
(2) 将灭好菌的种子均匀摆放在基本培养基上,封好瓶口,置于28 ℃和16 h光照/8 h黑暗条件下培养,待萌发后取其生长5 d的子叶柄做为实验材料.
1.2.2农杆菌培养
(1) 挑取携带植物表达载体质粒PBI121-SHN1/WIN1的农杆菌单菌落,接种在10 ml含40 mg/L Str和100 mg/L Kan的YEB液体培养基中,在28 ℃和200 rpm环境中振荡培养过夜.
(2)活化过夜的农杆菌按1∶100(V∶V)的比例接种在相同的YEB液体培养基中,继续培养直到OD600为0.4.
(3)用12 000 rpm离心5 min,收集菌体,用重悬培养基同体积重悬使用.
1.2.3外植体的侵染及共培养
在超净工作台中打开瓶盖,用解剖刀将苗切下放到灭过菌的培养皿中,加入少量无菌水,防止时间过长幼苗失水影响再生活性.再用解剖刀将下胚轴和子叶柄切下,下胚轴长度约0.5~1 cm,子叶柄切口应尽量靠近生长点,且要除去生长点.切完后移入另一培养皿中,用重悬好的菌液侵染5 min.
(1)共培养:吸水纸吸干表面菌液,随后将子叶柄均匀摆放在共培养培养基上,暗培养3 d.
(2)滤菌培养:将共培养的外植体转移到滤菌培养基上,在28 ℃和16 h光照/8 h黑暗条件下培养3~7 d.
(3)分化筛选培养:将外植体滤菌培养基转移到筛选培养基上,在28 ℃和16 h光照/8 h黑暗条件下培养21 d左右,外植体表面开始出现白色愈伤组织,之后长出大量绿色小芽或者白化苗.
(4)继代培养:将长出大量愈伤组织的抗性外植体分割成小块后转入分化筛选培养基,此时的筛选压力为14 mg/L.
(5)生根培养:待筛选的抗性芽长至3~5 cm时,切下并转入生根培养基诱导生根,获得具有卡那霉素抗性的转基因油菜植株.7~10 d后伤口处有根长出,40 d左右形成根系,经一周炼苗,即可进行移栽.
1.2.4培养条件对转化的影响
所有组织培养过程,若无特别说明,都是在28 ℃、16 h光照/8 h黑暗光周期、光照强度为1 600~ 2 000 Lx的光照培养室中进行.农杆菌平板的培养是在28 ℃恒温培养箱中,预活化及其活化均在28 ℃、200 rpm的恒温摇床上进行.
2 结果和分析
2.1 卡那霉素浓度对带柄子叶分化的影响
植物表达载体PBI121-SHN1/WIN1带有NptII抗Kan基因,为了确定外植体对卡那霉素的临界值,将未侵染菌液的预培养带柄子叶置入不同浓度卡那霉素的分化培养基,每个梯度3个重复,进行敏感度实验,其结果见表1.由表1可知,带柄子叶对卡那霉素较为敏感,当卡那霉素浓度为9 mg/L时,比未加Kan的对照(CK)减少了将近53.34%;当卡那霉素浓度为11 mg/L时,芽的诱导率明显下降,且分化苗几乎为白化苗,因此将卡那霉素筛选浓度初步定为11 mg/L.由此说明,随着Kan浓度的提高,其选择压力增强,即Kan浓度越高,逃脱选择的绿芽减少且对芽的再生有强烈的抑制作用.
2.2 菌液浓度与侵染时间对转化的影响
在油菜农杆菌介导法转化中,适宜的农杆菌感染浓度和侵染时间是影响遗传转化成功与否的重要因素.表2和表3表明,当OD600值为0.4时,侵染5 min卡那霉素分化苗最高,随着菌液浓度的升高(OD600>0.4),侵染时间越长,外植体被侵染越厉害,致使外植体切口部位变黑、腐烂,甚至大量褐化死亡.研究表明,农杆菌对外植体的侵染时间过短,菌液浓度偏低,导致受体细胞未被侵染,使假阳性再生芽增多.
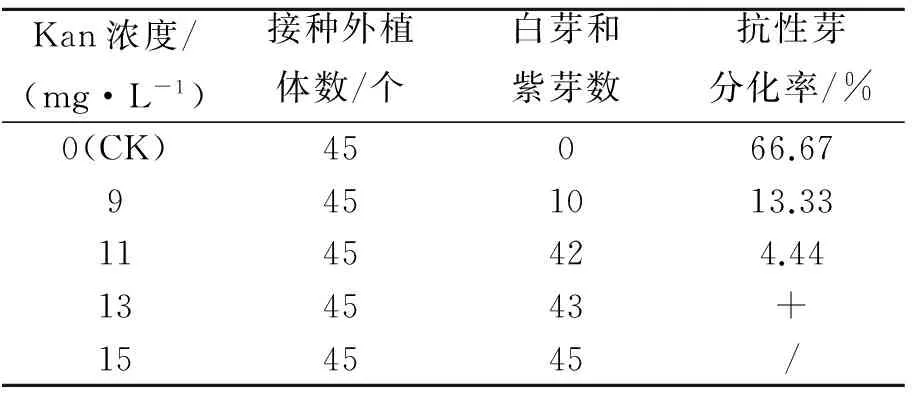
表1 外植体对卡那霉素的敏感度实验Tab.1 Sensitivity of explants to kannmycin
注:/表示无,+表示少
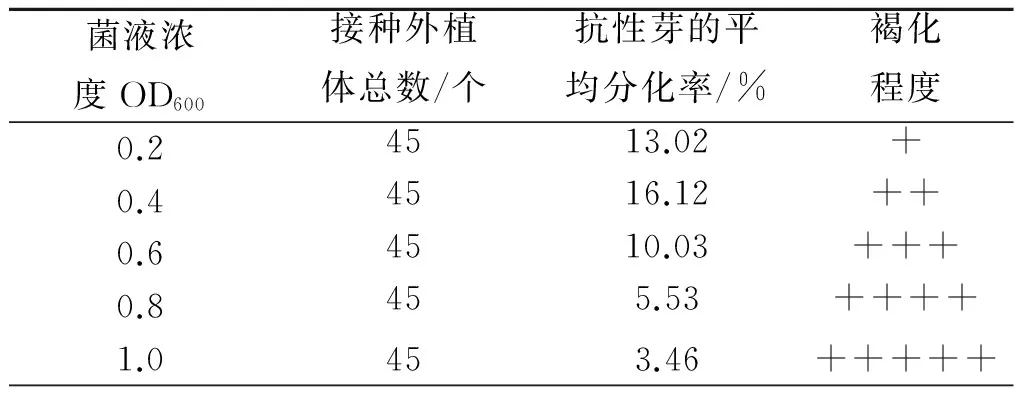
表2 菌液浓度对转化的影响Tab.2 Effects of bacterium concentration on transformation
注:/表示无,+表示少,++表示一般,+++表示多;后面表格同样表示
2.3 共培养时间对遗传转化的影响
根癌农杆菌的粘附、T-DNA的转移和整合过程都在共培养时期,共培养是农杆菌介导遗传转化的一个重要环节,掌握好合适的共培养时间和方法非常重要.由表4可以看出,外植体共培养24 h后,开始有抗性芽的出现,不过频率很低;当共培养48 h时,外植体的转化率已明显提高;但是共培养时间超过72 h后,不定芽的分化频率不断下降,农杆菌泛滥严重,褐化死亡的外植体也急剧增加;到共培养96 h后,外植体几乎全部死亡.上述结果表明,共培养时间为48 h时,转化率最高,可定为本实验所用油菜品种的最适共培养时间.

表3 菌液侵染时间对转化的影响Tab.3 Effects of bacterium immerged time on transformation
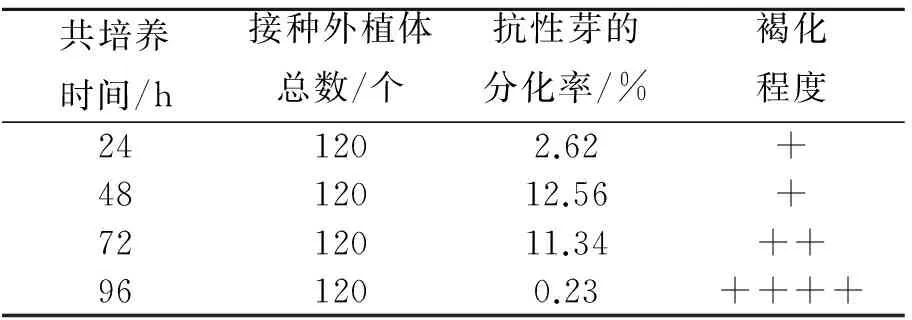
表4 共培养时间对转化效果的影晌Tab.4 Effect of cocultivation time on transformation frequency
2.4 乙酰丁香酮(AS)对转化的影响
农杆菌介导的遗传转化作为一种天然的植物基因转化系统,宿主植物细胞能分泌某些酚类化合物,可诱发农杆菌内Ti或Ri质粒DNA上Vir区的活化和高效表达,促进农杆菌T-DNA向宿主细胞核转移,从而提高遗传转化效率.其中常用且诱导效果最佳的是乙酰丁香酮(AS),AS作为诱导性最好的酚类化合物,被广泛应用于植物遗传转化中,取得了较好的效果,使得农杆菌介导的遗传转化方法更加完善.原理是诱导农杆菌Vir基因的活化,从而促进外源基因的整合.所以最好让其有一定的诱导时间再转化,而不是加完后直接转化(活化需要一段时间),就是在重悬培养基中和共培养基中都加入AS,浓度为200 μmol/L,效果会更好.说明AS可提高油菜的再生频率及转化率,这与蓝海燕[9]等人的研究结果一致.
2.5 AgNO3对转化的影响
在封闭的培养容器中,植物细胞在离体培养过程中会产生乙烯,造成乙烯的过量积累,从而影响外植体的生长和分化芽的产生.加入AgNO3,一方面可以抑制乙烯的活性,促进植物器官和体细胞胚胎的发生;另一方面,还具有降低玻璃苗的产生概率和抑制外植体褐化等功能,从而提高油菜的再生率和遗传转化率.本试验发现,添加一定量的AgNO3(浓度为5~10 mg/L),可促进芽的再生,大大降低外植体褐化的现象[10],也不会对外植体产生负作用.
3 结论与讨论
农杆菌介导是油菜转化最常用的一种方法.在转化过程中,许多因素都对转化效果有一定的影响,包括植物的基因型、所采用的外植体及其状态、培养条件和选择方法等.本研究可得出如下结论:
(1)使用5 d苗龄的带柄子叶作为转化受体,具有再生率高、再生周期短以及对农杆菌敏感等特点,这一实验结果与梁会娟[11]等人研究相符.
(2)卡那霉素的筛选浓度非常重要,确定11 mg/L为该实验筛选的临界浓度.只有确定卡那霉素的临界值,才能降低再生苗的假阳性率,减少后续抗性苗筛选的工作量,方便筛选工作的顺利进行.因此在整个的筛选转化体系中,前期筛选应采用较低浓度的抗生素,待芽长出后再用高浓度的抗生素筛选,这样可以避免剔除转基因绿苗,从而大大提高转化效率[12-13].
(3)侵染时间为5 min时,其外植体转化率最高.通过菌液浓度与侵染时间对外植体的实验,表明菌液浓度OD600值为0.4时,转化率最高,这与何业华[14]等人研究结果相似,褐化程度较弱.
(4)共培养时间的长短在很大程度上影响着转化率.试验表明,共培养时间为48 h时效果最好,不仅有利于外源基因的整合,也不会造成农杆菌的过度增殖.
(5)在培养基中添加AgNO3,不仅可以防止褐化,而且能够提高转化率;在重悬培养基和共培养培养基中添加AS可明显提高转化效率.
参考文献:
[1] 蓝海燕,王长海,张丽华,等.导入β-1,3-葡聚糖酶基因及几丁质酶基因的转基因可育油菜及其抗菌核病的研究[J].生物工程学报,2000,16(2):142-146.
[2] 张鹏,傅爱根,王爱国.AgNO3在植物离体培养中的作用及可能的机制[J].植物生理学通报1997,33(5):376-379.
[3] Magnani E, Sjolander K, Hake S. From endonucleases to transcription factors: evolution of the AP2 DNA binding domain in plants[J]. Plant Cell,2004,16:2265-2277.
[4] Riederer M, Schreiber L. Protecting against water loss: analysis of the barrier properties of plant cuticles[J].J Exp Bot,2001,52(363):2023-2032.
[5] Kerstiens G. Cuticular water permeability and its physiological significance[J]. J Exp Bot,1996,47(12):1813-1832.
[6] 沙琰琰,李晓莉,史团省,等.农杆菌介导蜡质基因SHN1/WIN1转化烟草的初步研究[J].植物研究,2011,31(6):702-707.
[7] 叶云,秦新民.转基因技术在甘蔗育种上的应用[J].广西师范大学学报:自然科学版, 2002,20(4):90-93.
[8] 柴凌燕,翁海波,王冰.蜡质相关转录因子SHN1/WIN1基因的克隆和植物表达载体的构建[J].贵州农业科学,2010,38(4):26-29.
[9] 蓝海燕,王长海,陈正华,等.农杆菌介导法将β-1,3-葡聚糖酶基因导入油菜的研究初报[J].中国油料作物学报,2000,22(1):6-10.
[10] 杜虹,庄东红,黄文华.AgNO3对大白菜子叶芽再生的促进作用[J].热带亚热带植物学报,2000,8(2):109-112.
[11] 梁会娟,曹刚强,苗丽娟,等.根癌农杆菌介导的fad2RNA干扰体基因转化甘蓝型油菜的研究[J].河南农业科学,2007(1):34-38.
[12] 王艳,曾幼玲,贺宾,等.农杆菌介导NHX基因转化甘蓝型油菜的研究[J].作物学报,2006,32(2):278-282.
[13] 申娟,曹刚强,梁秋霞,等.粳稻成熟胚愈伤组织诱导及其分化培养体系的建立[J].郑州大学学报:理学版,2010,42(3):119-124.
[14] 何业华,雄兴华,官春云,等.根癌农杆菌介导TA29-Barnase基因转化甘蓝型油菜的研究[J].作物学报,2003,29(4):615-620.
