HPLC法测定头孢唑肟钠氯化钠即配型输液中头孢唑肟的含量
2012-05-21李金菊原庆泓山西天星制药有限公司化验室太原03003山西华元医药集团通讯作者mailzp836sohucom
李金菊, 朱 平,, 原庆泓, (山西天星制药有限公司化验室, 太原 03003;山西华元医药集团;通讯作者,E-mail:zp836@sohu.com)
头孢唑肟钠氯化钠即配型输液是依据中国专利注射剂组合[1]研制而成的组合式即配型输液,是将注射用头孢唑肟钠(规格:1.0 g,按头孢唑肟计),与氯化钠注射液(软袋装,规格 100 ml∶0.9 g)、无菌输液加药器三者相容性试验符合要求后,组合在一起而成。临床静脉滴注时,将头孢唑肟钠氯化钠即配型输液中的注射用头孢唑肟钠与氯化钠注射液,用无菌输液加药器连通,使注射用头孢唑肟钠溶解于氯化钠注射液中,配制成可供静脉滴注的溶液。该溶液符合临床用药浓度、合理用药要求和对药液的质量要求,减少了常规配制过程中的二次污染。
本文参考中国药典2010版收载的头孢唑肟钠含量测定方法,参考有关药物研究的指导原则和文献[2-4],研究建立了将头孢唑肟钠氯化钠即配型输液配制成可供静脉滴注的溶液后,高效液相色谱法(high performance liquid chromatography,HPLC)测定该溶液中头孢唑肟含量的方法。
1 材料与仪器
1.1 材料 头孢唑肟钠氯化钠即配型输液(注射用头孢唑肟钠 1.0 g、氯化钠注射液 100 ml∶0.9 g、无菌输液加药器 1只,批号:110301、110302、110303,自制),头孢唑肟对照品(含量 98.1%,批号:130504-200701,中国药品生物制品检定所);水(超纯水),乙腈(色谱纯),磷酸氢二钠、枸橼酸、磷酸二氢钾(均为分析纯)。
1.2 仪器 岛津高效液相色谱仪:LC-10ATVP泵、SPD-10A VP紫外检测器(岛津仪器苏州有限公司);N2000色谱工作站(浙江大学智能信息工程有限公司)。
2 方法与结果
2.1 色谱条件 色谱柱:依利特 SinoChrom ODSBP C18柱(4.6 mm ×200 mm,5 μm),流动相:pH 3.6缓冲液(取枸橼酸1.42 g、磷酸氢二钠 2.31 g,加水溶解并稀释至1 000 ml)-乙腈(9∶1);流速:1.0 ml/min;进样量:20 μl;检测波长:254 nm;柱温:25℃。
2.2 溶液的配制 取磷酸二氢钾3.63 g、磷酸氢二钠14.33 g,加水溶解并稀释至1 000 ml,作为 pH 7.0磷酸盐缓冲液;取头孢唑肟钠氯化钠即配型输液,配制成可供静脉滴注的溶液,精密量取2 ml,置200 ml量瓶中,加pH 7.0磷酸盐缓冲液,稀释至刻度,摇匀,作为供试品溶液;取头孢唑肟钠氯化钠即配型输液中氯化钠注射液,精密量取2 ml,同法制成不含头孢唑肟的溶液,作为空白溶液;取头孢唑肟对照品适量,精密称定,加pH 7.0磷酸盐缓冲液,制成每1 ml中约含0.1 mg头孢唑肟的溶液,作为对照品溶液。
2.3 系统适用性试验 称取头孢唑肟对照品5 mg,置10 ml量瓶中,加0.1 mol/L氢氧化钠溶液1 ml,放置30 min,用pH 7.0磷酸盐缓冲液稀释至刻度,摇匀;取20 μl注入液相色谱仪,记录色谱图,头孢唑肟峰与其相对保留时间约0.8处碱降解物峰的分离度应不小于3.0,见图1。

图1 系统适用性试验Fig 1 The system suitability test
2.4 空白试验 取空白溶液20 μl,注入液相色谱仪,记录色谱图。结果表明,空白试验无干扰,具有专属性,见图2。
图2 空白试验Fig 2 The blank test
2.5 线性相关性试验 取头孢唑肟对照品约20 mg,精密称定,置100 ml量瓶中,加 pH 7.0磷酸盐缓冲液稀释至刻度,摇匀;分别精密量取3.0,4.0,5.0,6.0,7.0 ml,分别置10 ml量瓶中,加 pH 7.0 磷酸盐缓冲液稀释至刻度,摇匀,制成 60.04,80.05,100.05,120.07,140.09 μg/ml的溶液。精密量取上述溶液各20 μl,注入液相色谱仪,记录色谱图。见表1。
表1 线性相关性试验结果Tab 1 Results of linear correlation analysis
以头孢唑肟对照品峰面积A为纵坐标(Y),以浓度c为横坐标(X),按最小二乘法进行线性回归,得回归方程为Y=20 920X+31 143(r=0.999 9)。
结果表明,头孢唑肟在 60.04 -140.09 μg/ml浓度范围内,峰面积与浓度线性关系良好,见图3。

图3 头孢唑肟标准曲线图Fig 3 The calibration curve of ceftizoxime
2.6 精密度试验 照2.2项下的方法配制成对照品溶液,精密量取20 μl,注入液相色谱仪,重复6次,分别记录色谱图,计算RSD。结果表明,精密度良好,见表2。
表2 精密度试验结果Tab 2 Results of precision test
2.7 重复性试验 取头孢唑肟钠氯化钠即配型输液,配制成可供静脉滴注的溶液,精密量取6份,每份2 ml,分别照2.2项下的方法配制成供试品溶液;再照2.2项下的方法配制对照品溶液,按外标法测定每份供试品溶液中头孢唑肟的含量,计算RSD。结果表明,本测定方法重复性良好,见表3。
表3 重复性试验结果 (%)Tab 3 Results of repeatability test (%)
2.8 回收率试验 取头孢唑肟钠氯化钠即配型输液中注射用头孢唑肟钠16,20,24 mg各3份,精密称定,分别置200 ml量瓶中,各加头孢唑肟钠氯化钠即配型输液中氯化钠注射液2 ml溶解,再分别加pH 7.0磷酸盐缓冲液稀释至刻度,摇匀,分别精密量取上述溶液各20 μl,注入液相色谱仪,记录色谱图。照2.2项下的方法配制头孢唑肟对照品溶液,精密量取20 μl,注入液相色谱仪,记录色谱图。按外标法计算含量,计算回收率、平均回收率、RSD。结果表明,本测定方法回收率良好,见表4。
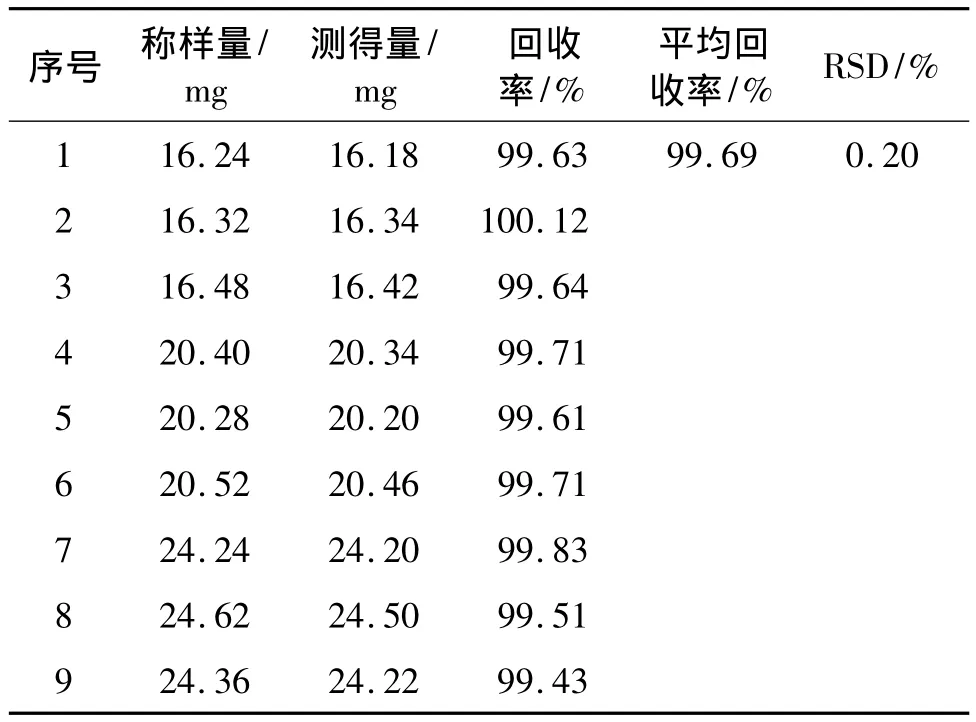
表4 回收率试验结果Tab 4 Results of recovery test
2.9 稳定性试验 取头孢唑肟钠氯化钠即配型输液,配制成可供静脉滴注的溶液,按2.2项下的方法,配制成供试品溶液,室温放置,于 0,2,4,6,8,10 h分别精密量取20 μl,注入液相色谱仪,记录色谱图,计算RSD。结果表明,室温下,供试品溶液在10 h内稳定性良好,见表5。

表5 稳定性试验结果Tab 5 Results of stability test
2.10 样品含量测定 取头孢唑肟对照品、样品,按2.2项下的方法,配制对照品溶液和供试品溶液。精密量取对照品溶液、供试品溶液各20 μl,分别注入液相色谱仪,记录色谱图,按外标法计算,得头孢唑肟钠氯化钠即配型输液配制成可供静脉滴注的溶液后,该溶液中头孢唑肟的含量,见表6。

表6 样品含量测定结果 (%)Tab 6 Results of sample assay (%)
3 讨论
本文研究的是组合的即配型输液中活性成分的含量测定方法,目前还没有这方面的文献报道。头孢唑肟钠氯化钠即配型输液中头孢唑肟的含量,指的是将头孢唑肟钠氯化钠即配型输液配制成可供静脉滴注的溶液后,该溶液中头孢唑肟的含量。
系统适用性试验采用的是主成分经碱破坏后的试验,重点考察主成分头孢唑肟经碱破坏后,头孢唑肟峰与其碱降解物峰的分离度。空白试验色谱图中所出现的峰,是pH 7.0磷酸盐缓冲液所产生的峰,对本文研究建立的测定方法没有影响。
本文研究建立的HPLC测定法,主成分峰分离度好、空白无干扰,线性关系、精密度、重复性良好,测定溶液稳定,回收率高,既可用于头孢唑肟钠氯化钠即配型输液组合前相容性试验中的头孢唑肟含量测定,又可用于组合后成品检验中的头孢唑肟含量测定。
[1] 山西天星制药有限公司.注射剂组合[P].中国:ZL 200720138312.4,2008 -09 -24.
[2] 国家药典委员会.中华人民共和国药典,二部[S].2010年版.北京:中国医药科技出版社,2010:204-205,附录194-附录195.
[3] 山西天星制药有限公司提出,国家食品药品监督管理局发布.国家食品药品监督管理局标准:注射用头孢唑肟钠,YBH21882005[S].
[4] 朱平,李娜,原庆泓.高效液相色谱法测定氟罗沙星葡萄糖注射液中氟罗沙星的含量[J].山西医科大学学报,2008,39(2):152-154.
