阿法骨化醇冲击或每日治疗对继发性甲状旁腺功能亢进患者血钙血磷水平的影响
2012-05-21孔繁明王伟莉孙金柱解放军第313医院辽宁葫芦岛125000
孔繁明,王伟莉,孙金柱(解放军第313医院,辽宁 葫芦岛 125000)
继发性甲状旁腺功能亢进(Secondary hyperparathyroidism,SHPT)是慢性肾脏病(Chronic kidney disease,CKD)矿物质和骨代谢疾病(CKD-MBD)的分支,是CKD患者常见的并发症。SHPT的机制为代偿体内血钙的下降,主要特征为钙磷代谢紊乱,1,25-羟化维生素D3缺乏,高甲状旁腺激素(PTH)血症,甲状旁腺增生[1]。SHPT发生后,高PTH血症不仅加重了钙磷代谢紊乱,导致骨骼的严重损害,还可以引起贫血、心血管疾病及神经系统损害等一系列全身病变,给CKD患者的生存质量和预后带来了极大危害[2]。目前的临床和实验研究[3]认为,SHPT的发生有多种机制共同参与,而血全段甲状旁腺激素(Integral parathyroid hormone,iPTH)可以作为临床上评定SHPT的指导性指标。本研究通过比较阿法骨化醇(1α-(OH)-D3)冲击治疗和每日治疗CKD尿毒症期并已进入常规血液透析阶段合并SHPT的患者,分析其对血钙、血磷、钙磷乘积、iPTH及碱性磷酸酶(ALP)水平的影响。
1 资料与方法
1.1 病例选择
1.1.1 病例选择对象 选取2009年8月-2011年8月间于我院血液净化中心常规进行血液透析的尿毒症患者56例,血液透析每周3次,每次4 h。
1.1.2 入选标准 根据CKD诊断标准及2006年《慢性肾脏病骨代谢及其疾病的临床实践指南》中的“维生素D治疗”,选择符合以下条件的患者:1)年龄20~70岁;2)进入尿毒症期,已接受常规血液透析治疗;3)存在SHPT,血中iPTH水平300~500 pg·mL-1;4)治疗前血钙<2.37mmol·L-1,血磷<1.78mmol·L-1,钙磷乘积<55mg2·dL-2(若有明显低蛋白血症者,需要计算纠正钙);5)所有患者2周内未接受过维生素D制剂及影响骨代谢的药物治疗;6)肝功能均在正常范围内。
1.1.3 排除标准 排除出现以下任何情况之一者:1)严重心脑血管并发症者;2)严重感染者;3)妊娠者;4)对药物不能耐受或过敏者;5)甲状旁腺明显增生且以往活性维生素D冲击治疗无效者。
1.2 一般资料
符合入选标准的病例共56例,其中男性27例,女性29例;年龄20~70岁。原发病:慢性肾炎26例,糖尿病肾病14例,高血压动脉硬化性肾病8例,先天性多囊肾病2例,狼疮性肾病2例,梗阻性肾病2例,痛风性肾病2例。所有患者随机均分为常规组和冲击组,2组患者一般资料经均衡性检验,差异无统计学意义(P>0.05),具有可比性,详见表1。
表1 2组患者一般资料比较()Tab 1 Comparison of general information of patients between 2 groups()

表1 2组患者一般资料比较()Tab 1 Comparison of general information of patients between 2 groups()
项目例数/n年龄/岁透析时间/月iPTH/pg·mL-1血钙/mmol·L-1血磷/mmol·L-1钙磷乘积/mg2·dL-2 ALP/U·L-1常规组2850.59±14.3039.24±41.90481.91±85.411.89±0.201.46±0.2248.04±11.71103.3±68.04冲击组2852.15±12.8548.42±49.72478.29±73.271.92±0.151.43±0.1850.67±13.71104.42±54.52 P>0.05>0.05>0.05>0.05>0.05>0.05>0.05
1.3 治疗方法
治疗前所有患者均未用过其他活性维生素D制剂,均于夜间睡眠前肠道钙负荷最低时给药。常规组口服阿法骨化醇(昆明贝克诺顿制药有限公司,每粒0.25μg)0.75μg·d-1;冲击组口服阿法骨化醇每次3μg(剂量符合说明书规定),每周2次。2组疗程均为12周。所有患者用含钙1.75mmol·L-1的碳酸氢盐透析液进行血液透析,每次透析4 h,每周3次。
1.4 观察指标
在治疗前及治疗第4、8、12周时测患者血钙、血磷、钙磷乘积、iPTH及ALP的水平。在整夜禁食后早晨采集样本。有低蛋白血症者,每2周测1次白蛋白,应用纠正钙公式计算血清钙:纠正钙=血Ca2++0.8×(4.0-白蛋白)。
1.5 统计学方法
所有数据采用SPSS 13.0软件进行统计分析,计量资料采用表示。治疗前、后及组间比较分别采用配对t检验及成组t检验。2组不良反应发生率的比较采用四格表χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后2组血钙、血磷、钙磷乘积、iPTH、ALP的变化
治疗前后血钙、血磷、钙磷乘积、iPTH、ALP的变化详见表2。
表2 治疗前后2组血钙、血磷、钙磷乘积、iPTH、ALP的变化()Tab 2 Changes of serum calcium,phosphorus,Ca-P sedimentation,iPTH and ALP before and after treatment between 2 groups()
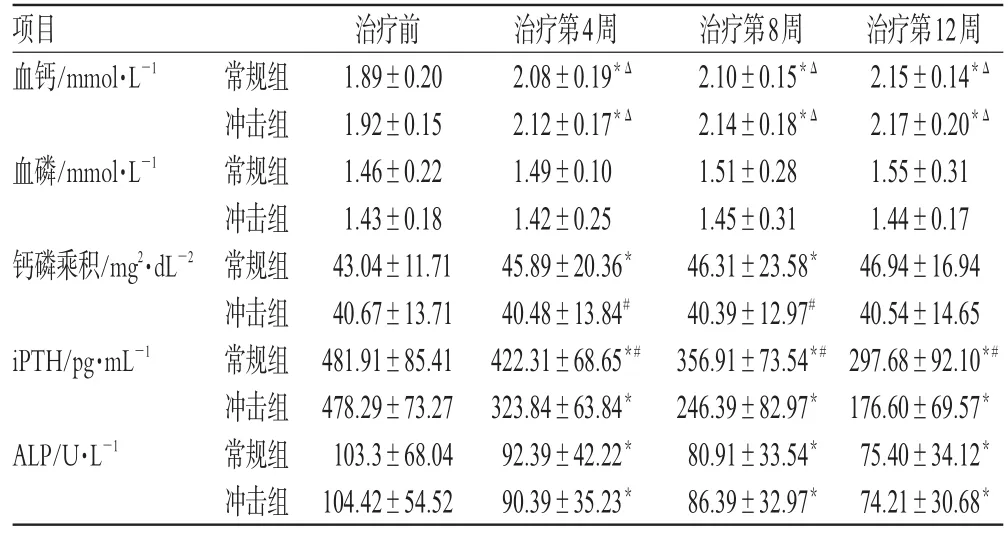
表2 治疗前后2组血钙、血磷、钙磷乘积、iPTH、ALP的变化()Tab 2 Changes of serum calcium,phosphorus,Ca-P sedimentation,iPTH and ALP before and after treatment between 2 groups()
与治疗前比较:*P<0.05;与冲击组比较:#P<0.05,ΔP>0.05vs.before treatment:*P<0.05;vs.pulse therapy group:#P<0.05,ΔP>0.05
治疗第12周2.15±0.14*Δ 2.17±0.20*Δ 1.55±0.311.44±0.1746.94±16.9440.54±14.65297.68±92.10*#176.60±69.57*75.40±34.12*74.21±30.68*项目血钙/mmol·L-1血磷/mmol·L-1钙磷乘积/mg2·dL-2 iPTH/pg·mL-1 ALP/U·L-1常规组冲击组常规组冲击组常规组冲击组常规组冲击组常规组冲击组治疗前1.89±0.201.92±0.151.46±0.221.43±0.1843.04±11.7140.67±13.71481.91±85.41478.29±73.27103.3±68.04104.42±54.52治疗第4周2.08±0.19*Δ 2.12±0.17*Δ 1.49±0.101.42±0.2545.89±20.36*40.48±13.84#422.31±68.65*#323.84±63.84*92.39±42.22*90.39±35.23*治疗第8周2.10±0.15*Δ 2.14±0.18*Δ 1.51±0.281.45±0.3146.31±23.58*40.39±12.97#356.91±73.54*#246.39±82.97*80.91±33.54*86.39±32.97*
由表2可见,(1)2组血钙水平在治疗第4、8、12周时均较治疗前显著升高(P<0.05),但都在正常范围内(Ca2+<2.54mmol·L-1),且组间同期比较差异无统计学意义(P>0.05);(2)2组血磷水平治疗后与治疗前比较差异无统计学意义(P>0.05),且组间同期比较差异无统计学意义(P>0.05);(3)常规组钙磷乘积在第4、8周时较治疗前显著上升(P<0.05),而冲击组治疗前、后无显著变化(P>0.05),组间同期比较差异有统计学意义(P<0.05);(4)2组iPTH水平均较治疗前显著降低(P<0.05),且治疗后组间比较差异有统计学意义(P<0.05),冲击组显著低于常规组;(5)2组ALP水平在治疗第4、8、12周时均较治疗前显著下降(P<0.05),组间同期比较差异无统计学意义(P>0.05)。
2.2 不良反应
常规组出现恶心4例、一过性高钙血症3例、眩晕3例;冲击组出现恶心5例、一过性高钙血症1例、眩晕2例、腹痛1例。2组的不良反应发生率比较,差异无统计学意义(P>0.05)。所有不良反应均未采用特殊处理自然缓解。2组均未见持续性高钙血症、高磷血症、肾功能明显减退、肝功能损害等不良反应。
3 讨论
SHPT是CKD患者常见的并发症之一。研究表明,血钙与PTH之间的关系是一个反S形曲线,正常血钙水平即钙调定点处于S曲线的中点处,所以PTH对血钙含量的变化十分敏感。血钙是甲状旁腺中钙离子敏感受体(Ca2+sensing receptor,CaR)的内源性配体,Ca2+轻微下降时CaR即开始对PTH基因转录进行负性调节,继而引起PTH大量分泌及迅速合成[4]。而磷潴留作为SHPT的独立危险因素,可以通过许多途径直接和间接诱导SHPT和细胞增殖[5]。另外,维生素D系统缺乏除了导致钙吸收减少外,其活性形式1,25(OH)2-D3即骨化三醇,通过与靶细胞内高度特异性的维生素D受体(VDR)结合而对其介导的基因进行调控,产生对钙磷代谢、甲状旁腺增生等多方面的调节作用[6]。随着甲状旁腺增生的发展,组织开始细胞紧密堆积结节性增生,VDR及CaR的密度明显减少,且可自主分泌PTH,不受维生素D负反馈抑制,临床药物难以起效[7]。
阿法骨化醇是骨化三醇的前体药物,半衰期相对较长,在肝脏微粒体内羟化后成为1,25(OH)2-D3,吸收入血后血药浓度稳定,分布于肠道及骨等器官内,与受体结合,发挥作用的时间较长,可持久促进肠道吸收钙和骨的形成,更加适合间断冲击给药。阿法骨化醇还可与甲状旁腺组织中的VDR结合,在基因转录水平上抑制PTH过度分泌等代谢调节作用[8]。尿毒症血液透析患者在肝功能正常时补充生理剂量的阿法骨化醇,在体内羟化后可促进钙吸收,血中一定水平的1,25(OH)2-D3与升高的血钙浓度均可抑制PTH分泌,控制SHPT的进展[9]。
本研究中,2组患者的血钙在疗程中的各个观察周均较治疗前显著升高(P<0.05),但都在正常范围内(<2.54mmol·L-1),与文献报道相符[10],且2组同期比较差异无统计学意义(P>0.05)。根据文献[11]报道,血钙出现上述变化的可能机制为阿法骨化醇直接作用于甲状旁腺,提高甲状旁腺细胞中VDR数目和敏感性,恢复钙调定点正常;间接作用于小肠,促进其对钙的吸收,提高血钙水平,反馈性抑制PTH分泌。治疗过程中常规组曾出现一过性高钙血症3例,冲击组出现1例,比较而言,冲击给药较常规给药相对更加安全,与文献报道相符[10]。可能由于冲击给药的促进肠胃吸收钙的作用较间接,故发生高钙血症的几率较常规给药更小。
血磷水平冲击组治疗前、后比较差异无统计学意义(P>0.05);而常规组治疗第4、8、12周较治疗前有所上升,但无统计学意义(P>0.05)。考虑机制为阿法骨化醇可以刺激肠道VDR促进对钙和磷的吸收,使血清钙磷同时升高。而常规组升高更显著,结合上述血钙变化情况,常规组一过性高钙血症例数大于冲击组,说明以往常规给药方式更能引起血钙、血磷的上升。这可能与SHPT患者VDR减少,以往常规的每日给药方式不足以抑制甲状旁腺的增生,却促进了肠道对钙磷的吸收以及增加骨钙磷的释放[12,13]有关。
常规组在治疗第4、8周时钙磷乘积显著高于冲击组,差异有统计学意义(P<0.05)。表明冲击给药对于患者的血钙、血磷浓度的影响相对更小,与文献报道[14]相符。
在治疗第4、8、12周时,冲击组的iPTH下降幅度显著大于常规组,差异有统计学意义(P<0.05)。表明冲击给药和每日给药均能使患者的iPTH水平下降,但冲击给药起效更快、疗效更好,与国内、外有关文献报道[15]相符。
ALP是最常应用的评价骨形成和骨转换的指标,也是反映成骨细胞活性增加的重要标志[16]。本研究结果表明,2组患者治疗后ALP水平均较治疗前显著下降,差异有统计学意义(P<0.05),与文献报道[17]相符,进一步证实了阿法骨化醇对SHPT有较好疗效,有益于肾性骨病的治疗。
综上所述,阿法骨化醇口服常规治疗和冲击治疗均能控制尿毒症血液透析患者SHPT,但冲击治疗疗效更明显,且起效快。但本研究样本量较小,期待临床大样本试验进一步研究。
[1]王海燕.肾脏病学[M].第3版.北京:人民卫生出版社,2008:1919-1931.
[2]Brandi L,Egfjord M,Olgaard K.Pharmacokinetics of 1,25(OH)2D3and 1-alpha(OH)D3in normal and uremic men[J].Nephrol Dial Transplant,2002,17(5):829.
[3]Jara A,Chacon C,Valdivieso A,et al.Effect of calcitriol treatment and with drawal on hyperparathyridism in haemodialysis patients with hypocalcaemia[J].Nephrol Dial Transplant,2001,16(5):1009.
[4]Hruska KA,Saab G,Chaudhary.LR Kidney-bone,bonekidney,and cell-cell communi-cations in renal osteodystrophy[J].Semin Nephro,2004,24(1):25.
[5]Brusi F,Weston SA,Redfieldmm,et al.Systolic and diastolic heart failure in the community[J].JAMA,2006,296(18):2209.
[6]Bettencourt P,Frioes F,Azevedo A,et al.Prognostic information provided by serial measurements of brain natriuretic peptidein heart failure[J].In J Cardiol,2004,93(1):45.
[7]US Renal Data System.2004 Annual Data Report[J].Am J Kidney Dis,2004,34:557.
[8]陈向前,陈维广.阿法迪三治疗规律血液透析患者继发性甲状旁腺功能亢进的临床研究[J].中国血液净化,2005,6(4):334.
[9]Torres PU,Prie D,Beck L,et al.New therapies for uremic secondary hyperparathyroi-dism[J].J Ren Nutr,2006,16(2):87.
[10]Cozzolino M,Gallieni M,Brancaccio D.Vascular calcification in uremic condition:new insights into pathogenesis[J].Semin Nephrol,2006,26(1):33.
[11]孟建中,梅长林.1,25(OH)2E3受体与肾性甲旁亢关系的研究进展[J].医学综述,2001,7(5):261.
[12]Cozzolino M,Pasho S,Fallabrino G,et al.Pathogenesis of secondary hyperparathyroidism[J].Int J Artif Organs,2009,32(2):75.
[13]Lezaic V,Pejanovic S,Kostic S,et al.Effects of lowering dialysis calcium concerntraction onmineral metabolism and parathyroid hormone secretion:multicentre study[J].The Apher Dia,2007,11(2):121.
[14]蒋红樱,张 利.透析患者iPTH水平及钙磷代谢紊乱的关系[J].医学临床研究,2008,11(25):2094.
[15]毕敬涛,张自琴.原发性甲状旁腺功能亢进骨病影像及骨代谢指标特点分析[J].山东医药,2008,19(48):78.
[16]Andrew F,Shorr Kenneth G,Torrington.Endobronchial Biopsy for sarcoidosis[J].Chest,2001,120(1):109.
[17]Trisolini R,Aglill,Cancellieri A,et al.The value of flexible Tran bronchial needle aspiration in the diagnosis of stage I Sacoiclosis[J].Chest,2003,124(6):2126.
