糖尿病性牙周炎与氧化应激的研究进展
2012-05-18综述赵桂芝审校
韩 春 综述;柯 杰,赵桂芝 审校
(解放军空军总医院口腔科,北京 100036)
目前,世界卫生组织已将糖尿病列为严重影响人类健康的三大疾病之一,据预测:到2025年将有30多亿人口受到糖尿病的影响[1]。联合国估计全球受到糖尿病影响的人数是24.6亿,其中约一半人口来自印度、中国、尼泊尔以及其他亚洲国家[2]。牙周炎是人类最常见的口腔疾病之一,曾被认为其只局限于口腔组织,而仅被口腔医务工作者所关注。但近年来越来越多的证据已经改变了这个观点,有研究发现:牙周炎可能在影响系统健康的多种疾病上扮演着重要角色[3],包括牙周炎不利于糖尿病病人的血糖控制,可能增加糖尿病并发症的风险[3-4]。同时研究还发现:糖尿病病人牙龈炎和牙周炎的发病率非常高,提示糖尿病对于牙周炎也是一个显著的危险因素[4-5]。早在1928年,William等通过研究认为:糖尿病病人与非糖尿病病人的牙周炎具有不同特征,从而提出了糖尿病性牙周炎(diabetic periodontitis)的概念,目前将Ⅱ型糖尿病病人罹患的牙周炎统称为糖尿病性牙周炎。近年来,随着牙周炎与糖尿病之间的关系的确立,糖尿病性牙周炎这一概念也逐渐被国内外学者认可。
糖尿病的根本危害在于其各种并发症,即代谢综合征,因此,研究糖尿病并发症的发病机制具有重要意义。经典糖尿病并发症的发病机制包括:多元醇途径、糖基化终产物(AGE)途径、蛋白激酶C(PKC)激活途径和己糖胺途径。最近,Michael Brownlee提出了糖尿病并发症的统一机制学说[6],认为上述各经典机制可能均是在高糖情况下,线粒体呼吸链中氧自由基生成过多(图1),即氧化应激(oxidative stress)所导致的结果。
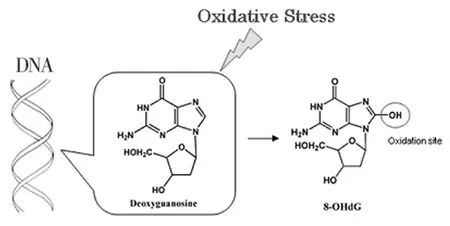
图1 氧化应激对线粒体的作用机制
氧化应激在糖尿病性牙周炎牙周组织破坏过程中的作用现已受到许多学者的重视。糖尿病条件下牙周组织中产生较多的活性氧簇产物,这些过氧化物加剧了牙周组织的损伤,导致了牙周组织破坏加重。本文就糖尿病性牙周炎与氧化应激之间的关系作一综述,旨在探讨氧化应激在糖尿病性牙周炎组织破坏过程中的作用,为糖尿病性牙周炎的治疗提供新的思路。
1 糖尿病性牙周炎
越来越多的证据表明:糖尿病能增加牙周炎的危险性和严重性,同时,牙周炎的存在又可能反过来影响糖尿病病人的血糖控制,增加糖尿病并发症的发生率[1,3,7-8]。由于牙周炎通常没有明显症状,直到牙周组织出现明显破坏时,病人才会意识到,同时,很多内科医师可能并不知道牙周炎能够影响血糖控制,从而使糖尿病控制难度加大。血糖控制差,则会进一步增加牙周炎的风险,所以应该询问病人在过去的6~12个月中是否看过牙医。如果没有,应推荐糖尿病病人找牙周专科医师进行一次彻底的牙周状况评估和牙周治疗,并在牙周治疗数月后再次检测HbA1c水平,以检测牙周治疗后的全身效应。
1.1 糖尿病对牙周炎的影响
很多证据表明糖尿病是牙龈炎和牙周炎的危险因素,血糖水平的控制在两者关系中起着重要的作用[4,9-10]。血糖控制较差是牙周进行性破坏的一个很危险的因素,与血糖控制较好的病人相比其牙周破坏程度更严重[11-12]。目前,已有很多研究对糖尿病影响牙周组织的机理进行了探讨[4,8],其中,解释糖尿病并发症的经典的微血管和大血管理论在牙周组织上也适用。牙周组织是末端血管丰富的器官,在很大程度上类似于视网膜或肾小球。糖基化终产物的聚集以及细胞对基质,基质对基质的相互作用,均能增加组织的氧化应激,改变内皮细胞功能,增加金属蛋白酶基质的活性。因此,经典的糖尿病并发症也在牙周组织有表现[4,10]。
糖尿病病人牙周组织的免疫炎症反应比较特殊,糖尿病导致了免疫细胞(主要是白细胞、单核细胞和巨噬细胞)功能的改变。而中性粒细胞粘连、趋化和吞噬功能被损伤后,牙周袋中的细菌会进一步破坏牙周组织[10]。单核-巨噬细胞系统可能对于糖尿病病人的细菌抗原有高反应性,导致产生了大量的前炎性因子和介质,例如糖尿病病人与健康人相比,其外周血单核细胞对G-菌、牙龈卟啉单胞菌的抗原反应性TNF-α的产量明显增高[13];高炎性单核-巨噬反应导致了毗邻牙齿龈沟液内前炎性因子的增加。此外,控制较差的糖尿病病人龈沟液内的IL-1β浓度则升高2倍[14]。糖尿病病人宿主防御系统的改变导致了牙周组织炎症的增加和牙齿支持结构的破坏。
1.2 牙周炎对糖尿病的影响
牙周炎对糖尿病的代谢状态有明显的影响,患有牙周炎的糖尿病病人的血糖控制风险可增高6倍[15]。牙周炎也与糖尿病并发症的增多有着密切的相关性。从一项持续11年的研究中发现[5]:82%的牙周炎糖尿病病人有一种或几种心血管、脑血管或外周血管并发症,较没有牙周炎的糖尿病病人的发病率(21%)要高很多。一项对600名Ⅱ型糖尿病病人牙周炎发病率研究发现[16]:在考虑到其他已知的危险因素后,严重牙周炎病人缺血性心脏病的病死率是轻度或没有牙周炎病人的2.3倍;而糖尿病性肾病的病死率是其8.5倍。经过22年的随访发现:患有中度到重度牙周炎的Ⅱ型糖尿病病人其巨型蛋白尿和肾终末期疾病的发病率是没有或轻度牙周炎病人的2到3倍[17]。提示:牙周炎的存在能使糖尿病病人的心血管疾病、肾病并发症的发病率上升。
临床干预试验表明:糖尿病病人的牙周治疗对糖代谢有明显的作用。有研究证实:患有严重牙周炎的糖尿病病人在血糖控制下,配合洁治和根面平整术并辅以全身抗生素的治疗,能使其病情明显的改善[18-20],而在其他医学治疗没有改变的条件下(HbA1c绝对降低1%),牙周治疗后2~3个月HbA1c水平降低了约10%;洁治加根面平整术后即使不用抗生素,牙周组织健康仍将有所改善,HbA1c水平也会相应的降低[21-22]。但是,不是所有的研究都支持这一结论,在一些研究中,虽然牙周治疗能使牙周健康得到改善,但血糖控制并没有明显的改变[23]。例如,在一些病人经牙周治疗后HbA1c降低1到2个百分点,而另一些接受相同治疗者HbA1c则变化很小。在一项包括456名病人的10个干预实验的Meta分析中,HbA1c绝对值的加权平均值在牙周治疗后降低大约0.7%,其中包括清创术和全身抗生素治疗,但是这种降低并没有明显的统计学差异[24]。由于研究人群不均匀,样本量不足,有吸烟的混杂效应,体质量指数以及药物治疗史等均使得该项meta分析的结果很难推广。
已有许多学者,对牙周炎影响糖尿病血糖控制的可能机理进行了深入研究[4,8],从中不难发现:牙周炎能明显影响全身的健康状况。牙周炎病人血浆中的炎性介质和血栓形成介质例如TNF-α、IL-6、纤维蛋白素原以及交叉反应蛋白的升高对血糖的控制有着很大的影响,特别是他们对于胰岛素均有拮抗作用[25-26]。这些介质在肥胖、胰岛素抵抗、高血糖症以及糖尿病时明显升高[8]。肥胖和胰岛素拮抗与IL-6和TNF-α的激活以及肝内急性期反应物的合成有关[27]。在Ⅱ型糖尿病的牙周炎病人中,源自牙周炎升高的血清炎性介质将会增加已有的胰岛素拮抗,降低血糖控制水平。最新的研究表明[28]:患有牙周炎的Ⅱ型糖尿病病人血清中的TNF-α水平主要与牙周组织的破坏有关,而不是与体质量指数有关。因此,牙周治疗不仅仅减轻局部的炎症,而且能够降低血清中造成胰岛素拮抗的炎性介质水平,从而对血糖控制有积极的作用。
2 氧化应激(oxidative stress)在糖尿病领域的研究进展
氧化应激是指机体中自由基的产生和清除平衡被一些病理因素(包括促进自由基的产生或者抑制自由基清除的多种因素)破坏,引起组织的损伤。正常的机体组织在代谢反应过程中,可形成一些自由基,包括、H2O2、OH-等有害的中间产物,通常这些自由基被称为活性氧簇(ROS);同时正常机体组织有多种抗氧化酶和非酶系统促进ROS清除,阻止或限制ROS损伤,维持细胞正常的代谢活动。起主要作用的抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等。氧化应激是一种高反应性分子物种如ROS、活性氮簇(RNS)以及抗氧化保护之间的持续失衡。在前糖尿病阶段,ROS是升高的,可能与肥胖相关的游离脂肪酸(FFA)升高相关。许多研究表明:ROS和抗氧化剂之间的失衡提高了人和大鼠对于胰岛素的耐受性。
糖尿病个体中氧化应激产生的最根本原因在于:高糖可引起三羧酸循环中电子供体生成增多,导致线粒体膜的电位升高,进而抑制呼吸链中复合物Ⅲ的作用,延长辅酶Q半衰期,促进了O2向的转化,生成增多,引发氧化应激。体外实验中,应用解偶联蛋白-1(UCP-1)、锰超氧化物酶(MnSOD)等方法,使线粒体中恢复正常,从而抑制PKC的激活、AGE的形成和山梨醇的聚积。以上研究表明:氧化应激是糖尿病并发症的根本原因,为糖尿病研究开辟了新领域。
3 氧化应激在糖尿病性牙周炎中的破坏作用
大量研究表明:糖尿病病人的牙周炎发病率和病变程度均高于非糖尿病人群,糖尿病性牙周炎是目前公认的糖尿病第六大并发症[3-4,8],其确切的致病机制尚未阐明,可能的生物学机制包括免疫遗传学因素、牙周菌群的改变、高脂和高糖协同学说等。牙周炎是由牙齿上的致病微生物“牙菌斑”刺激宿主引起的免疫反应,病原体牙菌斑的存在是牙周炎发生的前提条件,当牙周炎发生时,白介素8和巨噬细胞集落刺激因子的生成补充激活了嗜中性粒细胞,导致牙周组织中产生较多的活性氧簇产物,这些过氧化物加剧了包括牙周膜和牙槽骨在内的牙周组织损伤。目前已有研究发现:糖尿病病人的牙龈组织中可检测到氧化应激特异性产物8-OHdG/8-OHG的存在,但未有文献报道其在牙周组织中的分布特点或相关作用机制。对于糖尿病病人,高血糖导致更多的氧化应激产物ROS生成,而这些活性氧簇可能与糖尿病性牙周炎破坏程度大、进展速度快直接相关。
目前已有的研究发现:氧化应激在牙周炎,特别是糖尿病性牙周炎中作用明显,糖尿病可引起了全身器官和组织均处于氧化应激的状态,而牙周炎病人由于牙周组织的微环境中存在有大量的细菌微生物,持续处于炎症状态,在糖尿病的大环境下,进一步增加了细胞因子,例如IL-8,TNF-α等炎性因子的分泌,加剧了其对于牙周组织的破坏,特别是对牙槽骨的破坏[29]。单纯的牙周炎可以通过局部的洁治,手术以及抗生素治疗控制炎症,促进牙槽骨的修复;而糖尿病性牙周炎仅仅依靠局部抗感染治疗的方法很难对牙周组织的破坏有很好的控制,因为研究发现氧化应激在牙周炎中的破坏作用已经越来越明显[29],能否通过改善牙周局部氧化应激的状态来减轻或阻止糖尿病性牙周炎的破坏,从而进一步联合治疗糖尿病性牙周炎呢?这可能是治疗糖尿病性牙周炎的一个新思路。
4 抗氧化剂在治疗糖尿病性牙周炎中的应用
抗氧化剂存在于人体体液和组织中,能保护人体组织不受自由基的影响。人体内的抗氧化剂通过移除氧化剂或修复被氧化应激ROS损伤的组织,而保护细胞不受有害的氧化剂 ROS的影响[30]。这种具有清除作用的抗氧化剂主要包括:维生素E、维生素C、维生素A尿酸盐、胆红素以及包括SH基团的物质[31]。尽管维生素C在牙周组织健康中的作用并不清楚,但其作为一种潜在的局部预防牙周炎的药物已经开始得到重视[32]。
虽然维生素C摄入量低并没有造成牙周炎,但是维生素C在感染疾病和组织再生中都有着明显的作用[33]。维生素C在细胞间物质的合成,例如在多种形式连接组织的胶原以及骨和牙齿的基质中[34]均具有免疫调节功能,能影响宿主对于感染疾病的敏感性[35]。这些特性使得维生素C能够作为一种抗氧化剂应用于糖尿病牙周炎的治疗,但是可能由于加载时间和方式的问题,目前维生素C在单纯性牙周炎治疗上的作用效果仍然不明显,可是,从氧化应激的角度控制治疗糖尿病性牙周炎,能否将维生素C应用于糖尿病性牙周炎的治疗上,也许是一种新的治疗糖尿病性牙周炎思路。
5 问题和展望
目前,糖尿病加重牙周组织破坏的分子机制仍未完全明确,相关研究提示糖尿病所引起的氧化应激可能加重牙周组织破坏,但这一推测尚需进一步证实。此外,糖尿病性牙周炎组织破坏过程中,氧化应激对于成纤维细胞、成骨细胞、破骨细胞以及骨细胞的作用机制尚不清楚,所有这些问题有待于进一步深入研究。探讨糖尿病牙周炎与氧化应激的关系,为研究糖尿病加重牙周炎的机理提供了新的思路,从氧化应激入手控制糖尿病性牙周炎将可能成为治疗糖尿病牙周炎的一个重要方向。
[1]Preshaw PM.Periodontal disease and diabetes[J].J Dent,2009,37(8):S575-577.
[2]Sicree R,Shaw J,Zimmet P.Diabetes and impaired glucose tolerance.In:Gan D,editor.Diabetes Atlas.International Diabetes Federation.3rd ed[M].Belgium:International Diabetes Federation,2006:15-103.
[3]Mealey BL,Rose LF.Diabetes mellitus and inflammatory periodontal diseases[J].Compend Contin Educ Dent,2008,29(7):402-408,410,412-403.
[4]Mealey BL,Oates TW.Diabetes mellitus and periodontal diseases[J].J Periodontol,2006,77(8):1289 -1303.
[5]Thorstensson H,Kuylenstierna J,Hugoson A.Medical status and complications in relation to periodontal disease experience in insulin-dependent diabetics[J].J Clin Periodontol,1996,23(3 Pt 1):194-202.
[6]Brouwers O,Niessen PM,Ferreira I,et al.Overexpression of glyoxalase-I reduces hyperglycemia-induced levels of advanced glycation end products and oxidative stress in diabetic rats[J].J Biol Chem,2011,286(2):1374-1380.
[7]Taiyeb-Ali TB,Raman RP,Vaithilingam RD.Relationship between periodontal disease and diabetes mellitus:an Asian perspective[J].Periodontol,2000,2011,56(1):258 - 268.
[8]Mealey BL,Ocampo GL.Diabetes mellitus and periodontal disease[J].Periodontol,2000,2007,44:127 - 153.
[9]Lalla E,Cheng B,Lal S,et al.Periodontal changes in children and adolescents with diabetes:a case-control study[J].Diabetes Care,2006,29(2):295 -299.
[10]Mealey BL.Periodontal disease and diabetes.A two-way street[J].J Am Dent Assoc,2006,137(Suppl):26S -31S.
[11]Campus G,Salem A,Uzzau S,et al.Diabetes and periodontal disease:a case- control study[J].J Periodontol,2005,76(3):418-425.
[12]Tsai C,Hayes C,Taylor GW.Glycemic control of type 2 diabetes and severe periodontal disease in the US adult population[J].Community Dent Oral Epidemiol,2002,30(3):182 -192.
[13]Salvi GE,Collins JG,Yalda B,et al.Monocytic TNF alpha secretion patterns in IDDM patients with periodontal diseases[J].J Clin Periodontol,1997,24(1):8-16.
[14]Engebretson SP,Hey-Hadavi J,Ehrhardt FJ,et al.Gingival crevicular fluid levels of interleukin-1beta and glycemic control in patients with chronic periodontitis and type 2 diabetes[J].J Periodontol,2004,75(9):1203 -1208.
[15]Taylor GW,Burt BA,Becker BP,et al.Severe periodontitis and risk for poor glycemic control in patients with non-insulin -dependent diabetes mellitus[J].J Periodontol,1996,67(10 Suppl):1085-1093.
[16]Saremi A,Nelson RG,Tulloch-Reid M,et al.Periodontal disease and mortality in type 2 diabetes[J].Diabetes Care,2005,28(1):27-32.
[17]Shultis WA,Weil EJ,Looker HC et al.Effect of periodontitis on overt nephropathy and end-stage renal disease in type 2 diabetes[J].Diabetes Care,2007,30(2):306 - 311.
[18]Miller LS,Manwell MA,Newbold D,et al.The relationship between reduction in periodontal inflammation and diabetes control:a report of 9 cases[J].J Periodontol,1992,63(10):843-848.
[19]Grossi SG,Skrepcinski FB,DeCaro T,et al.Response to periodontal therapy in diabetics and smokers[J].J Periodontol,1996,67(10 Suppl):1094-1102.
[20]Grossi SG,Skrepcinski FB,DeCaro T,et al.Treatment of periodontal disease in diabetics reduces glycated hemoglobin[J].J Periodontol,1997,68(8):713 -719.
[21]Stewart JE,Wager KA,Friedlander AH,et al.The effect of periodontal treatment on glycemic control in patients with type 2 diabetes mellitus[J].J Clin Periodontol,2001,28(4):306 -310.
[22]Kiran M,Arpak N,Unsal E,et al.The effect of improved periodontal health on metabolic control in type 2 diabetes mellitus[J].J Clin Periodontol,2005,32(3):266 -272.
[23]Jones JA,Miller DR,Wehler CJ,et al.Does periodontal care improve glycemic control?The Department of Veterans Affairs Dental Diabetes Study[J].J Clin Periodontol,2007,34(1):46-52.
[24]Janket SJ,Wightman A,Baird AE,et al.Does periodontal treatment improve glycemic control in diabetic patients?A meta- analysis of intervention studies[J].J Dent Res,2005,84(12):1154-1159.
[25]Nishimura F,Iwamoto Y,Soga Y.The periodontal host response with diabetes[J].Periodontol,2000,2007,43:245 -253.
[26]Genco RJ,Grossi SG,Ho A,et al.A proposed model linking inflammation to obesity,diabetes,and periodontal infections[J].J Periodontol,2005,76(11 Suppl):2075 -2084.
[27]Pickup JC,Crook MA.Is type II diabetes mellitus a disease of the innate immune system?[J].Diabetologia,1998,41(10):1241-1248.
[28]Engebretson S,Chertog R,Nichols A,et al.Plasma levels of tumour necrosis factor-alpha in patients with chronic periodontitis and type 2 diabetes[J].J Clin Periodontol,2007,34(1):18-24.
[29]Ohnishi T,Bandow K,Kakimoto K,et al.Oxidative stress causes alveolar bone loss in metabolic syndrome model mice with type 2 diabetes[J].J Periodontal Res,2009,44(1):43 - 5 1.
[30]Halliwell B.Reactive oxygen species in living systems:source,biochemistry,and role in human disease[J].Am J Med,1991,91(3C):14S-22S.
[31]Chapple IL.Reactive oxygen species and antioxidants in inflammatory diseases[J].J Clin Periodontol,1997,24(5):287 -296.
[32]Nishida M,Grossi SG,Dunford RG,et al.Dietary vitamin C and the risk for periodontal disease[J].J Periodontol,2000,71(8):1215-1223.
[33]Rubin MB.Vitamins and wound healing[J].Plast Surg Nurs,1984,4(1):16-19.
[34]Geesin JC,Darr D,Kaufman R,et al.Ascorbic acid specifically increases type I and type III procollagen messenger RNA levels in human skin fibroblast[J].J Invest Dermatol,1988,90(4):420-424.
[35]Field CJ,Johnson IR,Schley PD.Nutrients and their role in host resistance to infection[J].J Leukoc Biol,2002,71(1):16-32.
