TRAF1蛋白在乳腺癌中的表达及意义
2012-05-15代文博米小轶林红刘楠
代文博,米小轶,林红,刘楠
(1. 沈阳市第一人民医院病理科,辽宁 沈阳 110041;2. 中国医科大学病理学教研室)
肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factor,TRAF)是细胞内重要的信号传导蛋白,它可与多种肿瘤坏死因子受体和IL-1R/TLR家族成员结合,参与调节NF-κB和JNK等多种信号转导通路的激活,具有调节正常细胞和肿瘤细胞的增殖、存活、凋亡、参与炎症反应等多种功能[1]。TRAF1是TRAF家族成员中的一个分子,有研究表明TRAF1在鼻咽癌和淋巴瘤组织中表达升高[2-3],但其在乳腺癌中的表达及意义尚不清楚。本实验主要应用免疫组化和Western blot方法研究TRAF1在乳腺癌组织和细胞中表达的变化情况,并分析其与微血管密度之间的关系。
1 材料和方法
1.1 标本来源 70例乳腺癌组织包括35例非浸润性导管癌(导管原位癌)和35例浸润性导管癌来自中国医科大学附属第一医院手术切除存档蜡块。患者均为女性,中位年龄51岁(28~70岁)。对照标本为癌旁非癌乳腺组织,经病理确认为正常乳腺组织共14例。
人雌激素依赖性受体乳腺癌细胞系MCF-7(低侵袭)和人雌激素非依赖性受体乳腺癌细胞系MDA-MB-231(高侵袭)购于中科院上海细胞库。
1.2 主要试剂 TRAF1鼠抗人单克隆抗体购自美国Santa Cruz公司。CD34鼠抗人单克隆抗体购自美国DACO公司。S-P超敏试剂盒和DAB酶底物显色试剂盒购自福州迈新生物技术开发公司。辣根酶标记第二抗体购自北京中杉金桥生物技术有限公司。DMEM低糖和RPMI 1640培养液、胎牛血清、胰酶购于GIBCO公司。
1.3 方法
1.3.1 免疫组化染色 采用链霉素抗生物素蛋白-过氧化物酶(SP)法。石蜡切片常规脱蜡至水,以胰酶进行抗原修复,依次滴加过氧化物酶阻断液(37 ℃封闭10 min),10%非免疫性动物血清(37 ℃孵育40 min),第一抗体(1∶50,4 ℃冰箱过夜),生物素标记的第二抗体(37 ℃孵育20 min),S-A/HRP溶液(37 ℃孵育20 min),DAB显色,苏木素复染,脱水透明,中性树脂封片。用PBS代替一抗作阴性对照。
1.3.2 细胞培养 MCF-7和MDA-MB-231细胞以常规细胞培养方法分别采用DMEM低糖和RPMI 1640培养液(每100 ml培养液中含10%的FBS,10 mmol/L Hepes,100 U/ml青、链霉素)在37 ℃、5% CO2条件下进行培养。
1.3.3 Western blot方法 取对数生长期细胞,于4 ℃下加入裂解缓冲液(50 mmol/L、Ph 7.4 Tris HCl,150 mmol/L NaCl,0.1% SDS,1% Triton-100,1 mmol/L EDTA,1.2 μl/ml Aprotinin,6 μl/ml PMSF),静置30 min,低温高速离心(4 ℃,12 000 r/min,30 min),保留上清。采用Folin酚试剂法进行蛋白定量。取等量蛋白,进行SDS聚丙烯酰胺凝胶电泳,5%浓缩胶中恒压(电压80 V,电流0.01 A)电泳约15 min,12%分离胶中恒压(电压120 V,电流0.02 A)电泳约50 min后,取下凝胶进行转印(恒压,电压40 V,2 h),取出PVDF膜经TBS液洗涤10 min后,封闭液封闭2 h,第一抗体(鼠单克隆抗体均为1∶150稀释,兔多克隆抗体为1∶200稀释)4 ℃过夜,辣根酶标记第二抗体(1∶1 500稀释)室温孵育2 h,DAB显色。实验结果经自动电泳凝胶成像分析仪采集,进行灰度值测定,对比两种细胞系中表达的差异。实验重复3次。
1.4 免疫组化结果判定 TRAF1判定标准参见许良中等[4]的免疫组织化学反应结果的判断标准。
CD34判定标准为:由内皮细胞形成的条索、腔隙状等孤立或簇状结构的棕黄色染色及有管腔者(管腔小于8个红细胞大小的)按一条微血管计数。先在低倍镜(×10)下找到肿瘤组织血管最密集区域,再在高倍镜(×20)下计数3个不重复视野内的微血管数,取其平均值作为最终微血管密度。
1.5 统计学分析 采用SPSS10.0统计分析软件,TRAF1在乳腺癌组织中的表达采用χ2检验,在乳腺癌细胞系中的表达、与微血管密度之间的关系采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TRAF1在乳腺癌组织中的表达 TRAF1在正常乳腺组织中不表达,表达于乳腺癌的肿瘤细胞胞浆内(图1)。

图1 TRAF1在正常乳腺(A)、非浸润性导管癌(B)、浸润性导管癌(C)组织中的表达(SP×400)
TRAF1阳性表达率在乳腺非浸润性导管癌中高于正常乳腺组织,但差异无统计学意义(P>0.05)。在乳腺浸润性导管癌中的阳性表达率明显高于正常乳腺组织(P<0.05)。在乳腺浸润性导管癌中的阳性表达率明显高于非浸润性导管癌 (P<0.05),见表1。TRAF1表达与乳腺癌侵袭性相关。
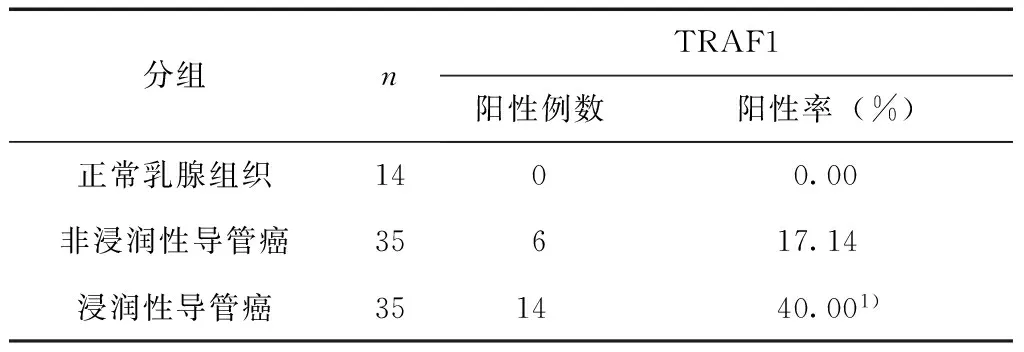
表1 TRAF1在乳腺癌组织中的表达
注:1)与正常乳腺组织、非浸润性导管癌比较P<0.05
2.2 TRAF1在乳腺癌细胞中的表达 TRAF1在乳腺癌高侵袭细胞系MDAMB-231的表达量高于低侵袭细胞系MCF-7,但差异无统计学意义(P>0.05),见图2。

图2 TRAF1在高、低侵袭乳腺癌细胞系中的表达注:1.低侵袭细胞系MCF-7;2.高侵袭细胞系MDA-MB-231
2.3 TRAF1与微血管密度之间的关系 乳腺浸润性导管癌中,TRAF1阳性表达的微血管密度平均值(MVD)(80.96±13.77)明显高于阴性表达组(66.08±24.24)(P<0.05),TRAF1表达与浸润性导管癌的微血管密度有关。
3 讨论
TRAF家族成员是细胞内重要的信号传导蛋白,它一方面借助自身羧基端的TRAF同源结构域,与不同的细胞表面受体蛋白相结合,另一方面它通过氨基端含有的环指/锌指结构域,介导DNA-蛋白质或蛋白质-蛋白质间的相互作用,将信号向下游传递[5]。
TRAF1是TRAF家族成员中的一种,在正常组织中表达较局限,只表达于脾、肺、睾丸。研究证实TRAF1是一种抗凋亡蛋白,TRAF1过表达抑制CD8+T淋巴细胞凋亡[6]。Siegler等[3]研究表明TRAF1在霍奇金淋巴瘤中过表达。另有研究表明TRAF1在鼻咽癌中表达高于癌旁组织,提示其过表达可能发挥抑制癌细胞凋亡的作用[2]。Suqhra等[7]认为TRAF1通过调节NF-κB通路来发挥其抗凋亡功能。近来的研究表明,TRAF1-C5单核苷酸多态性还与类风湿关节炎的发生密切相关[8]。
肿瘤的血管生成为肿瘤的浸润转移提供了途
径。TRAF信号通路中的一些分子如TNF、TWEAK 、NF-κB等均被证实具有促进血管生成的功能[9-10],而TRAF作为重要的信号传导分子是否具有促血管生成功能尚不知晓。
我们的研究结果表明,TRAF1在正常乳腺组织中不表达,在浸润性导管癌中的表达明显高于正常乳腺组织和非浸润性导管癌,此外TRAF1在高侵袭细胞系中的表达也高于低侵袭细胞系,提示TRAF1表达量的改变可能与乳腺癌侵袭性相关。TRAF1在乳腺癌组织中的表达是否抑制乳腺癌细胞凋亡仍需进一步研究。此外,乳腺浸润性导管癌中TRAF1与微血管密度呈正相关,提示TRAF1可能在乳腺癌的血管生成过程中发挥一定的作用。
参考文献:
[1]Aggarwal BB.Tumour necrosis factors receptor associated signaling molecules and their role in activation of apoptosis, JNK and NF-κB [J]. Ann Rheum Dis, 2000, 59(suppl I):i6-i16.
[2]王承兴,邓锡云,李晓艳,等.TRAF1在鼻咽癌及癌旁组织中的表达[J].癌症,2000,19(9):857-859.
[3]Siegler G, Kremmer E, Gonnella R, et al. Epstein-Barr virus encoded latent membrane protein 1 (LMP1) and TNF receptor associated factors (TRAF): colocalisation of LMP1 and TRAF1 in primary EBV infection and in EBV associated Hodgkin lymphoma[J]. Mol Pathol,2003, 56(3):156-161.
[4]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志, 1996, 6(4):229-231.
[5]辛利君. TRAF:一种重要的接头分子 [J]. 国外医学 免疫学分册, 2002,25(3):143-146.
[6]Speiser DE,Lee SY, Wong B, et al. A regulatory role for TRAF1 in antigen-induced apoptosis of T cells[J].J Exp Med,1997,185:1777-1784.
[7]Sughra K, Birbach A, de Martin R, et al. Interaction of the TNFR-receptor associated factor TRAF1 with I-kappa B kinase-2 and TRAF2 indicates a regulatory function for NF-kappa B signaling[J]. PLoS One, 2010 , 5(9):e12683.
[8]Plenge RM, Seielstad M, Padyukov L, et al. TRAF1-C5 as a risk locus for rheumatoid arthritis--a genome wide study[J]. N Engl J Med, 2007,357(12):1199-1209.
[9]Donohue PJ, Richards CM, Brown SA, et al. TWEAK is an endothelial cell growth and chemotactic factor that also potentiates FGF-2 and VEGF-A mitogenic activity[J]. Arterioscler Thromb Vasc Biol, 2003, 23(4):594-600.
[10]Takashi K, Paul S, Ashish K, et al. Nuclear factor-kappaB mediates angiogenesis and metastasis of human bladder cancer through the regulation of interleukin-8[J].Clin Cancer Res, 2003, 9:2786-2797.
