地木耳总黄酮提取及抑菌作用
2012-05-10厉荣玉钱森和
厉荣玉,钱森和,董 群,刘 辉
(1.皖南医学院 医学微生物学与免疫学教研室,安徽 芜湖 241002;2.安徽工程大学 生物技术教研室,安徽 芜湖241000)
地木耳,学名普通念珠藻(Nostoccommune),别名地皮菜、地软、地耳、地踏菜等,属蓝藻门(Cyanophyta),蓝藻纲(Cyanophyceae),念珠藻目(Nostoccales),念珠藻科(Nostocaceae),念珠藻属(Nostoc)中的Nostoc communeVauch,为蓝藻科念珠藻属的片状藻类和真菌的复合体[1]。
研究表明,地木耳富含蛋白质、粗脂肪、粗纤维、矿物质、维生素、氨基酸、蓝藻素、多糖等各种营养成分[2-4]。近年来,人们发现地木耳细胞提取物中具有生物活性的物质,其提取液对蛋白酶活性、人鼻咽癌细胞、直肠癌细胞的生长和真菌均有抑制作用[5-6]。据张威[7](2007)初步研究发现,地木耳中含有粗多酚及粗黄酮类物质,具有一定的抗氧化和抗肿瘤活性,可以作为一种良好的天然抗氧化剂及抗肿瘤活性物质来源。目前,对地木耳中活性物质研究较多的为水溶性多糖提取,有关地木耳黄酮类化合物生物活性物质的提取研究较少。为此,本文通过单因素和正交试验对地木耳总黄酮提取工艺进行了优化;并以提取液对常见的几种微生物进行了抑菌试验,旨在为地木耳总黄酮在医学上的应用奠定基础。
1 材料与方法
1.1 材料与仪器 地木耳采购于芜湖市神山口菜市场,用蒸馏水洗净后,晾干保存备用;芦丁对照品购于中国医药(集团)上海化学试剂公司,其他试剂均为分析纯。试验所需的主要仪器有TU-1800型紫外-可见分光光度计,RE-52A型旋转蒸发仪,2K-82B型电热恒温真空干燥箱,HH-6型电热恒温水浴锅,SW-CJ-2FD型双人单面净化工作台等。
1.2 供试菌种 供试菌种分别为:大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、黑曲霉(Aspergillusniger)和白假丝酵母菌(Moniliaalbican)。以上供试菌种均为皖南医学院微生物学实验室保藏菌种。
1.3 试验方法
1.3.1 培养基 牛肉膏蛋白胨固体培养基。
1.3.2 芦丁标准曲线的绘制[8]精确称取芦丁标准品24.3 mg,用30%乙醇溶液溶解后转移到100 ml容量瓶中定容,配制成0.243 mg/ml的标准溶液。分别吸取标准溶液 0.0、1.0、2.0、3.0、4.0、5.0 ml于25 ml容量瓶中,并用30%乙醇补充至12.5 ml,加入 0.05%NaNO30.56 ml,摇匀后放置 5 min,再加入 0.1%Al(NO3)30.56 ml,摇匀后放置5 min,再加入4 ml 1 mol/L NaOH溶液。混匀后用30%乙醇溶液定容。静置15min后,在500 nm波长下分别测定吸光度(A),得到标准曲线的回归方程Y=1.136X+0.0045,R2=0.9967。
1.3.3 地木耳粗黄酮的提取 将地木耳晒干后粉碎,过40目筛得其粉末;取其粉末5 g置于100 ml圆底烧瓶中,在一定的乙醇浓度、料液比、水浴温度、浸提时间条件下进行浸提,结束后,立刻抽滤并收集滤液;以同样方法处理滤渣数次,抽滤并合并滤液,冷却至室温后,10 000 r/min离心10 min,除去少量叶绿素及其他水不溶性杂质,上清液定容后作为待测液。检测后剩余提取液蒸发浓缩,干燥后得到地木耳总黄酮粗样品粉末。
1.3.4 黄酮含量的测定 取待测液10 ml于25 ml容量瓶中,加入30% 乙醇溶液2.5 ml使其体积为12.5 ml。之后按1.3.2芦丁标准曲线的绘制方法操作,测定其在500 nm处的吸光度,并按下式计算总黄酮得率。

1.3.5 总黄酮提取的单因素和正交试验 试验提取次数选取为1次、2次、3次和4次四个水平;乙醇浓度为40%、50%、60%、70%、80%和90%六个水平;料液比选取 1∶10、1∶15、1∶20、1∶25 和 1∶30 五个水平,提取温度选取40℃、50℃、60℃、70℃和80℃五个水平;提取时间选取 0.5 h、1 h、1.5 h、2 h、2.5 h和3 h六个水平;分别进行单因素试验。在单因素试验的基础上,选取适宜的浸提次数后,采用适宜的乙醇浓度、料液比、提取温度和提取时间进行正交试验。
1.3.6 地木耳总黄酮的抑菌试验 将各种待试菌用适宜斜面活化后,以无菌生理盐水配制成107CFU/ml的菌悬液,备用。量取由验证试验得到的总黄酮提取液10 ml作为原液,采用二倍稀释法,用无菌水配制成不同浓度的溶液,依次为100%、50%、25%、12.5%、6.25%,并以无菌水作为对照,即浓度为0%;经微孔过滤器过滤除菌后,于4℃冰箱保存备用。采用滤纸片法进行抑菌试验,其具体方法是:将已冷却至45℃的高压灭菌后的培养基倒平板,待培养基凝固后,用无菌吸管吸取菌悬液0.2 ml涂平板。用无菌镊子将灭菌后的滤纸片(直径为6 mm)放入地木耳总黄酮溶液中,浸泡0.5 h后取出,将含样品的纸片贴于平板上,每个纸片相隔一定间距,每种菌各设3个重复,结果取平均值。将贴好滤纸片的平板倒置于恒温培养箱中培养,细菌于37℃培养24 h,白假丝酵母菌和霉菌于28℃分别培养48 h。使用游标卡尺精确测定滤纸片的抑菌圈直径大小,比较抑其菌效果。
2 结果与分析
2.1 提取次数对地木耳总黄酮得率的影响 图1为乙醇浓度为60%,料液比为1∶15,提取温度为60℃,提取时间为1.5 h的条件下,提取次数对地木耳总黄酮得率的影响。由图可知,随着提取次数的增加,总黄酮得率逐渐增加,当提取次数大于2次时,总黄酮提取得率增加幅度明显减小。因此,从生产成本及效率方面考虑,选择浸提次数为2次较为合适。
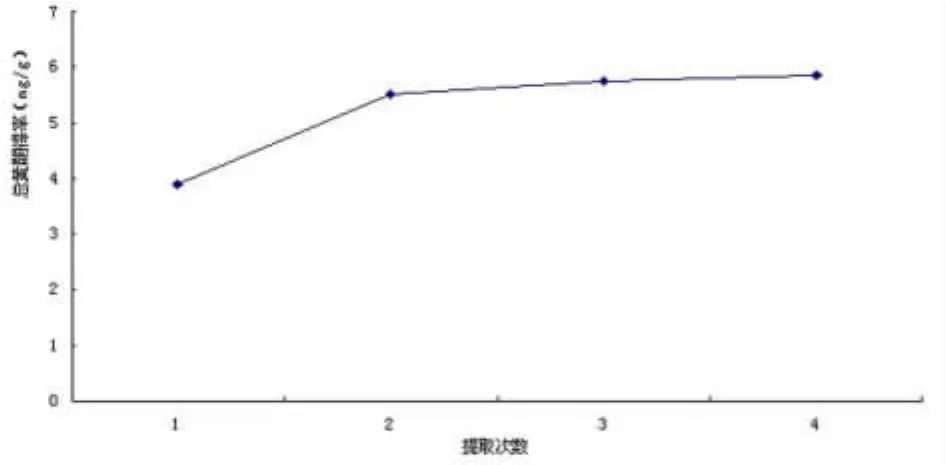
图1 浸提次数对地木耳总黄酮得率的影响Fig1 The effect of extraction frequencies on the yield of total flavonoids from Nostoc commune
2.2 乙醇浓度对地木耳总黄酮得率的影响 图2为提取次数为2次,料液比为1∶15,温度为60℃时,提取时间为1.5 h,不同乙醇浓度对总黄酮得率的影响。可以看出,随着乙醇体积的增多,黄酮得率逐渐增加,当乙醇浓度为80%时,其得率为最大值;浓度超过80%时,黄酮得率反而下降,其可能原因是提取溶剂中乙醇含量增大,从而造成脂溶性杂质增多的缘故[9]。另外,当乙醇浓度为70%时,黄酮得率为6.09%,与最大值6.14%相差无几。因此,从生产工艺对试剂损耗方面考虑,选择乙醇浓度为70%较为经济。
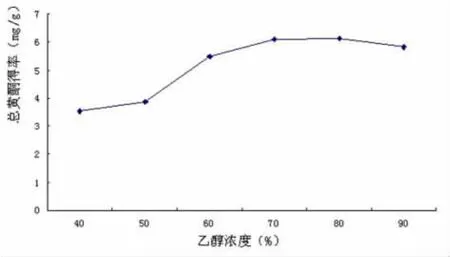
图2 乙醇浓度对地木耳总黄酮含量的影响Fig2 The effect of ethanol concentration on harvesting total flavonoids from Nostoc commune
2.3 料液比对地木耳总黄酮得率的影响 图3为提取次数为2次,乙醇浓度为70%,提取温度为60℃时,提取时间为1.5 h,不同料液比对地木耳总黄酮得率的影响。结果表明,随着料液比的增加,总黄酮的得率显著增加;当料液比大于1∶20时,其得率反而有下降的趋势。可能原因是随着溶剂的增加,总黄酮的溶解量也增加,当总黄酮已全部溶解,即使再增加溶剂的量,也不会使溶剂中的总黄酮的量增加,反而会稀释了总黄酮的溶质浓度,从而不利于总黄酮的沉淀。另外,考虑到料液比较大时,干燥、浓缩的工作量及能耗都相应增大,不符合实际生产的成本要求,因此,料液比不宜过高。

图3 料液比对地木耳总黄酮得率的影响Fig3 The effect of material/solvent ratio on output of total flavonoids from Nostoc commune
2.4 温度对地木耳总黄酮得率的影响 图4为提取次数为2次,乙醇浓度为70%,料液比为1∶20,时间为1.5 h时,不同提取温度对地木耳总黄酮得率的影响。从中可以看出,当提取温度从40℃增加到70℃时,地木耳总黄酮的得率增加较为明显,当温度大于70℃时,其得率增加幅度明显减小。可能原因是温度过高会对黄酮类化合物的结构造成破坏,同时加速了乙醇的挥发,从而影响到总黄酮的得率。因此,黄酮的提取温度不宜过高。
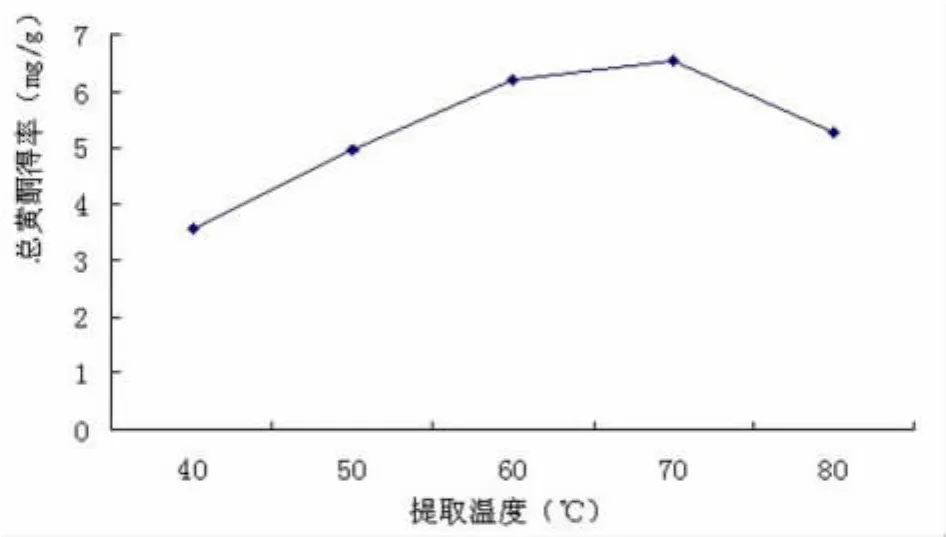
图4 提取温度对地木耳总黄酮得率的影响Fig4 The effect of extraction temperature on Nostoc commune flavonoids products
2.5 时间对地木耳总黄酮得率的影响 总黄酮浸出与时间的关系较为密切,时间过短,总黄酮不能完全浸出,时间过长,更多的杂质被溶解,从而影响其得率[10]。图 5为提取次数为 2次,乙醇浓度为70%,料液比为1∶20,提取温度为70℃时,不同提取时间对地木耳总黄酮得率的影响。结果表明,当提取时间小于2 h时,地木耳总黄酮得率增加显著;当提取时间大于2 h时,其总黄酮得率增加缓慢,几乎维持在同一水平。考虑到浸提时间延长能耗增加等因素,选取浸提时间为2 h。

图5 提取时间对地木耳总黄酮得率的影响Fig5 The effect of extraction duration on the output of total flavonoids form Nostoc commune
2.6 正交法提取地木耳总黄酮 为了考虑到各因素之间的相互作用,在单因素试验的基础上,进行正交试验。以提取次数为2次,采用L16(45)正交表,对乙醇浓度、料液比、提取温度、提取时间和进行四因素三水平正交试验。正交试验设计及其结果如表1所示,其方差分析如表2所示。

表1 正交试验结果与分析Tab1 Orthogonal test results and analysis
由表1正交试验极差分析结果可知,各因素对总黄酮得率影响大小的顺序为:乙醇浓度>料液比>提取温度>提取时间。通过表2正交试验方差分析结果可知,乙醇浓度、液料比和提取温度对地木耳总黄酮得率的影响达到了极显著水平,提取时间对地木耳总黄酮得率的影响差异不显著,但黄酮得率也有一定的影响。
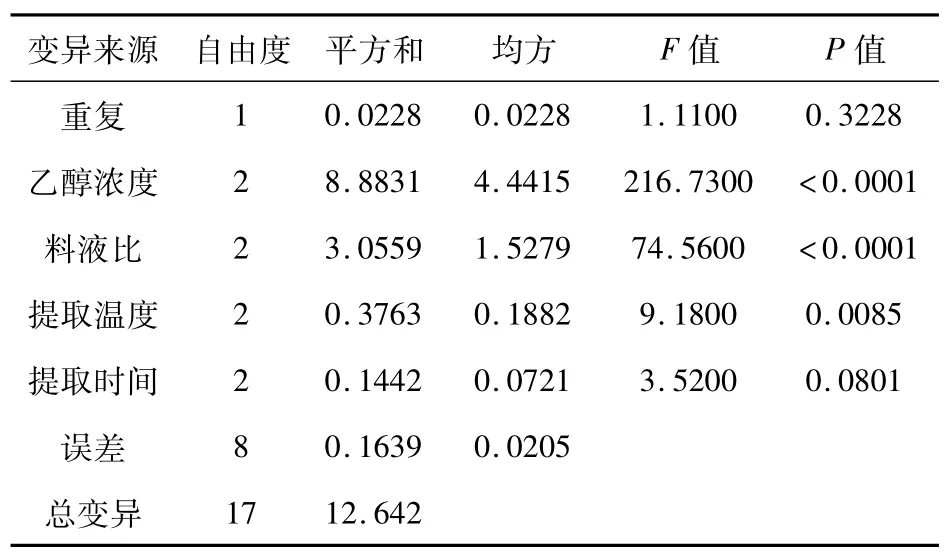
表2 正交试验结果的方差分析Tab2 Analysis of variances for total flavonoids yield
由表1极差分析T值可知,当提取次数为2次时,地木耳总黄酮提取的最优水平组合为乙醇浓度70%、料液比为1∶20、提取温度80℃,提取时间为2.5 h。在此条件下,进行地木耳总黄酮提取验证试验,3次重复,其总黄酮平均得率为6.84 mg/g。
2.7 地木耳总黄酮对常见微生物的抑菌活性 由验证试验所得黄酮得率为6.84 mg/g,地木耳黄酮提取液浓度为 100%、50%、25%、12.5%、6.25和0%所对应的实际黄酮含量分别为0.342 mg/ml、0.171 mg/ml、0.0855 mg/ml、0.04275 mg/ml、0.02138 mg/ml和 0 mg/ml。选取大肠杆菌、金黄色葡萄球菌、黑曲霉和白假丝酵母菌四种日常生活中常见的细菌、霉菌和酵母菌作为试验材料,测试所提取的总黄酮对这些菌种的抑菌效果,其结果见图6。
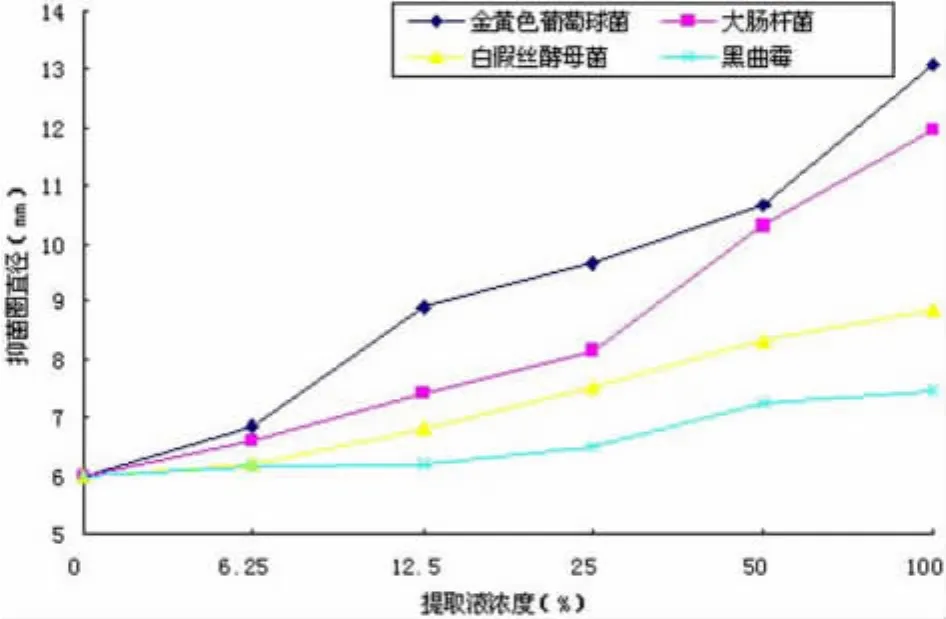
图6 地木耳总黄酮的抑菌作用Fig6 The antimicrobial activities of Nostoc commune flavonoids on certain microorganisms
图6结果表明,地木耳总黄酮对四种微生物均有不同程度的抑制作用,随着总黄酮溶液质量浓度的升高,抑菌圈直径有递增趋势性。其中,地木耳总黄酮对典型的革兰阳性细菌金黄色葡萄球菌抑制作用最强,对革兰阴性细菌抑制作用相对较弱;对酵母菌抑菌活性相对较强,而对产孢子的霉菌抑制能力较弱。可见,地木耳黄酮具有一定的广谱抑菌活性。
3 讨论
黄酮类化合物是广泛存在于植物体内,能够清除人体内自由基,具有抗老化、抗突变、调血脂、降血压、抑菌等药理保健功能,是一类极具开发前景的天然有机抗氧化剂[11-12]。本研究通过单因素试验和正交试验得出了地木耳总黄酮提取的最佳条件,即提取温度为乙醇浓度70%、料液比为1∶20、提取温度80℃,提取时间为2.5 h,提取次数为2次,在此最佳条件下总黄酮得率为6.84 mg/g,这为地木耳黄酮的应用提供了的前提条件。
另外,试验结果表明,地木耳总黄酮对大肠杆菌、金黄色葡萄球菌、黑曲霉和白假丝酵母均有一定的抑制作用,其抑菌效果为金黄色葡萄球菌>大肠杆菌>白假丝酵母>黑曲霉。黄酮类化合物可以通过破坏细胞壁及细胞膜的完整性,导致微生物细胞释放胞内成分,引起膜的电子传递、营养吸收、核苷酸合成及ATP活性等功能障碍,从而抑制微生物的生长[13]。由于真菌的细胞壁厚于细菌的细胞壁,导致黄酮类化合物对两种类型菌的细胞壁和细胞膜损伤程度不同所造成的。从而造成地木耳总黄酮对细菌抑制作用大于真菌。革兰阳性菌与革兰阴性菌的细胞壁组成成分不同,革兰阳性菌肽聚糖层多,革兰阴性菌肽聚糖层数少,黄酮类化合物有可能影响肽聚糖的交联,进而破坏细胞壁形成。也有研究表明[14],抑菌性的差异可能与样品作用于细胞壁和细胞膜系统,或者对酶的抑制、代谢过程的破坏有着密切关系,但具体原因还有待于进一步研究。本文通过地木耳总黄酮的抑菌试验,初步得出了一定的结论,但由于试验选用菌种有限,其试验结果还不够全面,在今后的研究中将利用地木耳总黄酮对大量的微生物进行系统的抑菌试验,并深入探讨其抑菌效果和机制,为新型天然抗菌剂的开发提供依据。
[1]张唐伟,杨乐,柳青海,王启兰,等.地木耳多糖的抗氧化性与抑菌作用[J].食品与生物技术学报,2011,30(6):868-873.
[2]牛生洋,郝峰鸽,赵瑞香,等.地皮菜中多糖的抑菌特性研究[J].广东农业科学,2011,(9):93-94.
[3]JAKI B,ORJALA J,HEILMANN J.New antibacterial metabolites from the CyanobacteriumNostoc commune[J].Journal of Natural Products,2000,63(9):1283-12850.
[4]鄢贵龙,纪丽莲,韩铭海,等.地皮菜营养成分分析与评价[J].营业学报,2010,32(1):97-98.
[5]PLOUTNO A,CARMELI S.Modified peptides from a water bloom of the cyanobacterium Nostoc sp[J].Tetrahedron,2002,58(50):9949-9957.
[6]GOLAKOTI T,YOSHIDA W Y,CHAGANTY S,MOORE R E.Isolation and structure determination of nostocyclopeptides A1 and A2 from the cyanobacterium Nostoc sp.ATCC53789 [J].JNat Prod,2001,64(1):54-59.
[7]张威.地木耳天然活性物质的筛选及活性研究[D].兰州:兰州大学,2007.
[8]孔琪,吴春.菊花黄酮的提取及抗氧化活性研究[J].中草药,2004,35(9):1001-1002.
[9]杨瑞云,管海波,张革,等.当归藤中总黄酮提取工艺研究[J].食品工业科技,2011,32(4):217-219.
[10]郭娇娇,罗佳,宫智勇.桂花中总黄酮提取工艺及其抗氧化活性的研究[J].武汉工业学院学报,2011,3(1):5-7.
[11]KANWAL Q,HUSSAIN I,SIDDIQUIH L,et al.Flavonoids from mango leaves with antibacterial activity[J].J Serb Chem Soc,2009,74(12):1389-1399.
[12]常丽新,贾长红,高曼,等.丁香叶黄酮的抑菌作用[J].食品工业科技,2010,31(10):126-128.
[13]玄红专,胡福良.黄酮类化合物抑制微生物活性及其作用机制[J].天然产物研究与开发,2010,22(1):171-175.
[14]史德芳.仙人掌提取物的分离及其抑菌性能的研究[D].广西:广西大学,2006.
