海洋来源真菌中二个聚酮类化合物的NMR研究
2012-05-07李占林裴月湖华会明
刘 涛,李占林,王 宇,田 黎,裴月湖,华会明
(1.中国医科大学药学院,辽宁 沈阳 110001;2.沈阳药科大学 创新药物研究与设计教育部重点实验室,辽宁 沈阳 110016;3.国家海洋局第一海洋研究所,山东 青岛 266061;4.青岛科技大学,山东 青岛 266042)
海洋微生物资源丰富,独特的代谢和生理特性使其能够产生化学结构特殊的次级代谢产物,特别是其中结构新颖、具有抗肿瘤作用的代谢产物越来越受到国内外科研工作者的重视[1,2]。为了寻找新的抗癌活性物质,作者对海洋来源真菌Penicilliumsacculum的次级代谢产物进行了研究,从中分离得到2个聚酮类化合物Griseophenone B(Ⅰ)和Griseophenone C(Ⅱ),文献中只有化合物Ⅰ的1HNMR数据报道。作者应用1D NMR和2D NMR(HSQC,HMBC)等技术确定了2个化合物的结构,并利用2D NMR技术对其核磁共振信号进行了归属。
1 实验
1.1 仪器与测试条件
核磁共振一维和二维谱分别用瑞士Bruker ARX-300型及Bruker AVANCE-600型核磁共振仪测定。测试条件:溶剂为CDCl3,内标为TMS(四甲基硅烷),室温下测定。2D NMR(HSQC,HMBC)采用标准脉冲程序,HSQC采样数矩阵1024×256,选取C-H键偶合常数JCH=140 Hz以获取碳氢直接相关峰;HMBC采样数矩阵2048×209,选取JCH=145 Hz、C-H远程偶合常数nJCH=5 Hz以获取碳氢远程相关峰。
1.2 菌株鉴定与发酵
实验菌株于2004年8月分离自东营潮间带盐生植物滨藜(Atiriplexsp.),由国家海洋局第一海洋研究所、青岛科技大学田黎教授鉴定为真菌(Penicilliumsacculum)。菌株编号:HTTM-Z04003,存放于国家海洋局第一海洋研究所药用海洋微生物菌种资源库。
发酵培养基及条件:马铃薯浸汁200 mL,蛋白胨2 g,酵母粉1 g,葡萄糖15 g,陈海水1000 mL。24 ℃、150 r·min-1下振荡培养17 d,发酵量75 L。
1.3 提取分离
将海洋来源Penicilliumsacculum的75 L发酵液过滤,得滤液65 L,减压浓缩至6 L,分别用等体积的乙酸乙酯萃取3次,回收溶剂,得浸膏93.5 g。经硅胶柱色谱,用氯仿-甲醇(100∶0~0∶100)进行梯度洗脱,得到141个流分(500 mL/流分)。第6~7流分合并,经Sephadex LH-20柱色谱,用氯仿-甲醇(1∶1)进行洗脱,第13~14亚流分,经硅胶柱色谱,用石油醚-丙酮(15∶1~2∶1)梯度洗脱,经重结晶及HPLC,得到化合物Ⅰ(4 mg)和化合物Ⅱ(3 mg)。
1.4 分析测试
对化合物(Ⅰ)、化合物(Ⅱ)分别进行定性分析和质谱检测。
取化合物Ⅰ(4 mg)、化合物Ⅱ(3 mg)分别溶于0.5 mL氘代试剂CDCl3中进行NMR测定。
2 结果与讨论
2.1 化合物Ⅰ的结构解析
黄白色无定形粉末,UV 254 nm下有很淡的暗斑,10%硫酸乙醇显淡黄色,硫酸乙醇显色后,UV 365 nm下荧光为黄绿色。HRESI-MS,m/z:337.0483[M-H]-,推测分子量为338,确定分子式为C16H15O6Cl,不饱和度为9。
1HNMR(300 MHz,CDCl3)给出δ6.36(2H,br s),在HSQC谱中与δC97.6、110.1存在相关,由经验可知该信号为2个芳氢(或烯氢)信号。同理,由HSQC谱中δH6.14和δC93.1相关,可知δH6.14为1个芳氢(或烯氢)信号。1HNMR(300 MHz,CDCl3)给出2个甲氧基的质子信号δ3.71(3H,s)、3.93(3H,s)和1个甲基信号δ2.16(3H,s)。13CNMR(150 MHz,CDCl3)给出2个甲氧基信号δC56.6、56.1和1个甲基信号δC19.1(由HSQC相关信号推断),此外,δC198.3根据经验推测为酮羰基的碳信号,然后根据分子式给出16个碳,分子中应该还有12个碳信号(而图谱中只给出11个sp2杂化碳信号,δC163.8的碳信号并未观察到,而是通过与δH6.14远程相关推断出的)。该化合物的不饱和度u=9(δC198.3 C=O为1个不饱和度),因此剩下的12个碳信号应该满足8个不饱和度,故推测分子中含有2个苯环结构。根据分子式C16H15O6Cl和已确定的原子数,还余下3个O和3个H,推测结构中存在3个羟基。
化合物Ⅰ的HMBC谱见图1、主要的HMBC相关见图2。
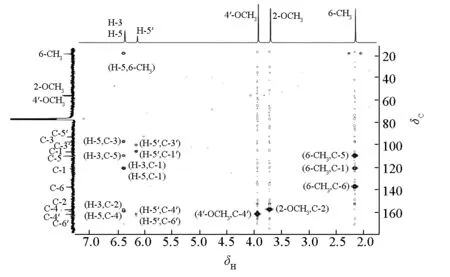
图1 化合物Ⅰ的HMBC谱
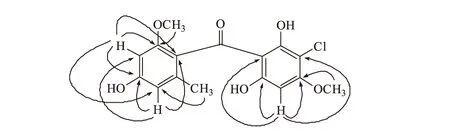
图2 化合物Ⅰ主要的HMBC相关
HMBC谱(图1、图2)显示CH3(δ2.16,s)与C-5(δ110.1)相关,表明CH3取代在苯环上C-5的邻位。根据HSQC谱中C-5(δ110.1)/δH6.36的交叉峰,可归属H-5(δ6.36)信号。HMBC谱中H-5(δ6.36,br s)和C-3(δ97.6)有远程相关,再根据HSQC谱中C-3(δ97.6)/δH6.36的交叉峰,可归属H-3(δ6.36)信号,而HMBC谱中H-3(δ6.36,br s)与C-5(δ110.1)有远程相关,并结合氢信号的裂分情况,推断H-3和H-5处于苯环的间位。根据H-3和H-5、C-3和C-5的信号处于较高场,推断其邻位应为含氧取代。2-OCH3(δ3.71,s)与C-2(δ157.9)有远程相关,H-3(δ6.36,br s)与C-2(δ157.9)有远程相关,证明2-OCH3为H-3邻位的1个含氧取代基,表明该OCH3位于C-2位,则C-4位为羟基取代。因此,剩下的2个OH、1个OCH3、1个Cl及1个芳氢信号均在另一个苯环上取代。根据δH6.14处于较高场,推断其邻位均为含氧取代。H-5′(δ6.14,br s)与C-4′(δ162.1)、C-6′(δ163.8)有远程相关,而与第3个含氧碳不存在远程相关,4′-OCH3与C-4′有远程相关,证明H-5′处于OH和OCH3的邻位,而处于另一个OH的对位。氯原子取代在3′位,可根据取代基对苯环碳信号的影响情况计算而确定[3]。至此,还剩下1个羰基,2个苯环也都剩下1个取代位置,因此确定是两个苯环由羰基连接的结构。综合以上推导,并结合文献[4~6]确定化合物Ⅰ为Griseophenone B,结构见图3。
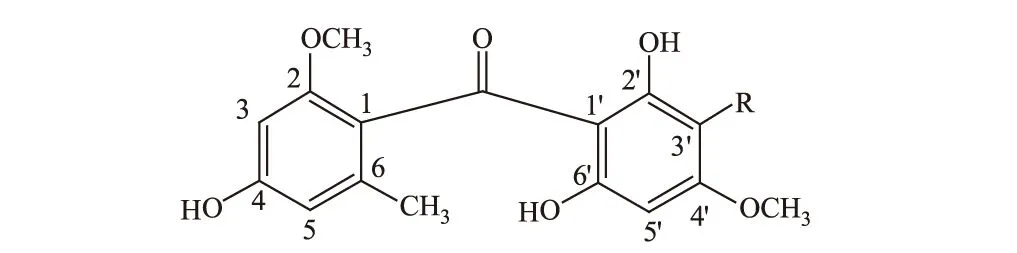
化合物Ⅰ.R=Cl 化合物Ⅱ.R=H
2.2 化合物Ⅱ的结构解析
黄褐色无定形物,10%硫酸乙醇显淡黄色,UV 254 nm下有很淡的暗斑,10%硫酸乙醇显色后,UV 365 nm下荧光变为蓝绿色。ESI-MS,m/z:305.2[M+H]+,327.2[M+Na]+,推测分子量为304。
NMR数据和化合物Ⅰ非常接近,主要区别在于该化合物多了一个芳氢信号,结合化合物Ⅰ与化合物Ⅱ的质谱给出的分子量338和304,推测化合物Ⅰ中的氯原子在化合物Ⅱ中被氢取代。1HNMR(300 MHz,CDCl3)中给出δ5.98(2H,br s)信号,13CNMR(300 MHz,CDCl3)中给出δ94.7(C-2)信号,HSQC显示δH5.98与δC94.7相关,推测存在对称苯环结构。根据HMBC相关(图4)可确定A环的取代情况(参照化合物Ⅰ),对比化合物Ⅰ及1D NMR和HSQC给出的对称苯环结构信息,可进一步确定B环的结构。在碳谱中,该化合物只显示出10个芳香碳,和化合物Ⅰ相同,C-2′和C-6′也未给出信号。从结构上分析,可能是由于自身为芳香季碳以及羟基取代和邻位羰基取代等因素影响,使其纵向弛豫时间T1延长,从而使碳信号强度减弱;再者,测试化合物的量较少也影响了碳信号强度。结合文献[4,7]确定化合物Ⅱ为Griseophenone C(图3)。
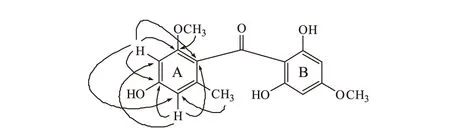
图4 化合物Ⅱ的主要HMBC相关
参照文献[8~10]的方法,通过HSQC、HMBC等2D NMR技术对化合物Ⅰ和化合物Ⅱ的1HNMR和13CNMR信号进行了详细归属,见表1。
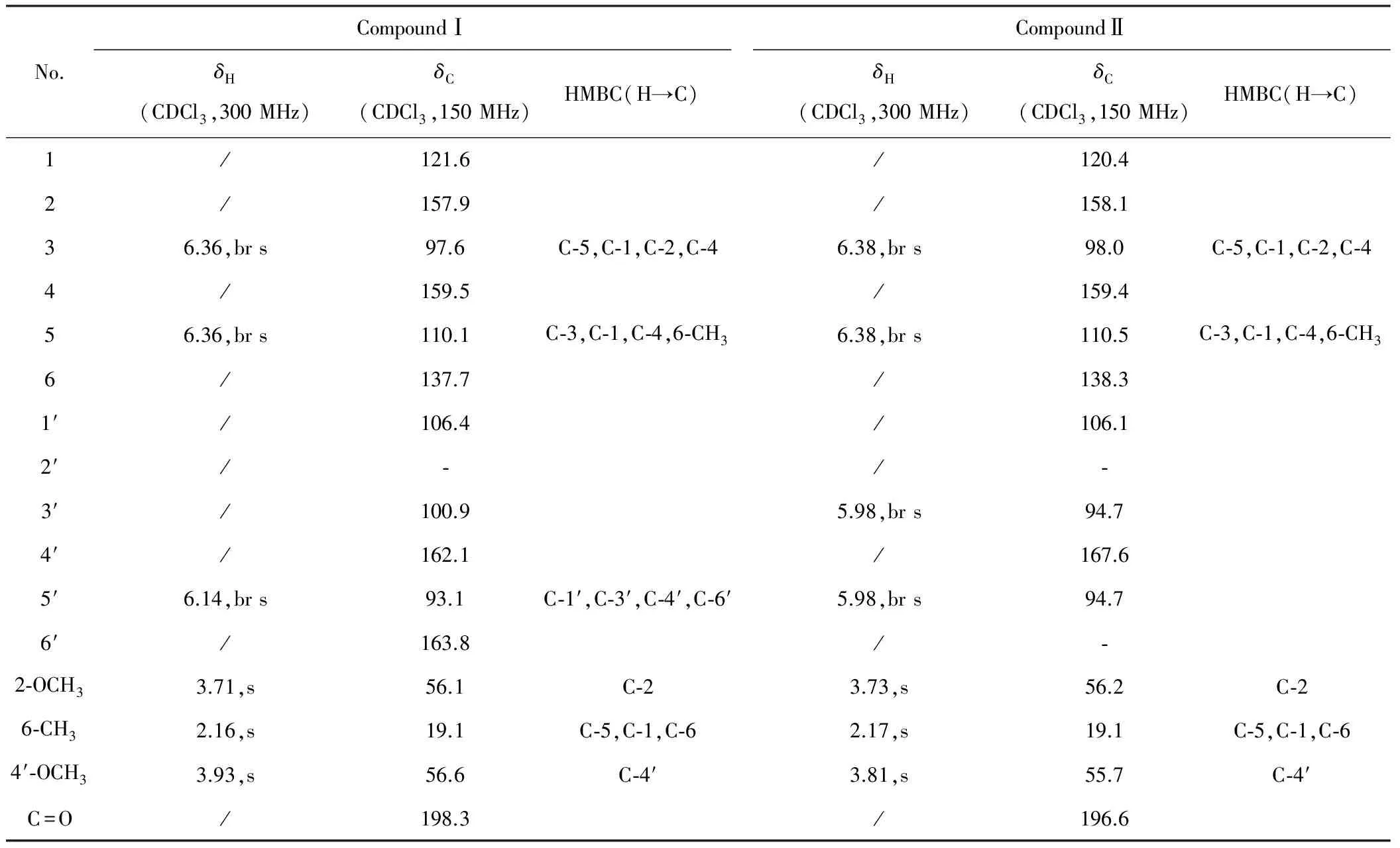
表1 化合物Ⅰ和化合物Ⅱ的NMR数据
3 结论
综合利用1D NMR(1H,13C)和2D NMR(HSQC,HMBC)技术对从海洋来源真菌Penicilliumsacculum发酵液乙酸乙酯提取物中得到的2个聚酮类化合物(Griseophenone B和Griseophenone C)的结构进行了解析,首次报道了化合物Ⅰ的13CNMR数据以及化合物Ⅱ的核磁共振数据,并对核磁共振信号进行了归属。化合物Ⅱ为首次从该种真菌中分离得到。
本研究中的2个化合物由于13CNMR谱均未给出C-2′和C-6′信号,给结构鉴定带来了一定难度。作者通过高分辨质谱,正确判断化合物的分子式后,再应用2D NMR进行解析,确定了化合物的结构。文中化合物的解析过程和数据归属为该类化合物的结构确证提供了参考。
致谢:1D NMR和2D NMR均由沈阳药科大学测试中心李文和沙沂老师测试,在此表示感谢!
参考文献:
[1]田树红,黄惠琴,鲍时翔,等.海洋微生物抗肿瘤天然产物研究进展[J].微生物学通报,2007,34(4):799-803.
[2]林永成,周世宁.海洋微生物及其代谢产物[M].北京:化学工业出版社,2003:1-3.
[3]宁永成.有机化合物结构鉴定与有机波谱学(第二版)[M].北京:科学出版社,2000:113.
[4]Harris C M,Roberson J S,Harris T M.Biosynthesis of griseofulvin[J].J Amer Chem Soc,1976,98(17):5380-5386.
[5]Fujii I,Iijima H,Tsukita S,et al.Purification and properties of dihydrogeodin oxidase fromAspergillusterreus[J].J Biochem,1987,101(1):11-18.
[6]Sato Y,Oda T,Saito H.Deuterium nuclear magnetic resonance studies on biosynthesis:Stereochemistry of the 5′-hydrogen atoms of griseofulvin derived from griseophenone B and 4-demethyldehydrogriseofulvin[J].J Chem Soc,Chem Commun,1978,(3):135-136.
[7]Paterson R R M.Standardized one-and two-dimensional thin-layer chromatographic methods for the identification of secondary metabolites inPenicilliumand other fungi[J].J Chromatogr,1986,368(2):249-264.
[8]吴帅,刘二伟,刘虹,等.川续断中的一个三萜皂苷结构的2D NMR解析[J].波谱学杂志,2010,27(4):661-668.
[9]李宁,张鹏,肖皖,等.间苯三酚化合物——鹤草酚的NMR研究[J].波谱学杂志,2009,26(1):103-110.
[10]杨国春,李占林,李文,等.没药中一呋喃倍半萜的核磁共振研究[J].波谱学杂志,2008,25(4):541-548.
