生姜根际姜瘟病拮抗菌的筛选及鉴定
2012-04-29徐莹莹杜秉海丁延芹王翠翠王璇姚良同
徐莹莹 杜秉海 丁延芹 王翠翠 王璇 姚良同
摘要:从生姜根际土样分离获得了65个细菌分离物和42个放线菌分离物,通过离体拮抗试验,筛选出对姜瘟病有良好拮抗效果的细菌一株,放线菌两株,编号分别为H16-8、WFl和JW02-6。通过形态学观察、生理生化测定以及16S rDNA序列分析,初步确定:H16-8为短短芽孢杆菌(Brevibacillus brevis),WF1为弗雷德氏链霉菌(Streptomyces fradiae),JW02-6为劳伦链霉菌(Streptomyces laurentii)。H16-8、WFl和JW02-6的16SrDNA序列的GenBank登录号分别为:EU812754,FJ972686和FJ972687。
关键词:生姜根际;姜瘟病;拮抗菌;筛选;鉴定
中图分类号:S476+.1文献标识号:A文章编号:1001-4942(2012)01-0079-05
姜瘟病主要是由青枯假单胞菌(Pseudomonassolanacearum)引起的。每年6~8月是该病发生和流行的高峰时期,此时北方正值高温高湿天气,是姜块形成膨大旺盛期,病菌易侵入,侵染速度快,严重的可在半月左右造成全田无收,成为制约生姜优质高产的毁灭性病害之一。筛选抗病品种、施用化学农药等措施可防治姜瘟病的发生,但是轮作和筛选抗病品种周期长,使用化学农药不仅不能从根本上防治病原菌,又带来了环境污染。而生物防治既可限制病原菌青枯假单胞菌的生长,又增加了根际有益微生物的数量和抑菌物质的含量,是一种行之有效的方法。目前,虽然已有一些可防治姜瘟病的菌种被发现,但是大多存在着难以在生姜根际长期定殖的问题。
本研究讨论的拮抗菌分离自生姜根际土壤,有利于其在根际的定殖,此外,拮抗菌的应用还可以有效地促进植株的生长。从山东莱芜采集发病区生姜根际土壤样品,筛选到对姜瘟病具有很好生防应用潜力的细菌1株,放线菌2株,其中H16-8被鉴定为短短芽孢杆菌(Brevibacillus brevis),WF1被鉴定为弗雷德氏链霉菌(Streptomyces fra-diae),JW02-6被鉴定为劳伦链霉菌(Streptomy-ces laurentii)。
1.材料与方法
1.1材料
生姜根际土壤样品:采集自山东省莱芜市。
供试病原菌:姜瘟病病原菌——青枯假单胞菌(Pseudomonas solanacearum),由山东省莱芜市农业科学研究院提供。
培养基:牛肉膏蛋白胨培养基,高氏一号培养基,马铃薯蔗糖培养基,细菌及放线菌菌种鉴定培养基参见文献[12,13]。
试剂:分子生物学试剂购于宝生物工程(大连)有限公司,DNA小量快速纯化试剂盒(3S SpinAgarose Gel DNA purification Kit)购于上海申能博彩生物科技有限公司。
1.2拮抗菌的筛选
分别采用细菌和放线菌培养所需的不同培养基,通过梯度稀释法,从生姜根际土样中分别获得细菌和放线菌分离物。采用稀释涂布平板法,即取100μl经12h培养的病原菌菌液涂布于拮抗筛选培养基平板上,再将待试菌接种于培养基上,37℃培养24-48h,通过观察抑菌圈的有无及大小进行拮抗活性检测,筛选出对姜瘟病病原菌具拮抗活性的细菌和放线菌,分别记录其编号,并转接到相应分离培养基斜面上保存。
1.3菌种鉴定
形态学特征、生理生化特性检测及16SrDNA序列的扩增方法见参考文献[13,14]。
1.4DNA提取和PCR反应
具体方法参阅文献[15,16],用相应的液体培养基接种拮抗菌,培养24h,收集菌液提取总DNA。
PCR反应体系为:Taq DNA聚合酶0.5μl,10×Buffer(Mg2+)2.5μl,dNTP(10mmol/L)0.5μl,引物1μl,模板1μl,ddH2O补足至25μl。
反应条件:95℃5min;94℃1min;56℃1min,72℃1.5min,30个循环;72℃延伸10min。
用3S柱离心式琼脂糖DNA小量,陕速纯化试剂盒(3S spin Agarose Gel DNA purification kit)纯化PCR产物。
1.5 16S rDNA序列测定及分析
16S rDNA的测序工作由南京金斯瑞生物科技有限公司完成,序列相似性分析通过NCBI的BLAST程序比对(http://www.ncbi.nlm.nih.gov/BLAST/),利用MEGA4.0软件进行系统发育分析,采用Neighbor-Joining算法和Jukes-Cantor模型构建系统发育树。自展次数设定为1000,自展检验结果低于50的数值不显示在图上。
2.结果与分析
2.1拮抗菌的筛选
通过梯度稀释法从生姜根际土壤样品中筛选出65个细菌分离物和42个放线茵分离物。经过初筛及复筛,获得拮抗效果良好且稳定的细菌1株,编号为H16-8;放线菌2株,编号为WF1和JW02-6。
从图1中可以看出,H16-8、WF1和JW02-6都对Pseudomonas solanacearum具有较好的拮抗效果。
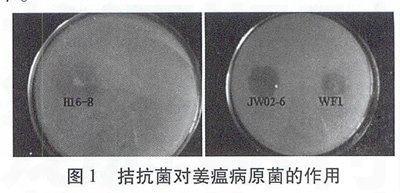
2.2形态学特征
H16-8的菌体大小为(0.50~0.55)μm×(1.10~1.20)μm,G+,短杆状,产芽孢且孢囊膨大,在LB平板上培养24h后,菌落为微黄色,粘稠厚重,不透明,表面湿润光滑,边缘较规则。WF1孢子丝直或柔曲,孢子卵圆形或不规则圆形,表面光滑;JW02-6孢子丝直、弯曲,孢子卵圆形,表面光滑(图2)。

2.3生理生化特性
菌株H16-8在牛肉膏蛋白胨和LB培养基上生长均形成微黄色不透明菌落,而在马铃薯蔗糖培养基上生长则形成乳白色粘稠不透明菌落;WF1和JW02-6的培养特性见表1。

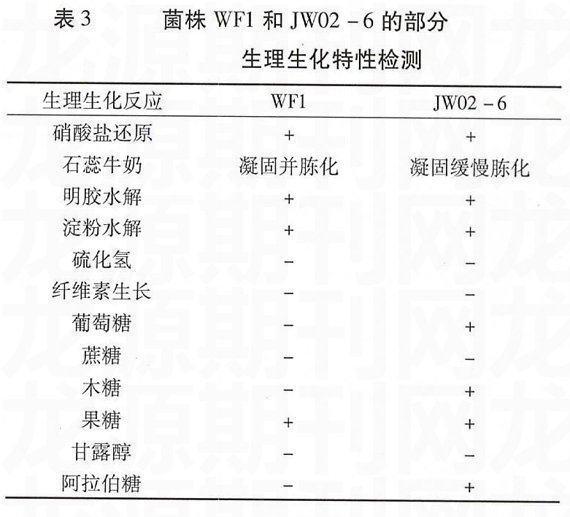
H16-8、WF1和JW02-6的主要生理生化特性见表2和表3。其中,细菌菌株H16-8与其模式种在大多数生理生化指标上具有相同的特征,但在pH5.5及50℃条件下的生长情况与模式菌株性状不符,说明H16-8更耐酸、耐热。根据放线菌的分类和鉴定,WF1和JW02-6具有典型的链霉菌属特征。其中,WF1与链霉菌属弗雷德氏链霉菌的生物学特性相似,如弗雷德氏链霉菌可水解淀粉,使明胶液化和牛奶胨化,分解纤维素,硝酸盐还原力强,不产生H2S,但WF1不能分解纤维素,且两者的碳源代谢不完全一致,弗雷德氏链霉菌可利用葡萄糖、果糖和蔗糖,而WF1仅能利用果糖。链霉菌属劳伦链霉菌可水解淀粉,使明胶液化,可利用阿拉伯糖、果糖和甘露醇,而JW02-6能利用葡萄糖和木糖,不能利用甘露醇。筛选菌株与模式菌株之间的这些不同性状,可能是菌株间确实存在差异,也可能是由菌株不
同生长环境造成的。
2.4 16S rDNA序列分析
PCR产物经1%琼脂糖凝胶电泳,凝胶成像,如图3所示。
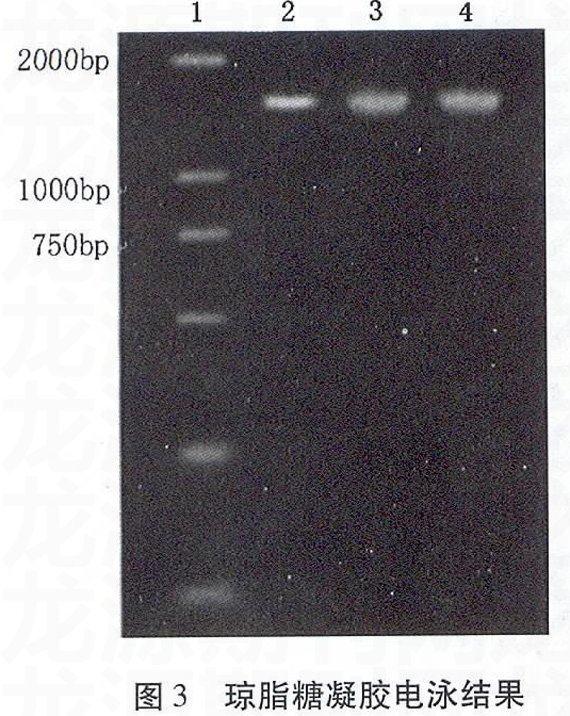
经测序分析,由菌株H16-8、WF1和JW02-6总DNA扩增的16S rDNA序列长分别为:1413bp,1406bp和1400bp,将得到的序列提交GenBank获得注册号:EU812754、FJ972686和FJ972687。
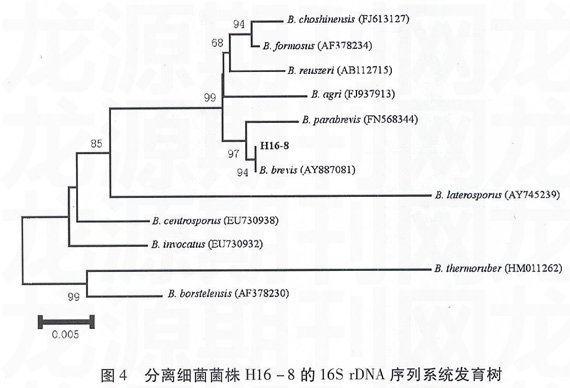
如图4所示,H16-8位于系统发育树中短芽孢杆菌属(Brevibacillus)分支中,与Brevibacillusbrevis(AY887081)有较近的亲缘关系。图5则显示菌株WF1和JW02-6都位于链霉菌属(Strep-tomyces)分支中,分别与Streptomyces fradiae(AB184068)和Streptomyces laurentii(AB184669)有较近的亲缘关系。
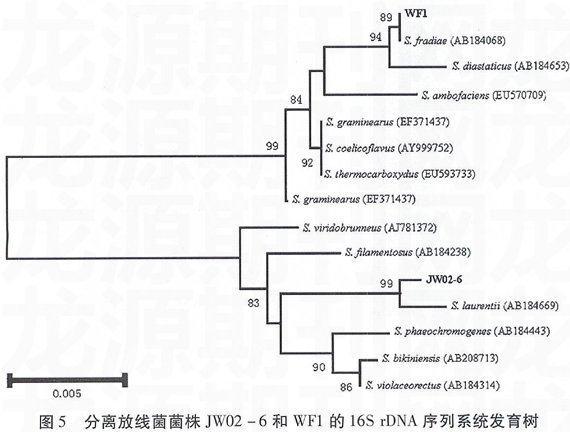
通过对其形态学、培养性状及生理生化反应结果进行分析,可以初步判定拮抗细菌H16-8为短短芽孢杆菌(Brevibacillus brevis),拮抗放线菌WF1为弗雷德氏链霉菌(Streptomyces fradiae),JW02-6为劳伦链霉菌(Streptomyces laurentii)。
3.讨论与结论
生物防治可作为解决土传病害的一条有希望的途径。利用拮抗菌防治植物病害已被认识和广泛应用,从自然界寻找和筛选新的生防菌对生物防治具有重大意义。因此,利用拮抗菌防治姜瘟病具有广阔的应用前景。
但一些实验室表现良好的生防菌株在进行田间试验时,出现拮抗效果不稳定的现象,这主要与生防菌在作物根际的定殖能力、竞争作用及外界环境影响等因素有关。生防细菌防病效果取决于它在适当的时间定殖于适当的位置,并产生适量的抗菌物质,不同环境条件下生防细菌产生的抗菌物质的量不同。本试验从微生物生态学角度出发,从生姜根际筛选得到了具有较好应用潜力的3个拮抗菌菌种资源短短芽孢杆菌H16-8,弗雷德氏链霉菌WF1和劳伦链霉菌JW02-6。目前关于植物细菌性青枯病的生物防治,国内外研究工作很多,但针对姜瘟病的研究则较少。同时,链霉菌可产生众多次生代谢产物,已经成为重要的生防菌种而被广泛研究。而本实验也证明了两株分别属于弗雷德氏链霉菌和劳伦链霉菌的放线菌菌株对部分致病菌具有拮抗能力。
利用这些具有生防能力的菌株产生的次生代谢产物制备生物农药,具有无污染、不易使有害生物产生抗药性等特点。因此,本实验所获得拮抗菌可作为进一步研究姜瘟病拮抗菌拮抗机制的实验材料,深入探讨其生防机制及应用前景,促进高效低毒农药的开发利用。
参考文献:
[1]刘达,杨寅贵,刘德力.生姜腐烂病的发生及其防治研究[J].江西农业大学学报,1991,13(2):154-157.
[2]任欣正,韦刚,齐秋锁,等.同寄主植物青枯菌菌株的比较研究[J].植物病理学报,1981,11(4):1-8.
[3]张广民,范国强,朱汉城,等.山东姜瘟病病原菌的研究[J].山东农业大学学报(自然科学版),2001,32(4):418-422.
[4]张成玲,赵永强,于晓庆,等.姜瘟病菌拮抗放线菌的筛选与鉴定[J].植物病理学报,2008,38(4):414-419.
[5]任清盛,于广霞.山东省生姜姜瘟病发病规律及综合防治技术[J].西北园艺,2003,9:39-40.
[6]李路军,李世国,李娜,等.姜瘟病致病菌的研究进展[J].山东农业科学,2009,7:95-99.
[7]王芬.生姜姜瘟病无公害综合防治技术[J].山东农业科学,20lO,8:108-109.
[8]刘铭,张敏,戢俊臣.中国姜瘟病的研究进展[J].中国农学通报,2005,21(6):337-340.
[9]杨合同,庞定远,任欣正,等.姜瘟病生物防治试验初报[J].山东科学,1990,3(4):42-46.
[10]孙彩云,潘军,陈秀兰,等.抑制姜瘟青枯假单孢菌的术霉菌株的筛选及其抑菌机理[J].山东大学学报,2002,37(4):373-376.
[11]史秀娟,王学海,刘振伟,等.姜防病增产菌的初步筛选试验[J].山东农业科学,2005,3:47-49.
[12]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999,241-249.
[13]阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992.650-692.
[14]东秀珠,蔡妙英.常见系统细菌学鉴定手册[M].北京:科学出版社,2001,162-171.
[15]Ausubel F M,Brent R,Kingston R E.Short protocols in mo-lecular biology[M].John Wiley &Sons,Inc,1995,36-40.
[16]姜淑梅,张龙,戴世鲲,等.一种简单的有效的适于PcR操作的放线菌DNA提取方法[J].生物技术,2007,17(1):39-41.
[17]郭坚华,孙平华,吴云波,等.植物细菌性青枯菌的生物防治机制和途径[J].中国生物防治,1997,13(1):42-46.
[18]王光亮,于金友,石玉萍,等.植物病害生物防治研究进展[J].山东农业科学,2004,4:75-77.
[19]陆宁,张永春.堆肥中烟草黑胫病拮抗放线菌的筛选[J].现代农业科学,2008,15(1):17-23.
[20]刘铭,张敏,尹福强,等.用抑菌圈-定殖力双重测定法筛选姜瘟病的生防细菌研究[J].中国农学通报,2005,21(4):266-269.
[21]郭坚华,郭亚辉,张立新,等.辣椒青枯病拮抗菌株的筛选及田间防效的测定[J].中国生物防治,2001,17(3):101-106.
[22]周洪友,魏海雷,刘西莉,等.通过染色体整合抗生素2,4-二乙酰基间苯三酚合成基因提高荧光假单胞菌生防能力[J].科学通报,2005,50(8):766-771.
[23]周洪友,杨静,宋娟.荧光假单胞工程菌株对甜瓜细菌性果斑病的生物防治[J].中国植保导刊,2009,29(1):9-12.
[24]李璐宁,张薇,赵永强,等.放线菌Y23菌株发酵液抗菌活性及稳定性测定[J].山东农业科学,2009,1:71-74.
[25]陈志谊,许志刚,高泰东,等.水稻纹枯病拮抗细菌的评价与利用[J].中国水稻科学,2000,14(2):98-102.[26]Cook R J.Making greater use of introduced microorganisms forbiological control of plant pathogens[J].Annual Review ofPhytopathology,1993,31:53-80.
[27]霍沁建,张深,王若焱.烟草青枯病研究进展[J].中国农学通报,2007,23(8):364-368.
[28]汪学军,闵长莉,陈代杰.一株产抗菌物质链霉菌的筛选及鉴定[J].华东师范大学学报,2010,2:134-140.
[29]曹广丽,陈立梅,徐文静,等.番茄叶霉病拈抗链霉菌BPS2的筛选及鉴定[J].东北农业大学学报,2007,38(3):343-347.
