木黄酮靶向抑制MKN-45胃癌细胞Notch1蛋白表达及对增殖和凋亡的影响
2012-04-27陕西省镇安县医院镇安711500胡应秀
陕西省镇安县医院(镇安711500) 柯 俊 胡应秀 王 康
Notch信号通路是重要的发育分化通路之一[1],参与细胞分化、增殖和凋亡过程。最新研究显示Notch信号通路也参与肺癌、胰腺癌、基底细胞癌等肿瘤演进过程[2]。胃癌细胞和组织中都高表达Notch1蛋白[3],提示Notch1蛋白可能在胃癌发生发展中扮演重要角色。本研究使用Notch1蛋白特异性抑制剂木黄酮干预胃癌细胞MKN-45,探讨Notch1在胃癌细胞增殖和凋亡中的作用。
材料与方法
1 材 料 人胃癌细胞株MKN-45细胞购自中科院上海生命研究所。DMEM培养基,胎牛血清(FBS)购自杭州四季青公司。四甲基偶氮唑盐(MTT),二甲基亚砜(DMSO)均购自美国Sigma公司。兔抗人Notch 1多克隆抗体,鼠抗人β-actin单克隆抗体,HRP标记山羊抗鼠IgG、山羊抗兔IgG二抗均购自Santa Cruz公司。Annexin V-FITC/PI荧光双标试剂盒购自深圳生物元公司。PCR Mix购自西安润德公司,PCR引物合成于上海生工公司。木黄酮(Genistein)购自Calbiochem公司,并以DMSO溶解配制成100mmol/L浓度保存于-20℃备用。对照组细胞使用相应浓度DMSO处理。
2 细胞培养与干预 人原发性胃癌细胞株MKN-45于含10%胎牛血清的DMEM 培养液中,37℃,5%CO2培养,2~3d用0.25%胰酶消化传代。取对数生长期的细胞进行试验。分组:等浓度DMSO溶剂对照(正常对照)组、10μmol/L木黄酮(10μM 木黄酮)组、30μmol/L 木 黄 酮 (30μM 木 黄 酮)组 和50μmol/L木黄酮(50μM 木黄酮)组。
3 MTT法细胞增殖实验 取对数生长期的MKN-45细胞,制成悬液,以每孔5×104个细胞接种于96孔培养板,每孔培养液为200μl。每组设4个复孔,37℃、5%CO2细胞培养箱中培养。12h后换加无血清DMEM培养液200μl继续培养12h,使细胞周期同步化,然后换加含10%血清培养液,分别再培养12h、24h、36h、48h、60h、72h后终止培养,在避光条件下加5mg/ml MTT溶液20μl/孔,孵育4h,弃上清液,避光条件下加DMSO 150μl/孔,置酶标仪上振荡10min。以空白孔调零,测各孔490nm吸光度(OD)值。试验重复3次。
4 流式细胞术检测细胞凋亡 分组干预细胞,到达预订时间点后,PBS冲洗1次,常规消化,1500rpm离心5min,弃去上清,用PBS再洗涤1次,1500rpm离心5min后弃去上清,加入500μl的1×Binding Buffer后加入5μl Annexin V-FITC,再加入10μl PI,轻轻混匀。室温下,避光反应5~15min。1h后进行流式细胞术测定。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FITC-/PI-);右上象限是非活细胞,即坏死细胞,为(FITC+/PI+);而右下象限为凋亡细胞,显现(FITC+/PI-)。
5 Westen blot检测蛋白表达 选择生长良好的细胞1×107个,蛋白裂解液裂解细胞,提取细胞总蛋白。BCA法测定蛋白浓度。SDS-PAGE凝胶电泳,转膜至PVDF膜。5%脱脂牛奶室温封闭1h。加一抗稀释液4℃孵育过夜。TBST缓冲液洗膜后加入二抗稀释液室温孵育1h。ECL化学发光,暗室显影。
6 PCR检测mRNA转录 用Trizol法提取各组细胞总RNA。取5μg按反转录试剂盒说明反转录为cDNA。以cDNA为模板PCR扩增Bcl-2,Bax,以GAPDH为内参照。各目的基因引物序列如下:Bcl-2:5’-GGA TTG TGG CCT TCT TTG AG-3’,5’-CCA AAC TGA GCA GAG TCT TC-3’(扩增片段 234 bp);Bax:5’-TCC ACC AAG AAG CTG AGC GAG-3’,5’-GTC CAG CCC ATG ATG GTT CT-3’(扩增片段 257bp);GAPDH:5’-GTA AAG ACC TCT ATG CCA TCA-3’,5’-GGA CTC ATC GTA CTC CTG CT3-3’(扩增片段452bp)。PCR反应条件:94℃30s,60℃30s,72℃30s共35个循环。PCR产物进行2%琼脂糖凝胶电泳,紫外凝胶成像系统观察电泳结果并拍照。用Quantity One软件对照片进行灰度值扫描,以目的条带与其相应内参GAPDH的光密度比代表目的基因mRNA的相对水平。每一时间点上述实验重复3次以上。
7 统计学处理 以均数±标准差表示,应用SPSS15.0软件处理数据,应用单因素方差分析,其中多组资料两两比较采用LSD多重检验,P<0.05认为差异有统计学意义。
结 果
1 木黄酮干预对MKN-45细胞增殖的抑制作用见图1。MTT结果显示,木黄酮干预明显抑制MKN-45细胞的增殖。在12、24、36、48、60、72h,正常对照组的OD值分别为0.366±0.026、0.482±0.011、0.648±0.029、0.859±0.043、1.117±0.017、1.483±0.057,10μM 木黄酮组的 OD 值分别为0.364±0.013、0.458±0.052、0.634±0.046、0.798±0.028、0.978±0.034、1.359±0.058,30μM 木黄酮组的 OD值分别为0.364±0.022、0.381±0.005、0.460±0.037、0.576±0.029、0.81±0.087、0.827±0.036,50μM 木黄酮组的OD值分别为0.330±0.016、0.318±0.014、0.434±0.031、0.479±0.027、0.71±0.087、0.727±0.092。自36h开始,30μM木黄酮组和50μM木黄酮MKN-45细胞增殖率与正常对照组(P<0.05)或10μM木黄酮组(P<0.05)相比,差异均有显著性意义。

图1 木黄酮干预对MKN-45细胞增殖的抑制作用
2 木黄酮干预对MKN-45细胞Notch1蛋白表达的抑制作用 见图2。木黄酮干预MKN-45细胞48h,经 Western blot法检测发现(图2A):与正常对照组(1.06±0.06)相比,30μM 木黄酮组(0.50±0.02)和50μM 木黄酮组(0.24±0.04)细胞 Notch 1蛋白的表达水平均明显降低(P<0.05);而10μM木黄酮组(0.95±0.06)和正常对照组之间 Notch1蛋白的表达水平无明显差异。

图2 木黄酮干预对MKN-45细胞Notch1蛋白表达的抑制作用
3 木黄酮干预对MKN-45细胞凋亡的促进作用见图3。不同浓度木黄酮干预细胞48h,通过Annexin V-FITC/PI荧光双标流式细胞术检测各组细胞的凋亡状况。结果(图3A)发现,正常对照组、10μM木黄酮组、30μM木黄酮组和50μM木黄酮组凋亡细胞数分别为3.13±0.78,3.82±0.99,7.96±10.90和13.49±0.82,4组间差异具有统计学意义(P<0.05)。与正常对照组或10μM木黄酮相比,30μM木黄酮和50μM木黄酮组 MKN-45细胞凋亡细胞数明显上调(P<0.05)(图3B)。

图3 木黄酮干预对MKN-45细胞凋亡的促进作用
4 木黄酮干预对 MKN-45细胞Bcl-2和Bax mRNA表达的抑制作用 见图4。木黄酮干预MKN-45细胞48h,通过RT-PCR法检测各组细胞的Bcl-2和Bax mRNA表达水平(图4A)。结果显示:30μM木黄酮和50μM木黄酮组 MKN-45的Bcl-2mRNA的相对表达强度与正常对照组(P<0.05)或10μM木黄酮组(P<0.05)相比明显下调,差异具有显著性意义;同时,Bax-2mRNA的相对表达强度与正常对照组(P<0.05)或10μM 木黄酮组(P<0.05)相比明显上升,差异具有显著性意义(图4B)。
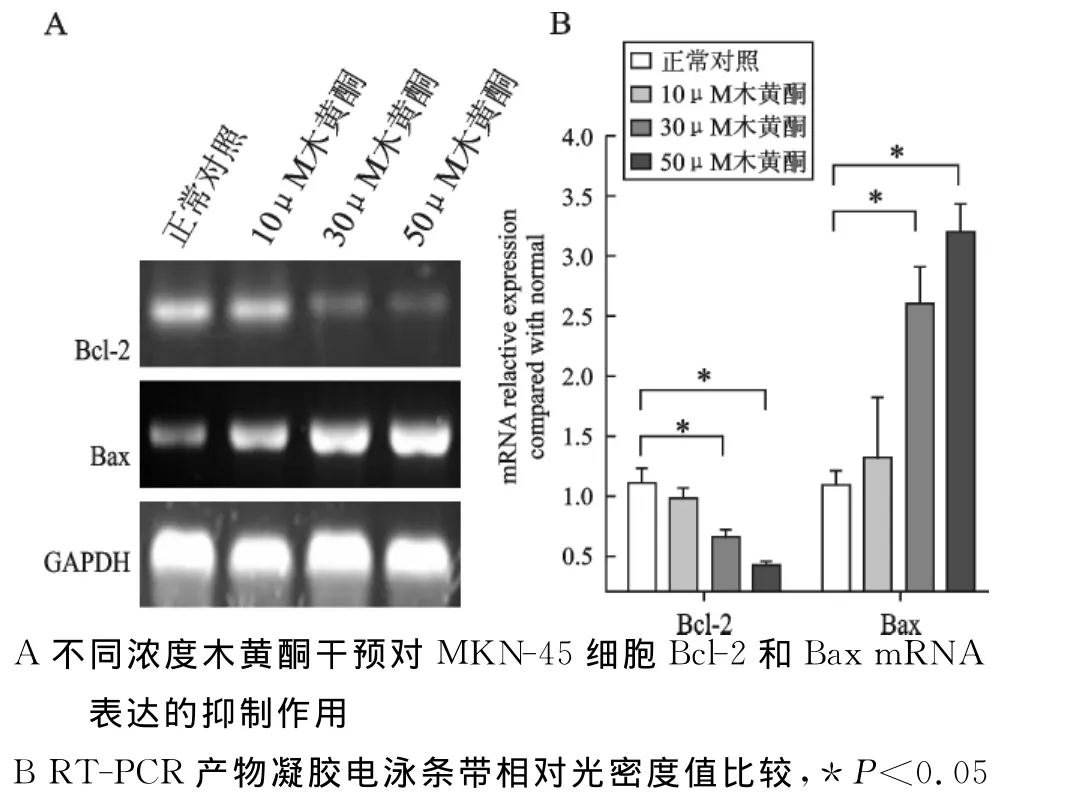
图4 木黄酮干预对MKN-45细胞Bcl-2和Bax mRNA表达的抑制作用
讨 论
Notch信号通路是调控细胞分化、发育的关键性通路。Notch蛋白是一个进化高度保守的跨膜受体蛋白家族。在人体细胞中共发现了Notch1、Notch2、Notch3和Notch4共4个Notch同源体。1991年Ellisen LW在人类T淋巴母细胞白血病中鉴定出Notch1,首次提示了Notch信号通路与肿瘤有关[4]。近年来日渐增多的证据表明Notch1与肿瘤发生密切关联,各种肿瘤中起致癌作用[1]。胰腺癌细胞中Notch1的下调表达明显抑制了癌细胞的生长和促进凋亡[5]。Notch1在不同肿瘤乃至同一肿瘤中不同的、甚至相反的作用,提示阐明Notch信号通路调控机制尚需大量的探索研究。木黄酮是来源于豆类植物的一种小分子黄酮类物质。该物质具有一系列广泛多样的生物活性,对肿瘤、心血管疾病、骨质疏松、糖尿病、皮肤病等疾病的发生有一定的预防和治疗作用,其中最重要的作用是抑制肿瘤发生发展[6]。虽然研究表明异黄酮抗肿瘤的分子机制可能抑制原发肿瘤增殖和凋亡相关蛋白有关[7],但是具体机制尚未完全明了。最新研究显示了木黄酮具有特异性的Notch1蛋白抑制活性,其抑制效果与Notch1蛋白RNA干扰相当[8],显示了具有相当前景的肿瘤治疗潜力。本研究发现通过不同浓度的木黄酮干预人源性胃癌MKN-45细胞,结果提示:与正常对照组相比,30μM 和50μM 异黄酮显著抑制胃癌细胞增殖,其效果和干预时间有关。这与文献报道木黄酮抑制肿瘤细胞的增殖能力的结果相符[9]。研究中,我们选择了木黄酮对 MKN-45细胞增殖发生明显影响的干预48h这个时间点做进一步试验。Western blot结果显示木黄酮能下调Notch 1蛋白表达,其程度和趋势与抑制细胞增殖基本相符,提示其抗增殖作用与抑制Notch 1蛋白表达相关。通过流式细胞术分析,我们发现木黄酮能显著诱导胃癌MKN-45细胞凋亡,其效果与木黄酮浓度和Notch 1蛋白抑制程度存在正向关联。因而我们推测木黄酮通过抑制Notch1后诱导细胞凋亡的可能机制是与Notch1相关的凋亡信号通路活性受到上调。
因此本研究使用RT-PCR检测不同浓度木黄酮干预胃癌MKN-45细胞48h后凋亡相关分子Bcl-2和Bax mRNA的表达。Bcl-2基因是一种原癌基因,它具有抑制凋亡的作用。在细胞凋亡过程中,Bcl-2家族成员起着至关重要的作用[10]。Bcl-2家族可以分为两大类,一类是抗凋亡的,主要有Bcl-2、Bcl-XL、Bcl-W 等,另一类是促细胞死亡的,主要包括Bax、Bak、Bad、Bik、Bid等。Bcl-2是细胞凋亡的负性因子,能保护细胞免于凋亡。Bax是极重要的促细胞凋亡基因,有对抗Bcl-2抑制细胞凋亡的作用。Bcl-2/Bax之间的比例,是决定对细胞凋亡抑制作用强弱的关键因素,Bcl-2>Bax时细胞趋于存活;Bax>Bcl-2时细胞趋于凋亡。我们发现,木黄酮干预胃癌细胞48h时,伴随着Notch1表达受抑和凋亡细胞数上升,其Bcl-2mRNA下调,Bax mRNA上调。结果说明经木黄酮干预胃癌细胞MKN-45抑制Notch l蛋白表达后,通过调节凋亡相关分子Bcl-2和Bax诱导了细胞凋亡。
总之,我们应用木黄酮特异性抑制胃癌细胞MKN-45的Notch l表达,通过抑制Notch通路活性而抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡,由此研究Notch通路在胃癌分子病理机制中的重要作用,并展示了木黄酮作为Notch 1特异性抑制剂在治疗胃癌方面的广泛前景,为胃癌治疗新手段提供理论依据。
[1] Kopan R,Ilagan MX.The canonical Notch signaling path-way:unfolding the activation mechanism[J].Cell,2009,137(2):216-233.
[2] Sekine A,Akiyama Y,Yanagihara K,et al.Hath1up-regulates gastric mucin gene expression in gastric cells[J].Biochem Biophys Res Commun,2006,344(4):1166-1171.
[3] 李大卫,吴 晴,彭志海,等.Notch1和PTEN在胃癌组织中的表达及其意义[J].癌症,2007,26(11):1183-1187.
[4] Ellisen LW,Bird J,West DC,et al.TAN-1,the human homolog of the Drosophila notch gene,is broken by chromosomal translocations in T lymphoblastic neoplasms[J].Cell,1991,66(4):649-661.
[5] Wang Z,Li Y,Kong D,et al.Acquisition of epithelial-mesenchymal transition phenotype of gemcitabine-resistant pancreatic cancer cells is linked with activation of the notch signaling pathway[J].Cancer Res,2009,69(6):2400-2407.
[6] Pavese JM,Farmer RL,Bergan RC.Inhibition of cancer cell invasion and metastasis by genistein[J].Cancer Metastasis Rev,2010,29(3):465-482.
[7] Ferenc P,Solar P,Kleban J,et al.Down-regulation of Bcl-2and Akt induced by combination of photoactivated hypericin and genistein in human breast cancer cells[J].J Photochem Photobiol B,2010,98(1):25-34.
[8] Wang Z,Zhang Y,Li Y,et al.Down-regulation of Notch-1contributes to cell growth inhibition and apoptosis in pancreatic cancer cells[J].Mol Cancer Ther,2006,5(3):483-93.
[9] Ouyang G,Yao L,Ruan K,et al.Genistein induces G2/M cell cycle arrest and apoptosis of human ovarian cancer cells via activation of DNA damage checkpoint pathways[J].Cell Biol Int,2009,33(12):1237-1244.
[10] 田 明,张云锋,杜 宁,等.PTEN和bcl-2在胃癌组织中的表达及临床意义[J].陕西医学杂志,2011,40(2):148-151.
