紫红曲霉液态发酵红曲红色素培养基的优化
2012-04-13李大鹏孙文红高玉荣王宇宁
李大鹏,孙文红,高玉荣,王宇宁
(1.黑龙江八一农垦大学,黑龙江 大庆 163319;2.大庆家良食品有限公司,黑龙江 大庆 163515)
红曲红色素是红曲霉在生长代谢过程中产生的天然红色素,无毒、无副作用,属于蒽醌衍生物,分子式为C22H24O5,溶于乙醇、水,被广泛用于清酒、酱油、腐乳、豆酱、鱼、肉、糕点等食品的着色,安全性高,热稳定性强,对蛋白质的着色性好[1],因此目前红曲和红曲红色素的市场需求量正日益扩大。目前红曲红色素的生产方法有固态发酵和液态发酵2种方法。红曲红色素传统发酵以固态发酵为主,由于液态发酵具有生产周期短,发酵条件容易控制,不容易污染等优点,近年来开始进行液态发酵生产红曲红色素的研究[2-4]。
红曲红色素是一种混合色素,主要包括红色素和黄色素,随着红色素与黄色素比值(色调)的增大,色素颜色逐渐加深呈现红色,因此,色调对红曲红色素的质量也有重要的影响。在前人对红曲红色素生产的研究中,只以红色价为指标,而未考虑色调对红曲红色素质量的影响[2-6]。目前为止,还未见同时以红色价和色调为指标对红曲霉发酵生产红曲红色素进行系统研究的相关报道。因此本文以红色价和色调为指标,对诱变得到的高产菌株紫红曲霉M144液态发酵生产红曲红色素培养基进行了响应面优化,在提高红曲红色素产量的同时也加强了红曲红色素的视觉效果,使红曲红色素产品的质量进一步提高。
1 材料与方法
1.1 菌种
紫红曲霉M144:以红曲霉CICC5017为出发菌株,通过紫外诱变获得的红曲红色素高产菌株,由黑龙江八一农垦大学食品学院微生物实验室保藏[7]。
1.2 培养基
种子培养基:玉米粉5%,豆粕粉2%,K2HPO4·3H2O 0.1%,MgSO4·7H2O 1.5%,pH 5.4,121℃灭菌20min。
基础发酵培养基:玉米粉4%,K2HPO4·3H2O 0.1%,MgSO4·7H2O 1.5%,pH 5.4,121℃灭菌20min。
1.3 实验方法
1.3.1 菌种活化
将紫红曲霉M144斜面菌种接入固体斜面培养基(PDA)中,30℃培养7d~10d。
1.3.2 紫红曲霉M144种子液的制备
取1~2环紫红曲霉M144斜面活化菌种接入液体种子培养基中,30℃、180r/min振荡培养48h。
1.3.3 紫红曲霉M144液态发酵
向装有50mL基础发酵培养基的250mL三角瓶中接种10%(5mL)的紫红曲霉M144种子液,30℃、180r/min振荡培养6d,测定发酵液的红色价及色调。
第一种方法是基于对象的行为数据的协同过滤算法(Collaborative Filtering,CF)。通过在对象的历史行为(例如用户的浏览记录,购买记录等等)归纳出一种特定的模式,再通过这些行为记录,利用一些基本的统计知识来分析这些用户的历史行为与产品的相似度。最后推荐将相似度最高且此用户未浏览过的内容推荐给用户。这种算法可依据收集的用户的历史数据,来推荐世界上的任何一种东西。这个算法的实施步骤主要来说可分为三个主要的阶段:(1)收集、分析各个用户的行为记录。(2)寻找相近用户。也就是找到和该用户相似度最高的用户。为了达到该目的,一般会使用调整余弦相似性来计算。
1.4 分析方法
红曲红色素色价的测定采用GS 15961-2005(食品添加剂红曲红色素国家标准[S])[8]。
红曲红色素色调=OD505/OD420[9]。
1.5 实验设计与数据分析方法
以红色价和色调为指标,采用析因实验设计[10],筛选对红色价和色调影响显著的因子,实验设计及结果见表1;然后进行最陡爬坡实验,实验设计及结果见表2;最后进行Box-Behnken中心组合实验设计[10],实验设计及结果见表3;用SAS8.2进行响应面分析。
2 结果与分析
2.1 主要影响因素的确定
以液体深层发酵的基础发酵培养基中各组份的含量为中心点,即玉米粉4.0%,豆粕粉2.0%,MgSO4·7H2O 1.5%,K2HPO4·3H2O 0.1%,对发酵培养基进行析因实验,实验设计及结果见表1。
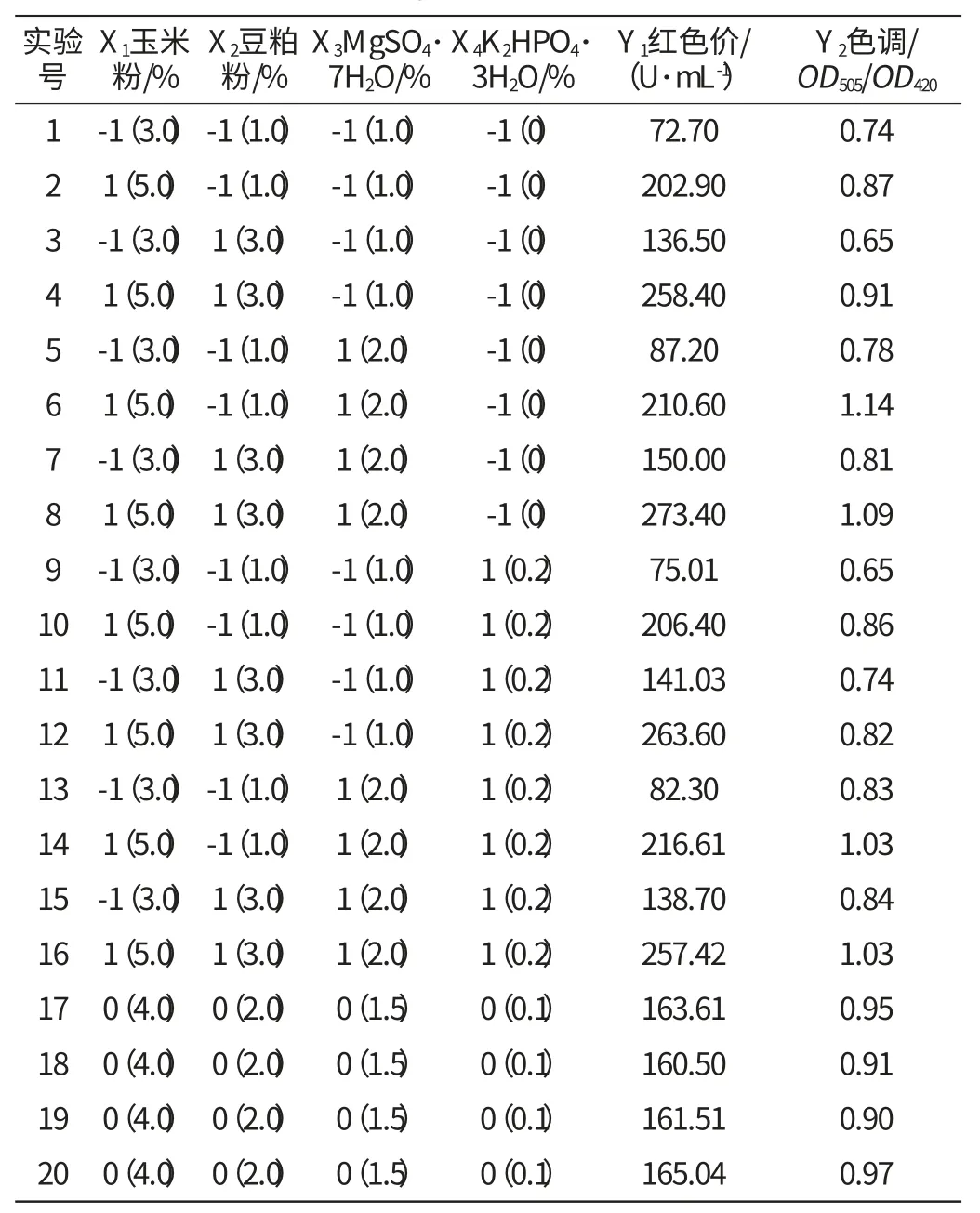
表1 析因实验设计及实验结果Table 1 Experimental design and results of factorial experiment
经SAS软件分析,玉米粉x1(p<0.01)、豆粕粉x2(p<0.01)的加量对红色价影响显著,MgSO4·7H2O和K2HPO4·3H2O对红色价的影响不显著,因此把MgSO4·7H2O和K2HPO4·3H2O固定在初始值即MgSO4·7H2O 1.5%,K2HPO4·3H2O 0.1%。玉米粉x1(p<0.01)、MgSO4·7H2O x3(p<0.01)的加量对色调影响显著,豆粕粉和K2HPO4·3H2O对色调的影响不显著,因此把豆粕粉和K2HPO4·3H2O固定在初始值即豆粕粉为2.0%,K2HPO4·3H2O为0.1%。
2.2 最陡爬坡实验
析因实验设计结果表明了Y1的主要影响因素为玉米粉和豆粕粉,Y2的主要影响因素为玉米粉和MgSO4·7H2O,根据此结果设计Y1和Y2的最陡爬坡路径,实验设计及结果见表2。

表2 Y1和Y2最陡爬坡实验设计及结果Table 2 Design and results of Y1and Y2in steepest accent experiment
从表2可以看出,第4组实验红曲红色素红色价最高,说明Y1的最优点在第4组实验附近。第2组实验红曲红色素色价最高,说明Y2的最优点在第2组实验附近。
2.3 响应面优化实验
以最陡爬坡实验的最佳点为中心点分别对红曲红色素的红色价(Y1)和色调(Y2)进行Box-Behnken中心组合实验和响应面优化,实验设计及结果见表3。
对表3的分析结果进行多项式回归拟合,得到回归方程为:

图1和图2为计算得到响应面图可看出对红色价和色调响应的两因素具有显著的交互作用。
由SAS软件进行脊岭分析,可知模型Y1的最大极值点为X1=4.69,X2=2.32,红色价Y1=290.94U/mL,其他成分不变即MgSO4·7H2O 1.5%,K2HPO4·3H2O 0.1%。模型Y2的最大极值点为X11=4.40,X3=1.68,色调Y2=1.17,其他成分不变即豆粕粉2.0%,K2HPO4·3H2O 0.1%。
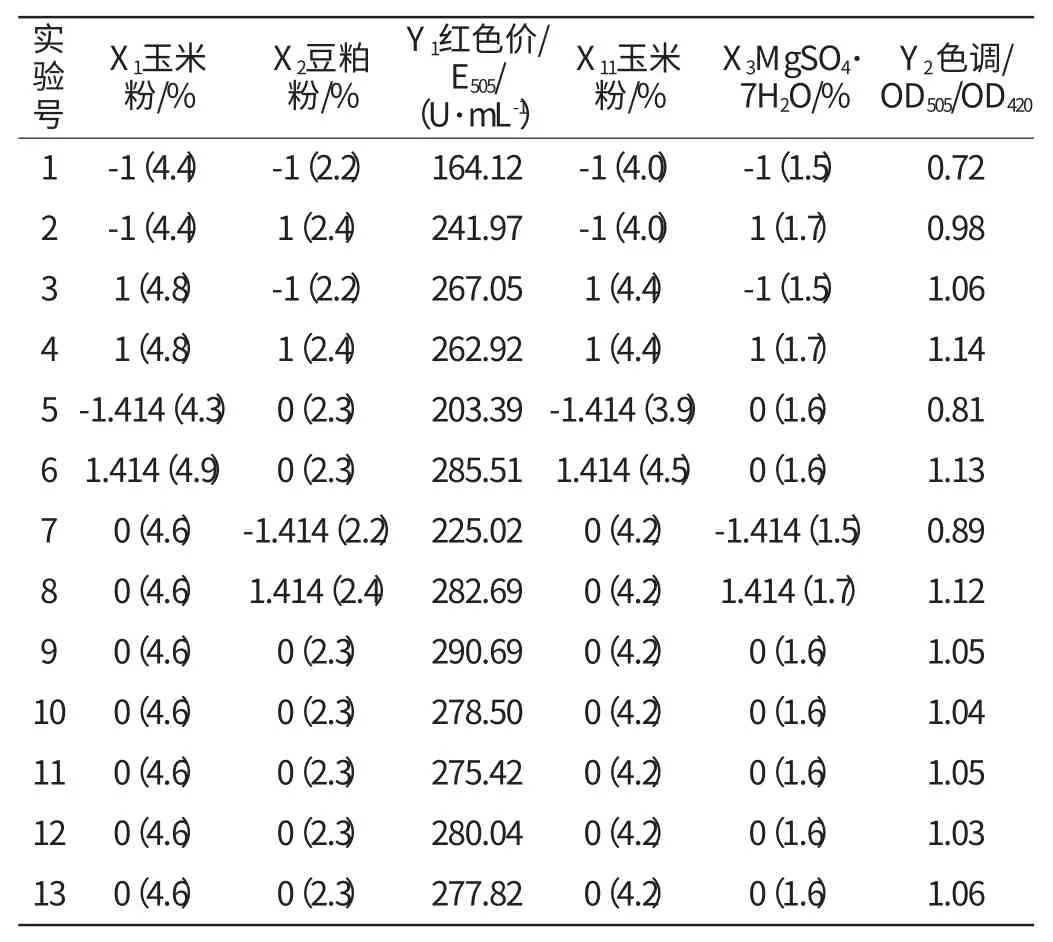
表3 Y1和Y2Box-Behnken 中心组合实验设计及结果Table 3 Design and results of Y1and Y2in Box-Behnken Central composite experiment
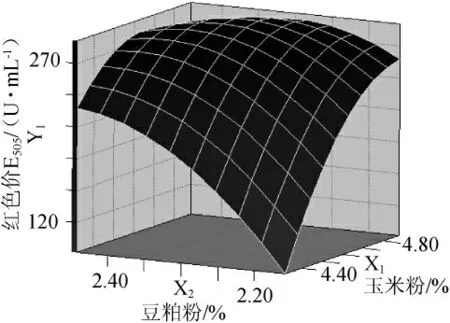
图1 玉米粉和豆粕粉交互作用曲线图Fig.1 Interaction diagram of corn power and bean power
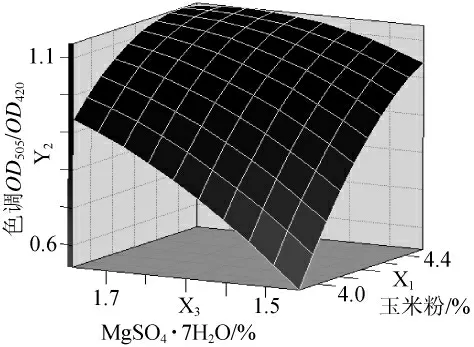
图2 玉米粉和MgSO4·7H2O交互作用曲线图Fig.2 Interaction diagram of corn power and MgSO4·7H2O
把方程(1)和方程(2)联合,经多元统计分析获得最大预测红色价与色调值为287.39U/mL和1.14,此时培养基组成为玉米粉4.52%,豆粕粉2.32%,MgSO4·7H2O 1.55%,K2HPO4·3H2O 0.1%。
2.4 响应面优化实验的验证实验
以响应面优化获得的最佳培养基和未优化的培养基进行对比实验,实验结果见表4。

表4 响应面法优化结果的验证实验Table 4 Confirmatory experiment of response surface optimization
由表4可知,在优化后的培养基中发酵后,平均红色价为280.27 U/mL,比对照增加64.86%;平均色调为1.09,比对照色调值增加10.10%。
3 讨论
目前对红曲霉液态发酵生产红曲红色素的研究中,在对红色素发酵条件研究方面大都采用单因子实验或简单的正交实验,这种研究方法忽略了各因素间的交互作用对响应值的影响,而且在研究中只以红色素的色价为指标,未考虑色价对红色素质量的影响[2-4,11-12]。
本文同时以红色价和色调为指标对红曲霉液态发酵生产红曲红色素的培养基进行了实验设计和响应面优化,利用析因实验设计对红曲霉发酵产红曲红色素培养基各成分进行了评价,成功地筛选出影响紫红曲霉M144发酵产红曲红色素的关键培养基组分,省时省力,快速有效。在此基础上通过中心组合实验和响应面优化(RSM)建立了影响红曲霉发酵产红曲红色素的二次多项数学模型,并利用统计学方法对该模型进行了显著性检验,优化了各因子水平,探讨了各因子间的交互作用。
以诱变后的M144为出发菌株,在优化后的液体培养基中红曲红色素的红色价和色调分别为280.27U/mL和1.09,红色价比山东荷泽学院王广峰[11]研究的结果提高80.81%,色调没有对照,是目前以玉米为原料液态发酵生产红曲红色素的最高水平,与彭中健[12]以EW906为出发菌株,以大米为原料液态发酵生产红曲红色素的红色价比高6.57%。同时大米的价格比玉米高40%,因此玉米是一种有优势的生产红曲红色素的原料。通过对红色素提取条件进行优化,有望进一步提高以玉米为原料生产红曲红色素的红色价和色调。
[1]田 莉,程剑峰.红曲的生产及其应用[J].农产品加工,2003(5):24-27.
[2]李喜仙,刘 玺.小米液态发酵生产红曲色素技术研究[J].食品添加剂,2002(9):42-44.
[3]CARELSM,SHEPHERDD.Theeffect of pH and amino acid on condiation and pigment production ofMonaseus majorATCC 16362 andMonascus rubiginosusATCC 16367 in submerged shaken culture[J].Can J Microbiol,1998(24):1346-1357.
[4]CARELSM,SHEPHERD D.The effect of different nitrogen sources on pigment production and sporulation inMonascusspecies in submerged shaken culture[J].Can J Microbiol,1997,23:1360-1372.
[5]夏书华,刘 颖.有关红曲色素的提取及提高色价的研究[J].北京农学院学报,1999,14(1):44-48.
[6]WONG HC,KOEHLER PE.Production of red water-soluble Monascus pigments[J].J Food Sci,1983(48):1200-1203.
[7]孙文红,高玉荣.紫外诱变选育红曲红色素高产菌株的研究[J].酿酒,2008(1):75-77.
[8]GS15961-2005,食品添加剂红曲色素国家标准[S].
[9]沈士秀.红曲的研究及应用[J].食品工业科技,2001,22(1):85-87.
[10]刘振学.实验设计与数据处理[M].北京:化学工业出版社,2005.
[11]王广峰.红曲色素液体深层发酵工艺研究[J].食品科技,2007,10(3):90-95.
[12]彭中健,梁淑娃.液态深层发酵生产红曲色素的研究[J].四川食品与发酵,2004,28(4):317-320.
