独立第三方参与临床课题研究质量监管模式的探索研究
2012-04-13韩秀兰刘蔚涛黄艳春武海波
韩秀兰,刘蔚涛,黄艳春,武海波
·质量控制与管理·
独立第三方参与临床课题研究质量监管模式的探索研究
韩秀兰,刘蔚涛,黄艳春,武海波
为保障已立项研究的“北京市重大疾病防治的科技计划”研究的顺利实施,北京市科委尝试采用独立第三方参与临床课题质量控制的新型监管模式。独立第三方从另一个全新的角度对课题的真实性、规范性和完整性进行质控管理。通过对独立第三方质控监查管理研究结果的环比分析,课题实施的规范性、数据记录的准确性、实验资料收集的完整性、数据的可溯源性等方面均有 20%~50% 的提高成果。现将其独立第三方参与临床课题质控管理的探索模式报告如下:
1 独立的监管形式
课题资助方以招标考核形式遴选出独立的质控监管方,这样有助于课题监管保持公平性,易于对科研课题实施全程给出客观的评价,易于对临床科研课题的全程质量管理并打造一个独立的、动态的、流程化的新型管理模式。
独立第三方的监管应服从于科研项目资助方的授权与委托,是一个独立的监管合同组织。须具有足够的相关专业监查人员,充分的现场核查管理时间,长期的质控管理工作经验,高度的责任心,明确的工作目标和管理水平。
2 成立专家顾问团队
各类被批准立项的研究课题,均为学科前沿水准的研究课题。依托于专家顾问进行学科前沿知识培训与工作指导,有益于独立第三方对新知识的汲取。依托专家进行问题评估分析,有利于独立第三方质控监管工作经验的积累。
依托专家力量是保证独立第三方质控监管质量的基本。课题流程环节实施是否规范,它是显而易见的事情,课题专业知识与技术含量对于独立第三方非学科专业人员来讲则是鞭长莫及不易监管的事情。因而诚聘顾问专家队伍,联合专家现场核查,接受专家培训,听取专家指导及论证凸显重要。
质控监查组的建立应按学科划分,每一学科研究课题设置一个质控监查组,按 1∶3 比例(1 名专家顾问、3 名质控监查员)匹配较为合适。它便于现场核查标准的执行,便于问题的讨论、评估与决策,便于与专家顾问/研究者资助方的沟通,便于现场分工合作(1 人询问问题、1 人记录、1 人实物查看)和相互补充。
3 建立自身质量控制体系
为保证监查质控的科学与严谨,须建立自身的监管质控体系。
3.1对内
实行三级监管质控体系,保证质控的质量标准。一级质控:项目监查员统一执行现场监查标准,进行现场核查并收集数据。二级质控:质控部与医学部门经理负责对一级质控人员进行工作全程监管,对问题数据进行现场稽查。三级质控:监管项目 PI 负责组织实施课题研究和组织专家论证。
3.2对外
实行多形式的监查体系,包括:例行现场监查、有因现场监查、邀专家联合现场监查、监查员互换监查、持续追踪监查。
4 制定质控监管标准
制定质控管理标准,可一致性检验质控监查人员的工作水平和技术偏差,检验质控标准执行的依从性和质控管理的公平、公正性。可一致性检验一项课题研究中各层级参研单位的研究人员结构合理性,研究设备、设施的完备性,方案的依从性,课题研究过程的规范性,数据采集的真实性,原始数据记录的及时性,研究资料保存的完整性。
独立第三方质控监管课题研究中,我们制定了《质控监查工作职责》、《质控监查计划》、《现场质控监查标准》、《现场质控监查流程》、《课题质量判定标准》、《质量判定标准操作流程》、《内部三级监管质控体系》、《外部质控监管方法体系》等现场质控监管的规范标准。质控监管标准规范的建立,是我们整个质控监查管理工作中的重要核心部分,公平公正和一致性的质控监管是支撑我们顺利完成质控监管工作和得到研究方中肯好评的关键。
5 建立多元化的质控核查方法体系
目前临床课题一般使用的研究方法有:前瞻性研究、诊疗规范研究、登记研究、流调研究、队列研究及技术推广研究等。应针对各类临床课题研究方法的不同,制定多元化的质控核查方法体系,以适应各类型临床课题研究的特点。根据不同课题的不同研究方法,选择不同的相适应的质控监管方法是最为适宜与奏效的选择。如:
①前瞻性研究:选择持续性追踪 + 现场监查 + 溯源方法
②诊疗规范研究:选择 Delphi + 现场监查方法 + 论证方法
③登记研究:选择连续性跟踪 + 现场监查方法
④流调研究:选择点面覆盖率 + 基线回归溯源方法
⑤队列研究:选择层级质控 + 现场监查 + 溯源方法
⑥技术推广研究:选择 Delphi + 现场监查方法 + 论证方法
6 制定课题质控监查量化标准
根据课题实施不同时间顺序分为三大质控监查环节,并明确规定各环节质控点内容。将其环节质控内容细化为 35条质控核查条目。按质控点所占比重和比例合理给出量化评分标准。采取若干措施对影响课题研究质量的各个环节进行控制。
6.1三大质控监查环节
①课题研究前;②课题实施中;③课题总结期
6.2各环节质控监查细化条目
①课题研究前 研究团队建设;研究人员职责分工;研究设备/设施;课题研究文件制定;伦理审查批准;国际临床试验网注册;课题启动人员培训;紧急情况抢救预案/设备/药品;接待受试者的场所;合作协议;研究药品/物品/资料专人专柜保存管理。
②课题实施中 研究方案的依从;研究病例的诊断;研究病例的筛选;研究病例的入排标准;研究病例 ICF 签署;研究病例访视;研究病例的治疗;研究病例的实验室检查;研究病例的合并用药;研究病例的病史;CRF/SD 的数据记录;AE/SAE 的记录、报告与追踪;研究病例的失访;研究药物/器械的管理;课题年度计划完成情况;中期总结协调。
③课题总结期 数据收集;数据管理;数据录入;数据揭盲;数据统计;数据分析;结题报告;课题文件管理。
7 制定质控监管流程
以内部层级质控管理体系内容为主,制定现场质控管理流程(图 1)。

图1 质控监管流程图
8 独立第三方质控监管定位
独立第三方参与临床课题质控监管应从监管职能、监管内容、监管目标、监管方法上进行定位。有依有据,有条不紊地进行质控监管工作。
①在监管职能上不可揽权越权,明确自己的职能替代不了政府部门的管理职能,而只是对政府的管理制度和措施提供数据支持和现场质控。使政府的管理措施下沉到基层,作为科委项目监管的有益补充。
②在监管内容上应根据临床课题研究流程和内容制定SOP,使现场质控监管工作符合其课题研究流程规律,实行一种全程动态的阶段性的监管模式,减少对临床课题研究的主观干预,保证临床课题实施各环节内容及所获得的研究数据真实可靠。
③在设立监管目标上要切实可行,以此为依据投入人力物力资源。要慎重考虑通过质控监管可达到或可提高的百分点。监管目标也是考核监管工作的指标,是检验我们监管工作的尺子。在此,研究人员组成合理性的提高、研究方案依从性的提高、数据记录规范性/完整性/真实性的提高、疑问数据的数量下降等都可作为课题质控监管中的客观考核指标。
④质控监管方法应根据临床课题应用的研究方法不同而制定质控监管方法。使用的方法不同其获得的效果必然不同。方法的使用上应恰如其分。
9 质控监管工作实施规范
①课题研究前采用 Delphi 问卷审查方法,对现场核查方法、现场核查标准、现场质控监查流程、质量判定标准、质量判定标准操作流程等进行审查论证。根据审查论证意见进行修改,修改后再行 Delphi 会议审评方法来验证其可行性。
②课题实施中,采取层级分段现场核查方式。层级为:把项目主持单位、项目研究单位、项目参与单位分为三级。根据各级研究单位在研究中所占责任比重制定质控监管标准,按其标准进行质控监查和问题权属划分。分段为:把质控监查分为初次核查、持续核查、追踪核查、终点核查四个阶段。在每个阶段的历次核查后,出具 SDV 报告敦促质量改进。出具核查报告与课题 PI 沟通给以质量重视。以季度报告和年度报告形式定期向北京市科委汇报,透明课题实施过程。
③课题研究结束前召开专家研讨会,对独立第三方参与的临床课题研究质控管理模式进行讨论。通过讨论看其独立第三方参与临床课题质控监管模式是否可行,质控监管是否起到促动作用,是否能有效地规范课题研究的实施过程,能否形成一个流程化、动态化管理的新型模式;能否与科委在课题实施中的监管上相互配合、相互补充,以形成长效管理机制。
10 结果
我们采用以上监管模式对 45 家参研单位的课题实施情况进行了考察,其结果均有不同程度的提高(表 1~4)。
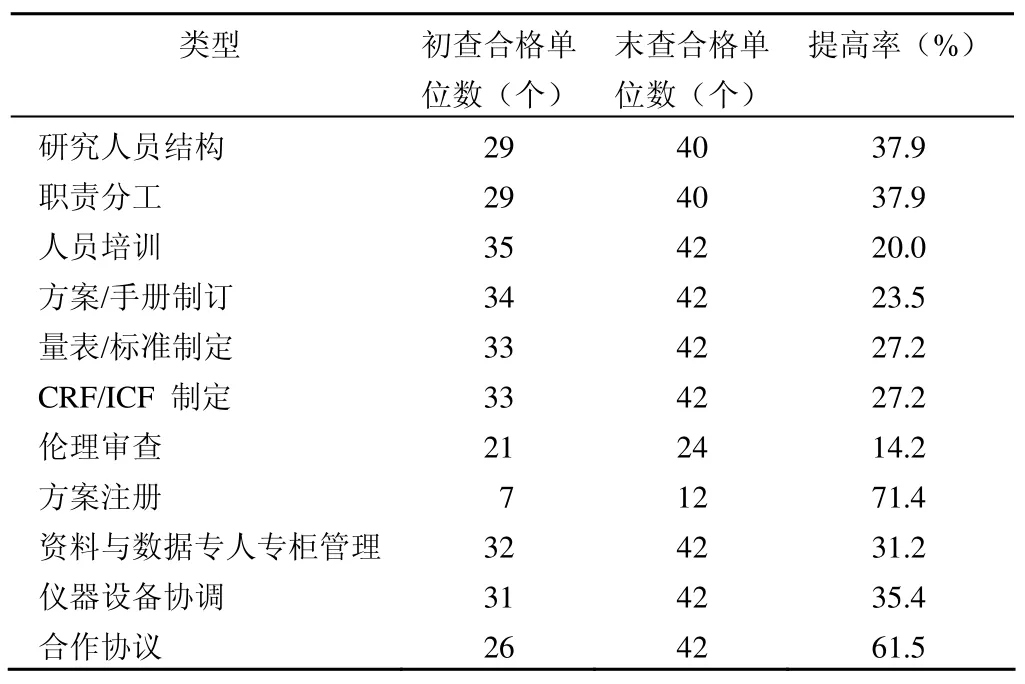
表1 课题实施支撑条件
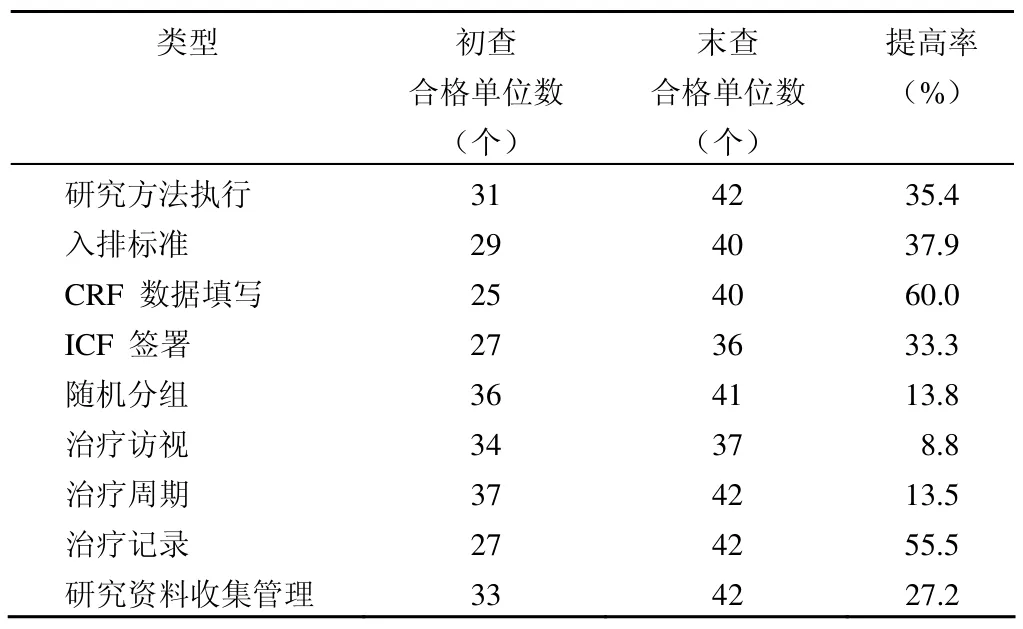
表2 课题实施规范性
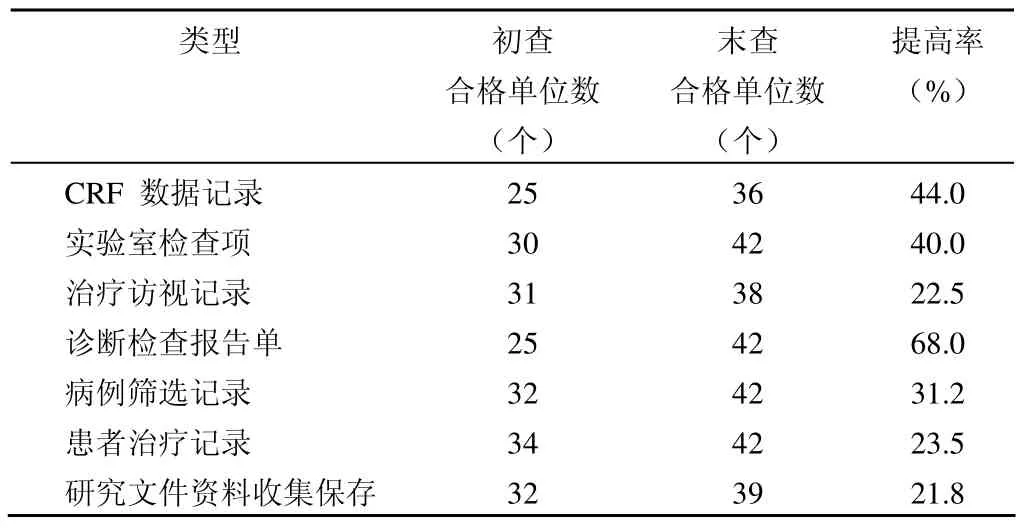
表3 课题实施完整性
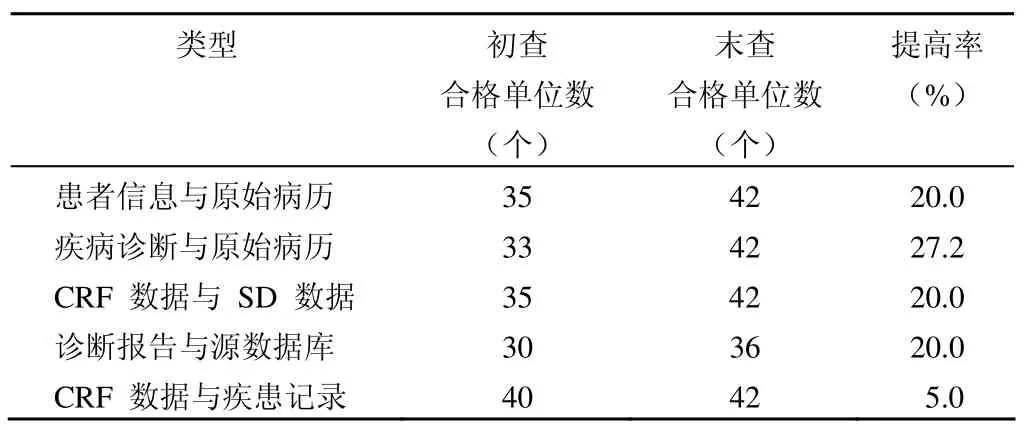
表4 课题实施可溯源性
11 小结
⑴本质控监查课题通过运用 PDCA(P:策划;D:实施;C:检查;A:改进)循环方法,使拟定的质控监查方法、技术路线、现场监查标准和课题质量评判标准不断得到修正和检验,更趋于合理化和公平性。质控监管操作过程公平、科学、标准、客观,使其达到了质控监管的目的。
⑵专家审评课题的意见认为:北京市科委为重大项目的顺利实施已根据国际管理理念进行流水分工,成功引入第三方进行质控管理,提高了研究效率,改进了研究质量。
⑶整合外部科研管理资源,有力形成质控管理规模优势,可大幅度提高课题研究质量控制的效率,降低质量管理成本。
⑷与北京市科委之间逐步形成一种相互配合,相互补充的管理模式。建立固定的独立第三方参与临床科研课题质控监管的长效机制,填补课题实施过程的质控监查管理空缺。
⑸本课题在质控监管的职能、目标、内容和方法上定位得当,监管目标明确。具有实际应用意义与其他部门借鉴价值。
⑹因本课题是北京市科委设立的第一个独立第三方参与临床课题研究质控监查的初步探索研究,故有待于继续多课题、多方法、多个独立监查三方共同探讨研究,拟定其独立第三方参与临床课题质控监管的内部管理和外部监管模式、方法、行为更趋于合理。
参考文献
[1] Li YQ, Weng WL, Li R, et al. Joint inspection of Chinese medicine clinical research and quality control. Chin J Inf Traditional Chin Med, 2010, 17(1):8-11. (in Chinese)李秋艳, 翁维良, 李睿, 等. 中医临床研究的联合监查与质量控制.中国中医药信息杂志, 2010, 17(1):8-11.
[2] Liu WN, Zhang YL, Lu Y, et al. Discussion on quality management mode of multi-center clinical trail. Chin J Clin Pharmacol, 2007, 23(1):70-72. (in Chinese)刘文娜, 张允岭, 路遥, 等. 多中心药物临床试验质量管理模式探讨. 中国临床药理学杂志, 2007, 23(1):70-72.
[3] Zhang MH, Zhao J, Song HB, et al. Analysis of self-organization and hetero-organization mechanism in scientific research management. Chin J Med Sci Res Manage, 2009, 22(1):19-21. (in Chinese)张明华, 赵瑾, 宋宏彬, 等. 试析科研管理中的自组织与他组织.中华医学科研管理杂志, 2009, 22(1):19-21.
[4] Agersti A. Categorical data analysis. 2nd ed. Hoboken, NJ: Wiley-Interscience, 2002.
[5] Topol EJ. Arthritis medicines and cardiovascular events—“house of coxibs”. JAMA, 2005, 293(3):366-368.
[6] Gallin JI, Ognibene FP. Principles and practice of clinical research. 2nd ed. Salt Lake City, UT: Academic Press, 2007.
DOI:10.3969/cmba.j.issn.1673-713X.2012.04.013
基金项目:北京市科委科技支撑计划(Z090507017709026)
作者单位:100005 北京精诚泰和医药信息咨询有限公司
通讯作者:武海波,Email:wuhaibo@giantcro.com
收稿日期:2012-01-11
