4份菊苣种质材料苗期抗旱性评价
2012-04-12刘建宁石永红侯志宏王运琦李鹏邢亚亮吴欣明张燕
刘建宁,石永红,侯志宏,王运琦,李鹏,邢亚亮,吴欣明,张燕
(1.山西省农业科学院畜牧兽医研究所,山西 太原030032;2.山西省农业厅,山西 太原030001)
*菊苣(Cichoriumintybus)又称咖啡草、咖啡萝卜,为菊科菊苣属多年生草本植物,广布于亚洲、欧洲、美洲及大洋洲,在我国分布于西北、东北、华北等地,常见于山区、田边及荒地。20世纪90年代我国从新西兰引进,在山西、四川、陕西等地引种[1-3]。菊苣不仅是一种广泛利用的菜叶类蔬菜植物,高产优质的饲用牧草,且根中含有丰富的菊糖和芳香族物质,可提制代用咖啡,根中提取的苦味物质可提高消化器官的活动能力,具有饲用、药用、食用和蜜源用等多方面的开发潜力,因而倍受国内外科学工作者的广泛关注[4,5]。四千年前古埃及就利用其根作咖啡的代用品,嫩叶供食用,古希腊和古罗马时代也已开始利用这种植物[6]。约1870年出现于布鲁塞尔并被广泛利用种植[6]。而最早对菊苣综合介绍的是法国的Plumier[6],1972年他详细的介绍了菊苣的生物学特性、栽培技术和品种改良等方面。1990年Nicola和Vincenzo[7]在意大利就进行了不同的收获期对2个菊苣品种的产量及质量影响的研究。在波兰Bahid[8]于1994-1996年进行了天气状况(太阳辐射量、光照和积温)对菊苣根成熟的影响,同时评估了利用热量需要量对收获时期进行预测的可能性[8],Rodkiewicz[9]于1999和2000年,进行了不同的播种期对菊苣产量的研究。1988年山西省农业科学院畜牧兽医研究所将新西兰培育的普纳菊苣(Cichoriumintybuscv.Puna)引进我国种植[1]。高洪文和马明荣(1991)[1]、刘大林和张万鑫(1998)[3]、李辰琼和韩永芬(2003)[10],韩永芬等(2004)[11]、代立兰(2005)[12]、孟林等(2005)[13]先后在山西、江苏、贵州、甘肃和北京进行了菊苣引种及栽培技术研究。葛荣朝等(2002)[14]、李明胜(2005)[15]、程林梅等(2004)[16]对普那菊苣的染色体进行了核型分析和遗传转化体系建立研究。罗燕等(2010)[17]对48份菊苣种质材料进行了遗传多样性的SRAP研究。任克良等(2002)[18]、梁茂文(2002)[19]、张俊宝和张霞光(2002)[20]、魏磊(2004)[21]分别进行了菊苣饲喂奶牛、肉兔、波尔山羊和猪的试验研究。国内外有关菊苣的植物学特性、生产性能评价、引种驯化栽培、染色体组及细胞遗传学、饲用利用、系列产品开发等方面的研究报道较多,但关于其抗旱性的研究报道很少。本研究对菊苣种质材料进行抗旱性研究评价,旨在筛选耐旱菊苣种质材料,为抗旱菊苣新品种选育提供基础材料。
1 材料与方法
1.1 试验材料
试验材料为4个菊苣品种(系),试验编号分别为C1、C2、C3和C4,C1为普纳菊苣,C2和C3为普纳菊苣的变异品系(C2叶片羽状深裂,C3叶片全缘),C4为将军菊苣(C.intybuscv.Commander)。C1、C2、C3由山西省农业科学院畜牧兽医研究所提供,C4由百绿国际草业(北京)有限公司提供。
1.2 试验设计
试验于2008年12月-2009年1月在山西省农业科学院畜牧兽医研究所试验温室进行,钢架阳光板温室,太原市热力公司统一供热,室内温度8~30℃,自然采光,中午通风换气30 min,相对湿度45%~60%。采用苗期土壤干旱-复水法。试验选用大田壤土,过筛,去掉石块、杂质,用无孔塑料箱(内径长49 cm、宽32 cm、高22 cm),每箱装土壤20 kg(土壤含水量16.31%),用硬纸片将塑料箱平均分隔成2块,每块播种1份试验材料。将种子均匀撒播于箱中,覆盖沙土1~2 cm,然后用水浇透,2~3片真叶时,间苗定苗,每箱中每个材料选留10株长势均匀的幼苗。试验设对照、连续干旱处理、反复干旱处理3组,3次重复。对照组和连续干旱处理组幼苗生长到4~5片真叶时进行干旱胁迫处理,干旱胁迫前将水浇透,分别于干旱胁迫第0天(CK),5,10,15,20,25 d(复水后第5天)上午8:30取样,采取混合取样法,每个处理随机取3~5个叶片,带回实验室用纸巾擦干净,用剪刀剪成小块,取样测定叶片含水量、相对含水量、相对电导率、可溶性糖含量、脯氨酸含量等生理指标。对照组和反复干旱处理组,对照组正常浇水,反复干旱处理组幼苗严重萎蔫后浇水,干旱胁迫第20天测定株高、地上及地下生物量,计算根冠比、株高胁迫指数、干物质胁迫指数。
1.3 测定内容与方法
1.3.1 叶片含水量、相对含水量及其下降百分率 干旱胁迫处理第0天(CK)、5,10,15,20,25 d(复水后第5天),采用烘干称重法测定并计算叶片含水量、相对含水量及其降低百分率[22,23]。

式中,Wf为叶片鲜重(g),Wd为叶片干重(g),Wt为叶片饱和鲜重(g)。
1.3.2 叶片渗透液相对电导率及其增加百分率 干旱胁迫处理第0天(CK)、5,10,15,20,25 d(复水后第5天),用DDS-11A型数字显示电导仪测定外渗液的电导率,计算相对电导率及其增加百分率[21,22]。

1.3.3 叶片可溶性糖含量及其增加百分率 干旱胁迫处理第0天(CK)、5,10,15,20,25 d(复水后第5天),采用蒽酮法测定并计算可溶性糖含量[22,23]。

式中,C为从标准曲线查得葡萄糖量(μg),V T为样品提取液总体积(m L),V1为显色时取样品提取液量(m L),W为样品重(g)。
1.3.4 叶片游离脯氨酸含量及其增加率 干旱胁迫处理第0天(CK)、5,10,15,20,25 d(复水后第5天),采用茚三酮法测定并计算游离脯氨酸含量[24]。

式中,X为从标准曲线查得脯氨酸含量(μg),V T为样品提取液总体积(m L),V1为显色时取样品提取液量(m L),W为样品重(g)。
1.3.5 干物质胁迫指数和株高胁迫指数 反复干旱胁迫处理第20天,测定对照和干旱胁迫处理牧草株高、地上及地下生物量,然后按下列公式计算株高和干物质胁迫指数[23,24]。

1.3.6 生物量根冠比 反复干旱胁迫处理第20天,测定对照和干旱胁迫处理地上及地下生物量,计算生物量根冠比[23,25]。

1.3.7 抗旱性综合评价 抗旱性综合评价采用隶属函数法[26,27]。利用下列公式对各项测定指标进行标准化处理,最后把每份材料的各项指标隶属函数值进行累加,求平均值,平均值越大,表示抗旱性越强[27]。

式中,x为各材料的某一指标测定值,xmin为该指标的最小值,xmax为该指标的最大值。如果某一指标与抗旱性正相关用R(u)计算,反之,则用R(u)-1计算。
1.4 试验数据处理与统计分析
试验数据采用Excel预处理后,再用DPS进行方差分析及Duncan’s多重比较。
2 结果与分析
2.1 干旱胁迫下菊苣叶片含水量的变化
水分是维持植物体正常生理作用的基础,叶片含水量与叶片相对含水量可以反映植物体内水分亏缺程度,干旱胁迫下植物叶片含水量及相对含水量越高,叶片持水力越强,植物抗旱性越强[27-31]。4份供试菊苣材料叶片含水量和相对含水量均随着干旱胁迫的加重而逐渐下降,复水5 d后均有不同程度的恢复,C2叶片含水量及叶片相对含水量下降幅度最小,分别为4.73%和7.24%,C1、C4、C3叶片含水量及叶片相对含水量下降幅度稍大,含水量下降百分率在6.42%~7.12%,相对含水量下降百分率在9.15%~9.76%,说明C2保水能力和抗旱性较强(表1,2)。
2.2 干旱胁迫下菊苣叶片细胞膜相对透性的变化
干旱胁迫发生时,叶片细胞膜容易受到损伤,膜透性增加,细胞内含物外渗[32],外渗液电导率越高,质膜损伤程度越大,抗逆性越弱[33]。供试的4份菊苣材料的电导率随干旱胁迫的加剧而逐渐增大,复水后略有下降。干旱胁迫第20天,C3和C4的电导率增加百分率较高,分别为91.76%和90.62%,C1和C2的电导率增加百分率较小,分别为52.91%和61.11%,表明干旱胁迫时,C1和C2叶片细胞膜受损程度相对较小,抗性较强(表3)。
2.3 干旱胁迫下菊苣叶片可溶性糖含量的变化
可溶性糖是植物体内重要的渗透调节物质之一,干旱胁迫发生时植物通过积累可溶性糖等渗透调节物质,降低叶片水势,增强吸水力,且随干旱时间延长和胁迫程度加大而增加,由此成为植物抗旱性的一个主要特征[29,34]。孙铁军等[23]对无芒雀麦(Bromusinermis)等10种禾草苗期抗旱性研究表明,干旱胁迫下抗旱性强的无芒雀麦可溶性糖增加百分率相对较高。供试菊苣材料的叶片可溶性糖含量随干旱胁迫程度增加而大幅度升高,复水后大幅度降低,但没有恢复到对照水平。干旱胁迫第20天,4份菊苣材料的可溶性糖含量水平均较高,C2叶片可溶性糖含量增加幅度较大,达1 146%,C1、C3、C4增加幅度较小,在416%~612%,C2抗旱性较强,C1、C3、C4抗旱性相对较差 (表4)。
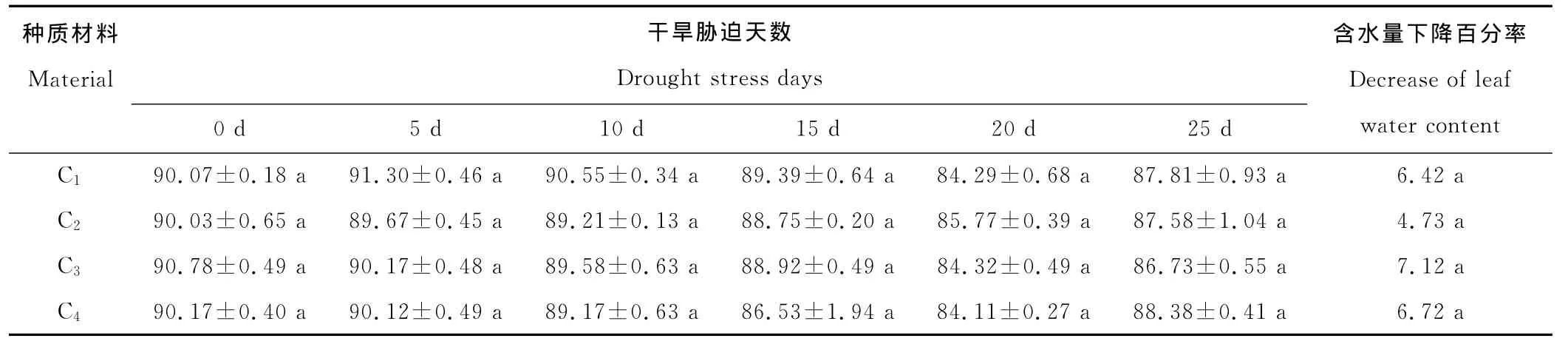
表1 不同程度干旱胁迫下菊苣叶片含水量Table 1 Leaf water content of C.intybus under different treatments of water stress %

表2 不同程度干旱胁迫下菊苣叶片相对含水量Table 2 Leaf relative water content of C.intybus under different treatments of water stress %
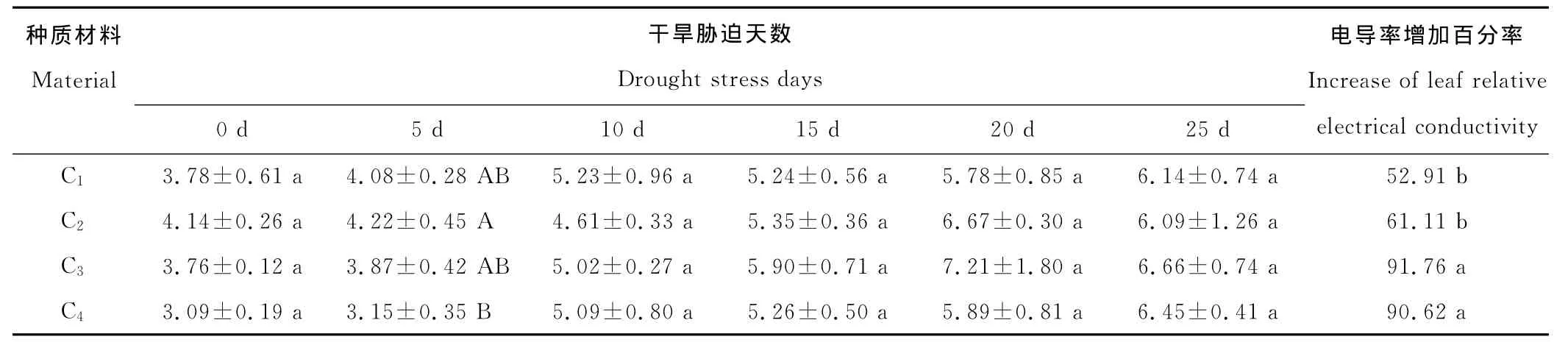
表3 不同程度干旱胁迫下菊苣叶片相对电导率Table 3 Leaf relative electrical conductivity of C.intybus under different treatments of water stress %

表4 不同程度干旱胁迫下菊苣叶片可溶性糖含量Table 4 Leaf soluble sugar content of C.intybus under different treatments of water stress μg/g FW
2.4 干旱胁迫下菊苣叶片脯氨酸含量的变化
国内外有关植物渗透调节物质中,以对脯氨酸的研究最多,但结果各异[35]。1954年Kemble和Macpherson研究黑麦(Secalecereale)时,首先发现干旱下游离脯氨酸大量积累,此后在大麦(Hordeumvulgare)、小麦(Triticumaestivum)、水稻(Oryzasativa)、高粱(Sorghumbicolor)、大豆(Glycinemax)、棉花(Gossypiumspp.)、烟草(Nicotianatabacum)上得到证实,各种逆境都会引起植物体内Pro积累,特别是干旱胁迫积累最多,可比原始含量增加几十倍到几百倍[36]。有研究表明:逆境下抗逆性较弱的品种积累脯氨酸较少,而抗逆性较强的品种脯氨酸积累较多[37]。但有些研究结论正好相反,认为脯氨酸积累的多少是一个胁迫伤害指标,而非抗性指标[38,39]。本研究结果表明(表5),轻度干旱胁迫期间(0~10 d),4份供试菊苣叶片脯氨酸含量出现小幅下降,随后开始快速增加;中度干旱胁迫期间(10~15 d),增加幅度减缓;重度干旱胁迫期间(15~20 d),大幅度增加;复水后(20~25 d),急剧下降。C2脯氨酸增加幅度较大,达到1 060%,C4、C1和C3脯氨酸增加幅度稍小,在872%~935%。

表5 干旱胁迫下菊苣叶片脯氨酸含量Table 5 The Pro of C.intybus under different treatments of water stress μg/g FW
2.5 干旱胁迫下菊苣生物量、株高的变化
植物在干旱等逆境胁迫下,生长发育受抑,株高和生物量会明显降低,抗旱性强的品种自我调节能力强,生长受抑程度较小。郭颖等[40]研究表明随着土壤水分含量的降低,白羊草(Bothriochloaischaemum)、冰草(Agropyroncristatum)、无芒隐子草(Cleistogenessongorica)、长芒草(Stipabungeana)等4种禾草的株高生长速度、株高生长量、单叶叶面积扩展速率均受到抑制,抗旱性弱的长芒草所受影响最大,抗旱性中等的无芒隐子草次之,抗旱性强的白羊草和冰草所受影响最小。本研究结果表明,4份供试菊苣在严重干旱胁迫下的生物量和株高均低于对照(表6),其中C1在干旱胁迫下地上及地下生物量均最高,C2株高最高。从生物量和株高来看,C1和C2抗旱性强于C3和C4。

表6 干旱胁迫下菊苣的生物量和株高Table 6 Dry matter and plant height of C.intybus under water stress
2.6 干旱胁迫下菊苣株高胁迫指数、干物质胁迫指数及根冠比的变化
植物长期处于干旱状态下,冠层同化物向根系分配增多,促进根系生长,使根冠比增加,抗旱性强的植物根冠比相对抗旱性弱的植物大[25]。干物质胁迫指数和株高胁迫指数在植物抗旱性研究中也有一定的应用,一定时间的干旱胁迫后,干物质与株高胁迫指数越大,抗旱越强[24]。4份材料之间株高胁迫指数、干物质胁迫指数差异不显著,根冠比差异显著,C1和C2根冠比均显著高于C3和C4(P<0.05)(表7)。从株高胁迫指数和生物量胁迫指数来看,C1、C2、C4抗旱性强于C3。从根冠比来看,C1、C2抗旱性强于C3和C4。
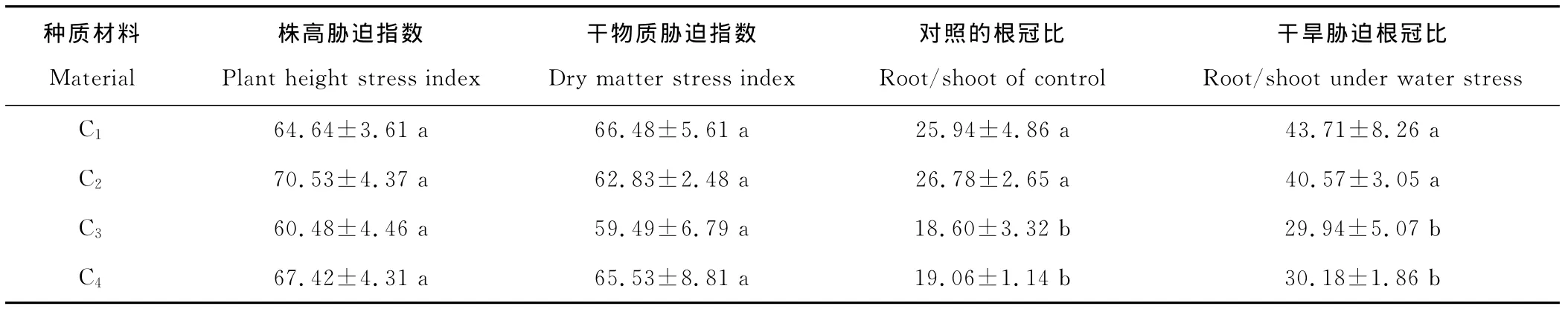
表7 干旱胁迫下菊苣的株高和干物质胁迫指数及根冠比Table 7 Plant height stress index and dry matter stress index,root/shoot of C.intybus under water stress
2.7 菊苣抗旱性综合评价
植物抗旱机理比较复杂,用某项单一指标来确定植物抗旱性强弱难度较大[23,41],利用生长指标和生理指标进行综合评价,是一种客观、有效的抗旱性评价方法[27]。本研究对4份菊苣材料干旱胁迫处理20 d的地上生物量、地下生物量、株高、株高胁迫指数、干物质胁迫指数、根冠比、含水量、相对含水量、膜透性、可溶性糖、脯氨酸等11个指标进行隶属函数处理,结果表明,C2、C1隶属函数平均值明显高于C4和C3,C2和C1差异不明显。从抗旱性综合评价结果来看,4份菊苣材料抗旱性由强到弱的顺序为C2>C1>C4>C3(表8)。
3 结论
通过对4份菊苣材料的叶片含水量、相对含水量、地上生物量、地下生物量、株高、株高胁迫指数、干物质胁迫指数、根冠比、细胞膜透性、可溶性糖、脯氨酸等11个指标进行比较分析,认为叶片含水量、相对含水量、株高、根冠比、细胞膜透性、可溶性糖可以作为菊苣抗旱性评价的主要指标,地上生物量、地下生物量、株高胁迫指数、干物质胁迫指数、脯氨酸仅可作为菊苣抗旱性评价的参考指标。
植物抗旱机理比较复杂,利用单一指标评价有失偏颇,采用多指标隶属函数法综合评价分析,可以客观地评价植物的抗逆性。C1(普纳菊苣)、C4(将军菊苣)为国家草品种审定委员会审定的引进菊苣品种,C2、C3是从普纳菊苣中筛选出的2种形态差异较大的新材料。经过近十年的田间观测比较,C2叶片羽状深裂,抗旱性较强,C3叶片全缘型,比较喜水。本研究对4份菊苣材料的11个抗旱性指标进行综合评价分析,得出4份菊苣材料抗旱性由强到弱的顺序为C2>C1>C4>C3,该结果与田间观测结果相一致。
[1] 高洪文,马明荣.菊苣引种栽培试验研究初报[J].中国草地,1991,(5):59-61.
[2] 卢克俊,田德贵,卞志高,等.菊苣草高产栽培与利用技术[J].四川草原,2003,(4):35-36.
[3] 刘大林,张万鑫.高产优质饲草——菊苣的栽培利用研究[J].畜牧与兽医,1998,30(6):256-257.
[4] 刘建宁,贺东昌.北方干旱地区牧草栽培与利用[M].北京:金盾出版社,1993:145-148.
[5] 王绍明,张霞,刘彤.菊苣花瓣的组织培养[J].植物生理学通讯,2001,37(3):230.
[6] Plumier W.Chicory improvement[J].Revue de l’Agriculture,1972,4:567-585.
[7] Nicola C,Vincenzo B V.Harvesting time on yield and quality of stems Chicory[J].Acta Horticulturae,2000,533:505-510.
[8] Bahid J M.The influence of weather condition and root harvest time for foreing usability of chicory cultivare[J].Acta Horticulturae,2000,533:513-517.
[9] Rodkiewicz.The effect of planting time on the yield of much-curled endive(CichoriumendiviaL.vac.crispim LAM.)[J].Vegetable Crops Research Bulletin,2001,55:71-75.
[10] 李辰琼,韩永芬.普那菊苣的栽培及利用[J].四川草原,2003,(6):59.
[11] 韩永芬,刘正书,刘凤霞,等.普那菊苣不同生育期的营养动态与产草量的关系[J].贵州农业科学,2004,5:30-32.
[12] 代立兰.兰州地区牧草引种筛选试验初报[J].甘肃农业,2005,(9):68.
[13] 孟林,张国芳,李潮流.饲用菊苣引种及其高产栽培技术研究[J].草业学报,2005,14(2):82-88.
[14] 葛荣朝,赵茂林,高洪文.普那菊苣的核型分析和C-分带研究[J].草地学报,2002,10(3):190-193.
[15] 李明胜.普那菊苣种内遗传变异的研究[D].杨凌:西北农林科技大学,2005.
[16] 程林梅,曹秋芬,黄静.菊苣高效遗传转化体系的建立[J].草业学报,2004,13(6):112-116.
[17] 罗燕,白史且,彭燕,等.菊苣种质资源遗传多样性的SRAP研究[J].草业学报,2010,19(5):139-147.
[18] 任克良,闫柳松,任家玲,等.普那菊苣栽培技术及饲喂肉兔效果试验[J].中国养兔杂志,2003,(4):12-14.
[19] 梁茂文.夏季菊苣草饲喂泌乳牛试验[J].中国乳业,2002,(2):13-16.
[20] 张俊宝,张霞光.优质牧草菊苣饲喂波尔山羊杂交羊试验效果[J].吉林畜牧兽医,2002,(7):21.
[21] 魏磊.用美国菊苣替代部分精料饲喂肥育猪的效果试验[J].养猪,2004,(3):41.
[22] 张治安,张美善,蔚荣海.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004:65-67.
[23] 孙铁军,苏日古嘎,马万里,等.10种禾草苗期抗旱性的比较研究[J].草业学报,2008,17(4):42-49.
[24] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2002:59-60.
[25] 徐炳成,山仑,黄瑾,等.柳枝稷和白羊草苗期水分利用与根冠比的比较[J].草业学报,2003,12(4):73-77.
[26] 兰巨生,胡福顺,张景瑞.作物抗旱指数的概念和统计方法[J].华北农学报,1990,5(2):20-25.
[27] 张冬玲,刘建宁,王运琦,等.羊茅种质资源苗期抗旱生理响应及综合评价[J].山西农业科学,2010,38(10):20-25.
[28] 陈立松,刘星辉.作物抗旱鉴定指标的种类及其综合评价[J].福建农业大学学报,1997,26(1):48-55.
[29] 刘惠芬,高玉葆,张强,等.不同种群羊草幼苗对土壤干旱胁迫的生理生态响应[J].南开大学学报(自然科学版),2004,37(4):105-110.
[30] 余玲,王彦荣,Trevor G,等.紫花苜蓿不同品种对干旱胁迫的生理响应[J].草业学报,2006,15(3):75-85.
[31] 石永红,万里强,刘建宁,等.干旱胁迫对6个坪用多年生黑麦草品种抗旱性的影响[J].草地学报,2009,17(1):52-57.
[32] Levitt J.Responses of Plants to Environmental Stress Vol.Ⅱ.Water Radiation,Salt and Other Stress[M].New York:Academic Press,1980.
[33] 韩清芳,贾志宽.紫花苜蓿种质资源评价与筛选[M].杨凌:西北农林科技大学出版社,2004:49.
[34] 王海珍,梁宗锁.黄土高原乡土树种抗旱生理指标的主成分分析[J].塔里木农垦大学学报,2004,16(1):13-15.
[35] 周久亚,刘建秀,陈树元.草坪草抗旱性研究概述[J].草业科学,2002,19(5):61-66.
[36] 邵艳军,山仑.植物耐旱机制研究进展[J].中国生态农业学报,2006,14(4):16-20.
[37] 汤章城.高粱幼苗对高渗透培养液的生长、生理反应及其抗逆性[J].植物生理学报,1984,10(1):37-45.
[38] Liu J P,Zhu J K.Proline accumulation and salt-stress-induced gene expression in salt-hypersensitive mutant ofArabidopsis[J].Plant Physiology,1997,114:591-596.
[39] 宗会,刘娥娥,郭振飞,等.干旱、盐胁迫下LaCl3和CPZ对稻苗脯氨酸积累的影响[J].作物学报,2001,27(2):173-177.
[40] 郭颖,韩蕊莲,梁宗锁,等.土壤干旱对黄土高原4个乡土禾草生长及水分利用特性的影响[J].草业学报,2010,19(2):21-30.
[41] 秦文静,梁宗锁.四种豆科牧草萌发期对干旱胁迫的响应及抗旱性评价[J].草业学报,2010,19(4):61-70.
