电解法生产甲醇钾的工艺研究
2012-04-10丁军委王绍荣于文龙
丁军委,王绍荣,于文龙
(青岛科技大学化工学院,山东 青岛 266042)
甲醇钾是甲醇OH基团中的H原子被K原子取代后的产物。甲醇钾主要用作缩合剂[1],可作为生产碳酸二甲酯、甲酸甲酯、二甲基甲酰胺的强碱性催化剂;也可用于生产磺胺类药物、维生素等医药产品以及农药产品;还可用作处理食用脂肪和食用油的催化剂,是一种重要的化工中间体。
液体甲醇钾有基本的两种生产工艺[2],一种是碱法(由甲醇和氢氧化钾生产),另一种是金属法(采用金属钾与甲醇反应来制备)。以此两种方法为基础,国内外研究学者又发明研究出许多制备甲醇钾的方法,其中,金属法[3]生产的甲醇钾含量高、稳定可靠,但金属钾价格昂贵、不易运输与贮存,生产中存在安全性差、易爆炸等弊病;甲醇与碱金属氢化物或氨基化物反应生成甲醇钾[4]的方法反应速度快,但生产原料价格昂贵且存在污染;碱法[5]生产工艺流程简单、操作方便,但其副产物很难去除;甲基碳酸钾与氧化钡反应生成甲醇钾[6]的方法中碳酸钡不能重复利用,造成较多的浪费;甲醇钠与碳酸钾反应制备甲醇钾[7]的方法中甲醇钠是不易获得的原料;碳酸钾与甲醇的反应[8]进行不彻底,产物分离困难。
相比之下,钾汞齐和甲醇反应制备甲醇钾[9]的方法保留了金属法生产的明显优势,又使其反应不会太剧烈。这一制备方法尚未投入工业化生产。本研究从电解法制备钾汞齐开始,通过讨论各种电解条件对电流效率的影响[10],研究了电解制备汞齐与钾汞齐法联合生产甲醇钾的方法,采用廉价的碳酸钾为原料,既降低了生产成本,又保证了产品纯度和操作的安全性。
1 试验部分
1.1 试验原理
1.1.1电解法制备汞齐
电解池底部流动的汞作为电解池的阴极[11],用带有氧化铱涂层的金属钛作为电解池的阳极[12-13],阳极溶液为碳酸钾溶液。电解池通电后,在阴极上,溶液中的钾离子得到电子,溶于金属汞中生成钾汞齐:
K++nHg+e-→K(Hg)n(钾汞齐)
(1)
在阳极上,水失去电子生成氧气:
1/2H2O-e-→1/4O2↑+H+
(2)
总反应方程式为:
(汞齐)+2H2CO3+O2↑
(3)
1.1.2汞齐合成甲醇钾
反应方程式[14]:
2K(Hg)n+2CH3OH→2CH3OK+2nHg+H2↑
(4)
由于钾原子溶解到汞中,可以增大反应面积,促进反应。同时由于汞的稀释作用,钾的反应会更温和。利用这个优点可以解决金属钾法反应剧烈、不易控制、安全性差、易爆炸等问题。从反应动力学方面来看, 此反应主要经历以下过程:1)汞齐表面的钾先与甲醇反应;2)由于浓度差钾汞齐中钾不断向表面扩散;3)扩散到表面的钾再与甲醇反应。
1.2 试验装置
自制水银电解槽、金属钛电极。
用厚度为10 mm的有机玻璃为原材料,丙酮为黏合剂制作成无盖长方体电解槽,其内部尺寸为200 mm×50 mm×150 mm。
电极板为带氧化铱涂层的金属钛板,尺寸为180 mm×35 mm×2 mm,试验时水平放置,与底部水银层距离为35 mm,接线柱直径为5 mm,与电极板顶部中点相连接并垂直于电极板。
1.3 分析方法
1.3.1钾汞齐中钾的含量
用水银采样器,取电解生成的钾汞齐试样2~5 g于150 mL 烧杯中[15];向钾汞齐中加入0.05 mol/L的硫酸标准液5~15 mL,激烈震荡至无气泡产生为止。再加入质量分数为0.1%甲基橙标准液2~3滴,用0.05 mol/L氢氧化钠标准溶液滴定至橙红色为终点。
1.3.2电流效率的计算
根据电流效率的定义,总电流效率代表第r过程在消耗总电量中的分数。
(5)
式中:F为法拉利常数,96 500, C/mol;Qr为电解生成汞齐的反应所消耗的电量,C;Q为过程中消耗的总电量,C;I为电解过程中的电流,A;t为电解时间,s;η为电流效率,%;Δn(K+)为电解过程中钾离子物质的量变化值,mol;Δυ(K+)为电解过程中依照电解反应式钾离子的系数的变化值。
1.3.3总碱含量的测定
用吸管吸取质量为W的混合液样品放入烧瓶中,将容量瓶定容至50 mL,再转移至锥形瓶中[16]。加入3滴酚酞指示剂,用C为0.5 mol/L的盐酸标准溶液滴定至无色,记下所用盐酸的体积V。
总碱%=(V×C×0.070 1)/W×100%
(6)
1.3.4游离碱的测定

(7)
式中:m为水分质量,μg;W为样品质量,g。
1.3.5甲醇钾的计算
甲醇钾%=总碱%-游离碱%×70.1/56.1
(8)
1.4 电解生成汞齐
将约70 mL金属汞倒入电解池中,使电解池底部铺上薄薄一层汞,汞层的厚度以其流动时不露出底层钢板为标准,然后将配置好的碳酸钾溶液注入电解池中。汞通过底层钢板与整流器的负极连接,作为电解池的阴极;以氧化铱为涂层的金属钛电极板与整流器的正极连接,作为电解池的阳极。
接通电源,开始电解。电解时不断通入新鲜的碳酸钾溶液,被电解反应稀释的碳酸钾溶液从电解槽的溢流口流出,以使电解液的浓度基本保持不变。在远离汞齐出口的电解池一端不断注入纯汞,尽量使纯汞的流速与钾汞齐流出的速度相同,以保证阴极汞处于流动的状态,并能方便收集生成的钾汞齐。
1.5 电解产物分析
记录反应时间,反应结束后称量生成的钾汞齐的质量,分析钾汞齐的浓度(钾汞齐中金属钾的质量分数),计算电解过程的电流效率。
1.6 合成甲醇钾
将最适宜电解条件下生成的钾汞齐加入到盛有甲醇的四口烧瓶中[17],在催化剂质量分数0.5%、反应温度60 ℃的最适宜反应条件[18]下搅拌反应,反应过程中不断有氢气生成,气泡停止生成,反应即停止。
1.7 产品分析
对最终生成的甲醇钾进行分析,分析甲醇钾溶液中的水分质量分数及产品中甲醇钾的质量分数[19-20]。
2 结果与讨论
2.1 单因素试验及结果
2.1.1反应时间的影响
在20 ℃、阴极电流密度1.6 kA/m2、控制钾汞齐的质量分数为0.2 %、电解液碳酸钾的浓度0.5 mol/L的条件下进行电解,结果如图1所示。

图1 反应时间对电流效率的影响Fig.1 Effect of reaction time on the current efficiency
由图1可见,在0~10 min内,随着反应的进行,电流效率逐渐增加,但增加的幅度逐渐降低;电解10 min后,电流效率的增加开始不明显,趋于不变。
2.1.2钾汞齐浓度的影响
在20 ℃、电解液浓度0.5 mol/L、阴极电流密度1.6 kA/m2条件下,控制钾汞齐的质量分数在0.1%~0.4 %之间,电解10 min后,结果如图2所示。

图2 钾汞齐的浓度对电流效率的影响Fig.2 Effect of potassium’s content on amalgam potassium on the current efficiency
从图2可以看出,随着钾汞齐浓度的增加,电流效率呈现先增后减的趋势,钾汞齐的浓度在0.20%~0.25%时,电流效率可以达到较高的水平。
2.1.3阴极电流密度的影响
在20 ℃、电解液浓度0.5 mol/L、钾汞齐的质量分数为0.3 %的条件下,控制阴极电流密度在1.2~2.0 kA/m2之间,电解10 min后,结果如图3所示。
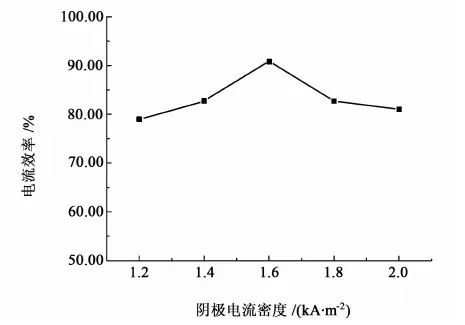
图3 阴极电流密度对电流效率的影响Fig.3 Effect of cathode current density on the current efficiency
从图3可以看出,随着阴极电流密度的增加,电解过程的电流效率呈现先增后减的趋势,在阴极电流密度为1.6 kA/m2左右电流效率较大,在90%以上,故电解使采用的阴极电流密度为1.6 kA/m2。
2.1.4电解温度的影响
控制阴极电流密度为1.6 kA/m2、电解液浓度为0.5 mol/L、钾汞齐质量分数为0.2%、在不同温度(20~60 ℃)下电解,反应10 min后,结果如图4所示。

图4 电解温度对电流效率的影响Fig.4 Effect of temperature on the current efficiency
从图4可以看出,电解温度对电流效率的影响较小,在20~60 ℃之间电流效率的变化不大,可根据实际操作条件适当选取。
2.1.5电解液浓度的影响
在20 ℃、阴极电流密度为1.6 kA/m2、钾汞齐质量分数为0.2%条件下,分别用浓度为0.5、1.0和2.0 mol/L的电解液进行电解,结果如图5所示。
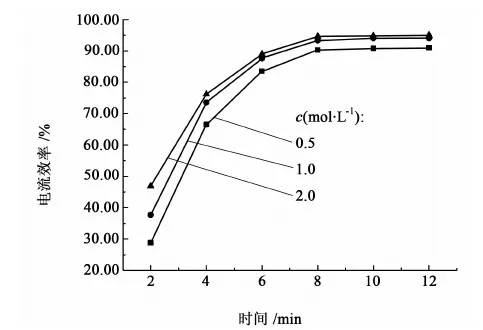
图5 电解液浓度对电流效率的影响Fig.5 Effect of electrolyte’s concentration on the current efficiency
从图5可以看出,在0.5~2.0 mol/L之间,随着电解液浓度的增加,电流效率逐渐增加,但是电解液浓度越高,这种增加幅度越是不明显,考虑到电解难度与资源节约,采用浓度为1.0 mol/L的碳酸钾溶液作为电解液即可达到较好的效果。
2.2 利用正交法确定电解的最适宜条件
对电解温度(A)、ω(钾汞齐)(B)、电解液的浓度(C)、阴极电流密度(D)4个因素,分别取3个水平进行正交试验,以电解过程的电流效率为标准,通过所得的试验结果得到最适宜电解条件。结果如表1和表2所示。
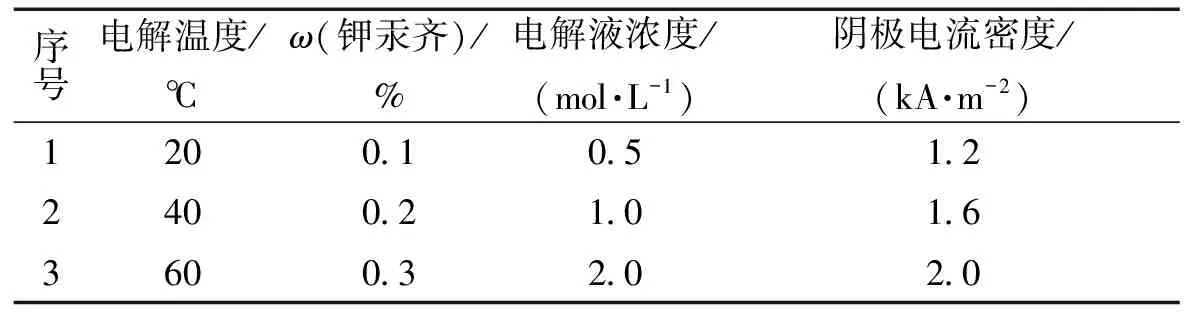
表1 正交试验因素表Table 1 Factors and levels of orthogonal experiment
表2中,因素A为电解温度,℃;因素B为钾汞齐浓度,%;因素C为电解液浓度,mol/L;因素D为阴极电流密度,kA/m2。
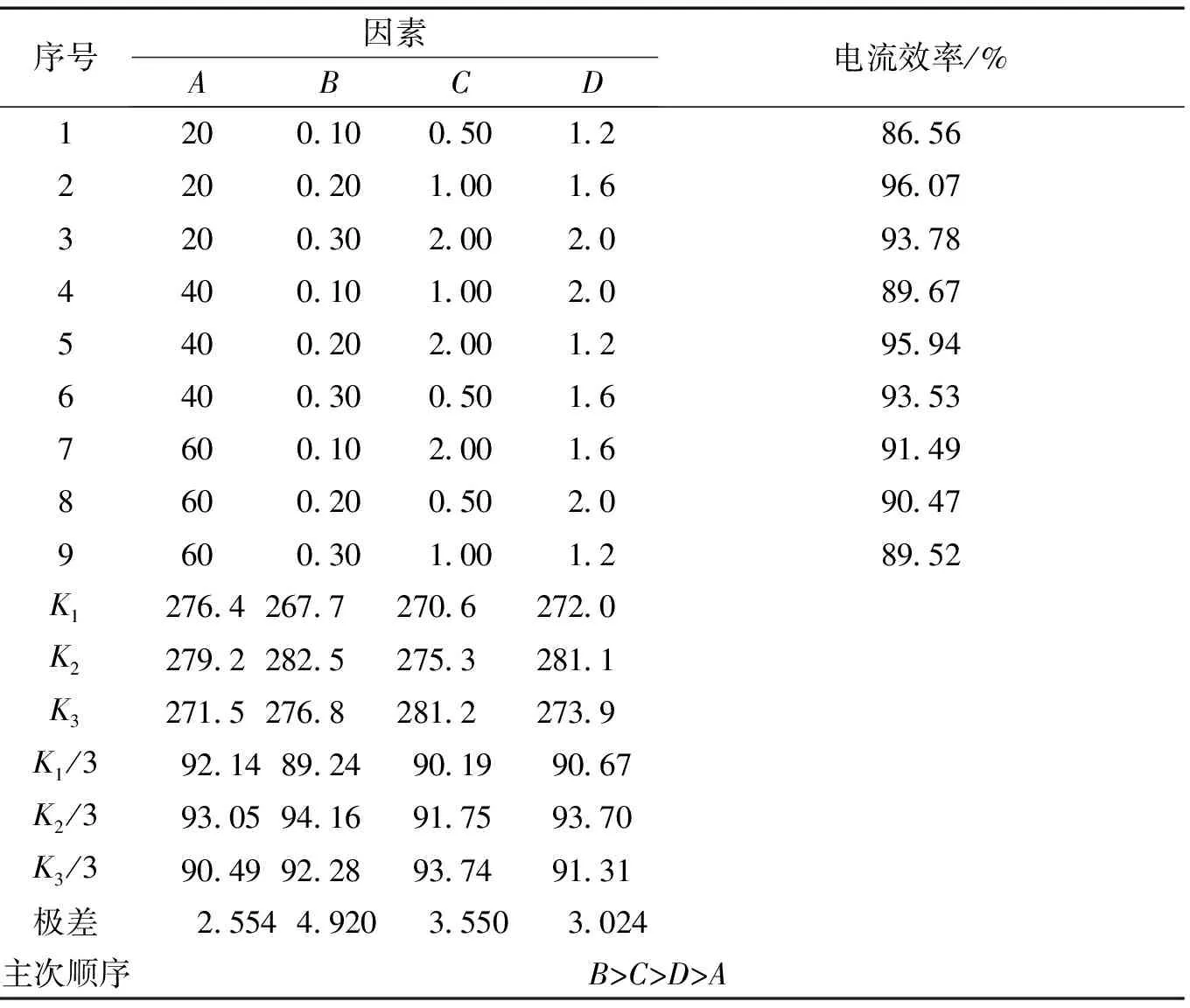
表2 正交试验结果表Table 2 The result of the orthogonal experiment
从表1和表2分析得出,钾汞齐的浓度对电流效率的影响最大,电解温度对电流效率的影响最小。考虑到由于温度越高,能耗越大,但是对电流效率的影响不大。在0.5~2.0 mol/L之间,随着电解液浓度的增加,电流效率逐渐增加,但是电解液浓度越高,这种增加幅度越是不明显,考虑到电解难度与资源节约,所以结合实际情况,最适宜电解条件取电解温度20 ℃、阴极电流密度1.6 kA/m2、电解液碳酸钾浓度1.0 mol/L、钾汞齐质量分数为0.2 %,电解10 min以上,可得到较为理想的电流效率。
3 甲醇钾制备结果与讨论
将最适宜电解条件下电解产生的钾汞齐170 g放入四口烧瓶,在60 ℃、20 mL甲醇和占体系总质量的0.5 %催化剂的条件下反应,结果如表3所示。

表3 钾汞齐的浓度和反应溶液中甲醇钾的含量Table 3 Potassium’s content in amalgam potassium and potassium methylate’s content in solution
从表3可以看出,最适宜电解条件下生成的钾汞齐与甲醇反应可以得到较高的收率,生成的甲醇钾质量分数高,水分质量分数基本保持不变,可以满足电解-合成反应联合生产的要求。
4 结论
1)此方法解决了钾汞齐生产甲醇钾的过程中钾汞齐制备的问题,电解法制备汞齐避免了昂贵金属钾的使用,生产成本大大降低。
2)通过单因素试验和正交试验,确定了电解的最适宜条件:温度20 ℃、ω(钾汞齐)为0.2 %、电解液碳酸钾溶液的浓度为1.0 mol/L、阴极电流密度为1.6 kA/m2,此条件下电解10 min以上即可达到95 %以上的电流效率。
3)该方法生产出的甲醇钾质量分数高,实现了电解法生产甲醇钾的工艺。
参考文献:
[1]沈明亮.高纯度甲醇钾制备工艺:中国,200710112917.0[P].2007-09-04
[2]孙宝远,张炳胜.一种生产甲醇钾的方法:中国,021101744[P].2002-03-13
[3]SCHECHTER W H.Production of alkali metal alkoxides:US,3053906 [P].1962-09-11
[4]HARFORD W E.Preparation of potassium alcoholates:US,2451945 [P].1948-10-19
[5]LODER D J,LEE D D.Preparation of alkali metal alkoxides:US,2278550 [P].1942
[6]LENZ A,GERSTENKAM P, BLETH O.Production of alkali metal alcoholates:US,341838 [P].1968-11-24
[7]ADAMS R G,BOMMARAJU T V,FRITTS S D.Method of denuding sodium mercury amalgam and producing sodium alcoholates:US,5262133 [P].1993- 11-16
[8]HAMANN C H,HELLING J.Process for preparing alkali metal alkoxides of higher alcohols:US,6191319B1 [P].2001-02-20
[9]苑金岐.醇钾、醇钠市场调研报告[J].化工科技市场,2004,8:39-42

[11]张万东,张凤才,聂建明.高纯汞齐的制备及其在可逆电池中的应用[J].实验室科学,2008,3:63-65
[12]HAMANN C H,SCHMITTINGER P,HELLING J.Process for electrolytically producing metal-amalgam:US,6294070 B1 [P].2001-09-25
[13]陈金水.自制GK-1700型小水银电解槽的实际应用[J].安徽化工,1996,83(2):56-59
[14]GERBER A,LESCHHORN O.Improved process for making alcoholic solutions of alkali-metal alkoxides:US,2761880 [P].1956-09-04
[15]胡贝尔G,皮特H,施勒-阿恩德特K.用电化学从碱金属汞齐中生产碱金属:中国,98123009.1 [P].2000-08-02
[16]孙向东,孙旭东,张慧波,等.利用金属钠制备甲醇钠的生产工艺[J].化工生产与技术,2003,10(5):35-37
[17]陈卧岗.甲醇钠/甲醇溶液的生产工艺浅析[J].甲醛与甲醇,2003,(6):7-9
[18]丁军委,孙国庆.钾汞齐合成甲醇钾工艺的研究[J].化工中间体,2006,(10):19-22
[19]陈卧岗.工业甲醇钠-甲醇溶液水分测定方法探讨[J].化工生产与技术,2002(3):38-39
[20]EVDOKIMOV A N,KURZIN A V,PLATONOV A Y,etal.Acid-Base equilibrium in the K2SO3-methanol system[J].Russian Journal of General Chemistry,2002,72(6):1 046-1 046
