LOX-1基因多态性与浙东地区汉族人群冠心病不相关
2012-04-03周军波许丽敏徐卫峰陈治奎姜庆军胡万英廉姜芳葛世俊周建庆
周军波 许丽敏 杨 曦 徐卫峰 陈治奎 姜庆军 胡万英 廉姜芳 葛世俊 周建庆
已有大量证据表明血凝素样氧化低密度脂蛋白受体(lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)与血管炎症、动脉粥样硬化斑块形成、进展和不稳定有关。国内外的多个研究均证实,LOX-1可以被氧化低密度脂蛋白(oxidized lowdensity lipoprotein,oxLDL)、血管紧张素Ⅱ等多种介质所诱导,并且在糖尿病、高血压、血脂紊乱等疾病状态中表达增加。国外已有多个对LOX-1基因多态性与冠心病发病风险的研究,但由于种族、病例数等的差别,得到的结果有较大差异,特别是针对国内人群所开展的相关研究,目前还较少,因此开展这方面的深入研究很有必要。本研究旨在研究LOX-1基因外显子4 G501C单核苷酸多态性与冠心病发病的相关性,初步探讨遗传因素对冠心病的影响。
材料与方法
1.对象:选择2008年5月~2010年4月于宁波市医疗中心李惠利医院心内科住院的患者。其中CAD患者159例为CAD组(男性116例,女性43例,平均年龄64.0±10.1岁),所有病例均经冠状动脉造影证实至少一支冠状动脉狭窄≥50%。选择经冠状动脉造影排除冠心病者106例为对照组(男性49例,女性57例,平均年龄≥59.0±10.0岁)。以上受检者均为浙东地区汉族人,排除先天性心脏病、心肌病和严重肝、肾疾病。
2.方法:(1)提取基因组DNA:取得患者知情同意后,于冠脉造影时抽取动脉血10m l,EDTA抗凝。常规苯酚-氯仿法抽提白细胞基因组DNA,TE溶解。紫外分光光度仪(Amersham,美国热电)测定DNA纯度与浓度后,-20℃保存。(2) PCR扩增:采用4管 SYBR-PCR结合融解曲线方法,对G501C进行等位基因型的检测,具体引物序列及样品设置参见文献[1]。根据人Lox-l基因(GenBank:DQ314885)序列,利用Primer 5.0对引物进行验证。引物序列由大连宝生物工程技术服务公司合成。每个样品设立4个定量PCR检测管,分别加入不同的上下游引物用于检测健康和突变的等位基因,同时设立阳性和阴性对照。PCR反应体系为:mix 9ml(已加入SYBR GREEN染料),上下游引物各0.4μl,DNA模板1μl,加双蒸水至总体积20μl(荧光定量PCR试剂盒购自天根生化科技有限公司)。在iCycler iQ PCR扩增仪(BIO-RAD,美国)进行PCR扩增。两个位点PCR反应条件均为:95℃预变性1min,然后按94℃ 30s、58℃ 30s、72℃ 40s进行40个循环,终末延伸72℃ 5min。扩增循环结束后,对PCR产物以0.5℃/s做55℃到95℃的融解曲线分析。根据定量PCR仪的分析软件获得的Ct值和融解曲线分析结果来判定样品的SNP类型。反应结束后,取PCR产物经2%琼脂糖凝胶电泳,凝胶成像分析仪(BIO-RAD Quantity one,美国)验证PCR扩增产物的单一性。(3)样本测序:随机选取50例样本,提供引物及PCR产物,由南京金斯瑞生物科技有限公司测序,以验证荧光定量PCR检测结果。G501C位点测序引物为上游: 5'-CACAAACATAACTGACTGATGAG-3',下游:5'-TAGAGATACTACAGAGCCTGTCC-3',PCR产物:356bp。
3.统计学方法:数据用SPSS 12.0统计软件进行分析,P值用CLUMP22软件计算。各组基因型及等位基因频率用χ2检验,利用拟合优度χ2检验的方法检验基因频率是否符合Hardy Weinberg遗传平衡定律。计量资料组间均数比较采用t检验。P<0.05为差异有统计学意义。
结果
1.对两组冠心病危险因素进行比较:结果显示,吸烟史和高血压史在冠心病组显著高于对照组(P<0.01),而糖尿病史和冠心病家族史两组之间的差异无统计学意义(P>0.05)(表1)。
2.每个样品进行4个平行的定量PCR反应:分别获得阳性、阴性对照及两种等位基因扩增产物的Ct值和融解曲线分析结果。图1A显示,检测突变型和阳性对照的PCR产物的Ct值一致,而检测野生型和阴性对照的PCR产物的Ct值接近,融解曲线分析结果一致,DNA测序结果显示该样品DNA等位基因是501CC。图1B显示检测野生型、突变型和阳性对照的PCR产物的Ct值一致,融解曲线分析结果一致,DNA测序结果显示该样品DNA等位基因是501GC。图1C显示,检测野生型和阳性对照的PCR产物的Ct值接近,大约是23.7;而检测突变型和阴性对照的PCR产物的Ct值接近,大约是28.2。融解曲线分析结果与Ct值一致。DNA测序结果显示该样品等位基因是501GG。定量PCR的基因分型结果与DNA测序结果均相符。
3.研究对象的G501C位点的基因型分布:经拟合优度χ2检验符合Hardy-Weinberg平衡,表明患者来自同一群体。
4.G501C基因多态性在CAD组及对照组中均存在G/G、G/C、C/C 3种基因型:其中G/G、G/C、C/C 3种基因型在CAD组与对照组分别占62.3%、35.8%、 1.9%和64.2%、33.0%、2.8%,进行χ2检验。CAD组 与对照组比较,差异无统计学意义(P>0.05)(表2)。

图1 SYBR-GREEN荧光定量PCR对LOX-1外显子4501G>C的基因分型及对应的DNA测序荧光定量PCR结果和DNA测序结果相对应,A、B、C图依次对应的是CC、GC、GG型

表2 CAD组与对照组G501C基因多态性基因型及等位基因频率分布
讨论
人LOX-1由273个氨基酸组成,包括胞质内N端,跨膜区,胞外的颈区和C型血凝素样结构域。多个证据支持LOX-1对动脉粥样硬化形成起作用。Aoyama等研究了人的LOX-1基因(oxidized lowdensity lipoprotein receptor 1,OLR-1),发现它是一个单拷贝基因,位于12号染色体短臂的p12.3~p13.2区域,由6个外显子和5个内含子组成,共7000个碱基对。外显子4 G501C的基因变化导致了K167N的错义突变。167位氨基酸残基位于LOX-1胞外的C-血凝素样区域,已经有实验表明血凝素样区域对配体的识别和结合很重要[2]。Ohmori等人检测了586名进行冠脉造影的患者G501C的基因多态性发现,病例组CC+CG基因型频率明显低于正常/轻微狭窄组(36%vs 49%,P<0.01)。按照冠心病严重程度分级,CC+CG基因型频率分别为:正常/轻微狭窄(狭窄<25%)组49%,轻度狭窄(狭窄26%~50%之间)组41%,狭窄>50%的3个亚组中单支病变组39%,2支病变组35%,3支病变组32%,多因素分析显示CC+CG基因型频率与狭窄严重度呈负相关(OR=0.61;95%CI:0.41~0.92)[3]。但在本研究中,G501C基因位点基因型频率和等位基因频率在冠心病组和对照组之间差异均无统计学意义,这与Elisabetta Trabetti、Sentinelli等人的研究结果相符[4,5]。不同的研究得出的结果不同,可能与种族差异、病例数不同有关。
CAD的发病存在着遗传异质性并且受环境因素的影响,不同的基因突变均可能导致CAD,但不同的基因突变引起的临床表型可能不同,如性别差异、CAD中存在的某些特殊的病理或生物学特征即中间表型(这些中间表型能反映其发展早期或中期病理变化的一系列生化或生理性状)、发病年龄和疾病的严重程度等,从而可导致易感基因研究结果的不一致。在多基因疾病中,仅仅一个易感基因并不意味着高风险。事实上,大多数的携带者虽然存在着某些生物学缺陷即中间表型,但并不表现任何的临床症状。
经过搜索PUBMED,EMbase,SpringLink等数据库,以及参考一些研究的文献,将一些研究成果与本研究的结果进行比较,表3列举了G501C基因多态性与CAD相关性的部分研究。从2003年至今选取了10份病例-对照组的研究与本研究的结果进行分析比较,总共分析了5679个病例和15511个对照的情况。
表3和表4分别呈现了显性模式和隐性模式下G501C基因多态性和CAD的关联性。在显性模式下,7个研究(1,3,6,8~11)显示突变降低了CAD的风险,3个已有研究(4,7,9)和本研究显示突变能增加CAD的风险。在隐性模式下,7个已有研究(3,4,6,8~10)和本研究显示突变降低了CAD的风险,而3个研究(1,7,11)显示突变能增加CAD的风险。经过荟萃分析,不管是在显性模式还是隐性模式中,G501C与CAD都没有显著的关联性。

表3 在荟萃分析(显性模式)中G501C和CAD的关系
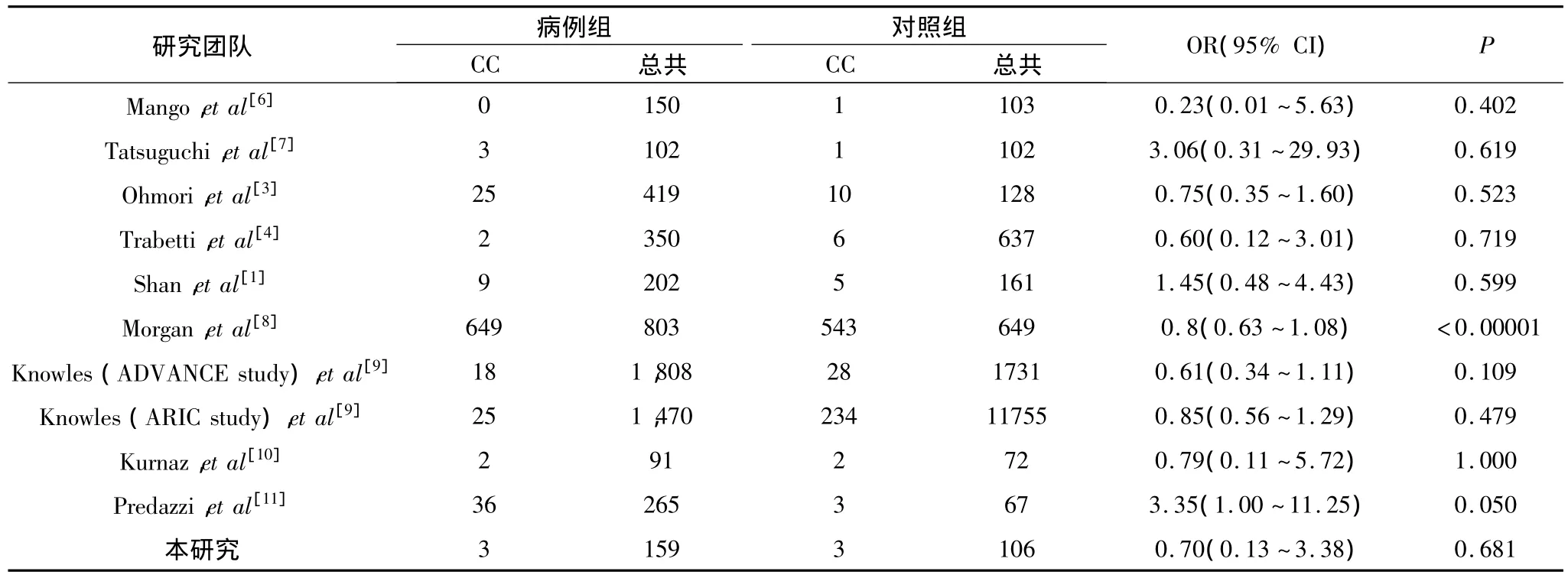
表4 在荟萃分析(隐性模式)中G501C和CAD的关系
可以发现,不同时期和不同国家的研究结果差异很大,这可能跟病例数较少以及种族之间的差异有很大的关联性,因此开展这方面的深入研究非常必要。本研究的总病例数仅265例,如能开展更大规模的研究,应可以得到更加准确的结果。总之,本研究显示LOX-1基因G501C位点的基因多态性与冠心病发病无显著关联。
1 单志新,符永恒,周志凌,等.Lox-1基因501G>C和3'UTR188C>T多态性与急性心肌梗死发病的相关性[J].热带医学杂志,2007,7(11):1048-1051
2 Chen M,Narumiya S,Masaki T,et al.Conserved C-terminal residues within the lectin-like domain of LOX-1 are essential for oxidized low-density-lipoprotein binding[J].Biochem J,2001,355: 289-296
3 Ohmori R,Momiyama Y,Nagano M,et al.An oxidized lowdensity lipoprotein receptor gene variant is inversely associated with the severity of coronary artery disease[J].Clin Cardiol,2004,27:641-644
4 Elisabetta T,Michele B,Ugo C,et al.On the association of the oxidised LDL receptor 1(OLR1)gene in patients with acute myocardial infarction or coronary artery disease[J].European Journal of Human Genetics,2006,14:127-130
5 Sentinelli F,Filippi E,Fallarino M,et al.The 3'UTR C>T polymorphism of the oxidized LDL-receptor1(OLR1)gene does notassociate with coronary artery disease in Italian CAD patientsorwith the severity of coronary disease[J].Nutr Metab Cardiovasc Dis,2006,16:345-352
6 Mango R,Clementi F,Borgiani P.Association of single nucleotide polymorphisms in the oxidised LDL receptor 1(OLR1)gene in patients with acute myocardial infarction[J].JMed Genet,2003,40: 933-936
7 TatsuguchiM,Furutani M,Hinagata J,et al.Oxidized LDL receptor gene(OLR1)is associated with the risk ofmyocardial infarction[J].Biochem Biophys Res Commun,2003,303:247-250
8 Morgan TM,Krumholz HM,Lifton RP,et al.Nonvalidation of reported genetic risk factors for acute coronary syndrome in a largescale replication study[J].JAMA,2007,297:1551-1561
9 Knowles JW,Assimes TL,Boerwinkle E,et al.Failure to replicate an association of SNPs in the oxidized LDL receptor gene(OLR1)with CAD[J].BMCMed Genet,2008,9:23
10 Kurnaz O,Aydogan HY,Isbir CS,et al.Is LOX-1.K167N polymorphism protective for coronary artery disease?[J].In Vivo,2009,23: 969-973
11 Predazzi IM,Martinez-Labarga C,Vecchione L,et al.Population differences in allele frequencies at the OLR1 locus may suggest geographic disparities in cardiovascular risk events[J].Ann Hum Biol,2010,37:136-148
