乳腺癌组织血清NF-κB p65表达分析及临床意义
2012-04-03杨明峰李志国孙红岗董学君
杨明峰 李志国 孙红岗 董学君
NF-κB作为调节多种蛋白转录的转录因子,在乳腺癌的发生和发展过程中起十分重要的作用[1,2]。目前有不少的国内外文献报道NF-κB p65 mRNA在癌组织中高表达,且与癌症转移相关[3,4];但NF-κB p65血清蛋白表达是否与组织mRNA表达一致,血清表达与病理特征有何关系,结果尚不一致。本文用ELISA法、RT-PCR法和Western blotting法检测乳腺癌患者血清NF-κB p65、组织NF-κB p65 mRNA及NF-κB p65蛋白的表达,分析组织和血清中的表达是否一致,血清学检测与临床病理特征有何关系,评价血清NF-κB p65在乳腺癌诊断和治疗中的应用价值。
材料与方法
1.材料:收集笔者医院2009年6~9月41例乳腺癌手术组织(病理诊断明确,术前未做过放疗和化疗),癌旁组织和15例乳腺良性肿块组织为对照组(经HE染色观察图1)。收集上述乳腺癌患者血清,另收集39例乳腺癌患者血清,60例乳腺良性肿块和正常人血清为对照组。收集的组织和血清标本经分装后分别保存于液氮和-80℃冰箱。80例患者均为女性,年龄31~77岁,病理类型见表2。NF-κB p65 ELISA试剂盒(美国RD公司),Trizol总RNA提取液(上海闪晶分子生物技术研究所),Takara primeScriptTMRT-PCR Kit(大连宝生物工程有限公司),PARISTM Kit(美国AMBION公司),兔抗人NF-κB p65多抗(MILLIPORE公司)、兔抗人β-actin多抗(SANTA CRUZ公司)HRP-羊抗兔的IgG(SANTA CRUZ公司),Bradford检测试剂盒(北京索莱宝科技有限公司)。
2.免疫组织化学方法及阳性结果判定:石蜡标本4μm厚连续切片,脱蜡,采用高温、高压修复抗原,组化染色按SP试剂盒说明书进行。用PBS液代替一抗作为空白对照。ER、PR、Her-2均以细胞核和(或)胞质出现棕黄色细颗粒为阳性细胞,阳性细胞<15%为-,15%~25%为+,25%~45%为++,>45%为+++。背景无颜色或淡黄色。
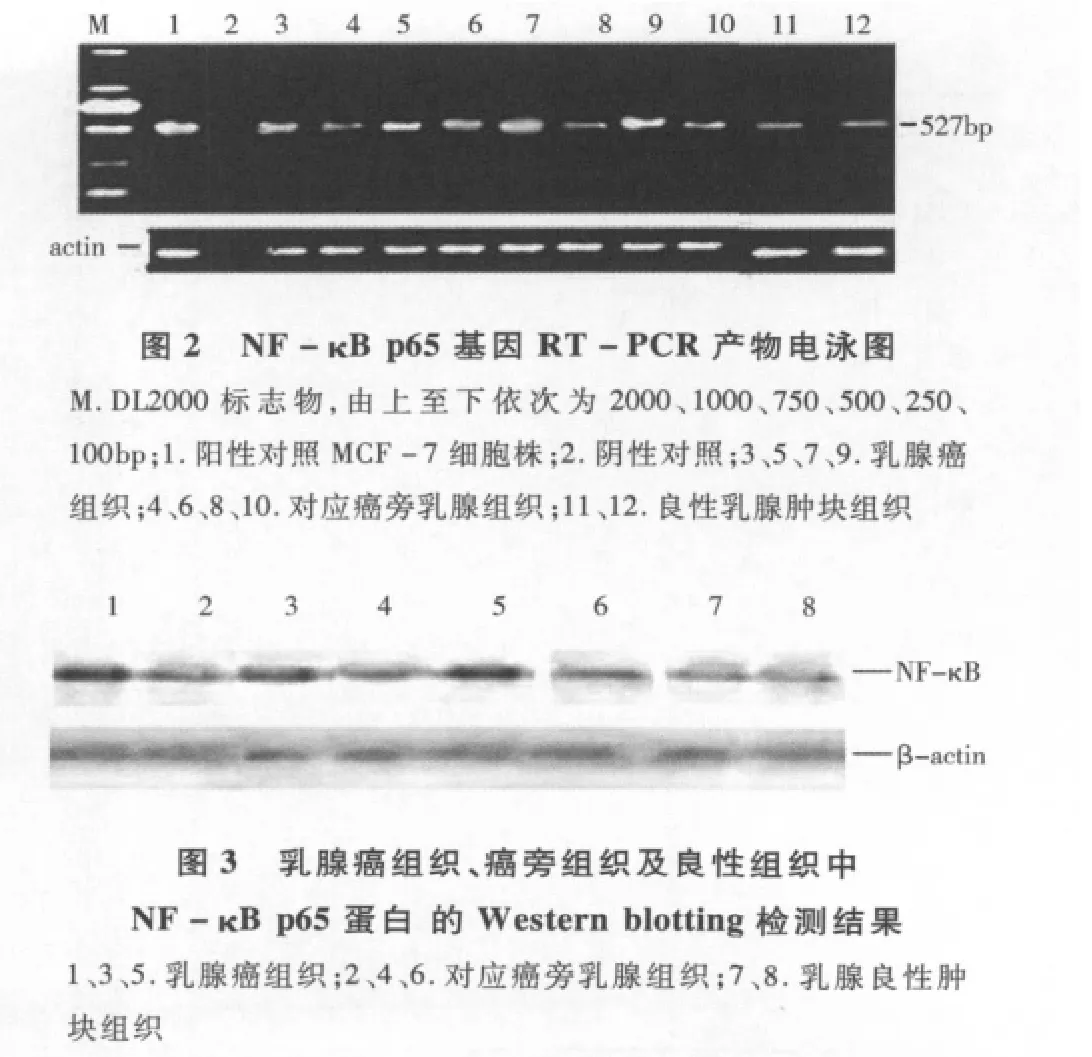
3.组织NF-κB p65 mRNA的RT-PCR检测:乳腺癌、癌旁、乳腺良性肿瘤组织中总RNA的提取参照Trizol使用说明书。总RNA 1μg反转录为cDNA,反应条件:30℃10min,42℃30min,95℃ 5min。PCR扩增NF-κB p65/β-actin mRNA,引物由上海生工生物工程(上海)有限公司合成,序列如下:①NF-κB p65:上游引物5'-TGCCGAGTGAACCGAAAC-3',下游引物5'-TGCCCAGAAGGAAACACC-3',目的片段长度为527bp;②β-actin:上游引物5'-TTCCTTCTTGGGTATGGAAT-3',下游引物5'-GAGCAATGATCTTGATCTTC-3',目的片段长度为200bp。扩增条件:95℃3min预变性,94℃30s,60℃30s,72℃1min,35个循环;72℃ 7min延伸。阳性对照为乳腺癌细胞株MCF-7,用蒸馏水作为阴性对照。取5μl PCR扩增产物与1μl6×Loading buffer液混合均匀后进行1%的琼脂糖凝胶(溴化乙锭10mg/ml)电泳,计算机扫描成像判断结果。结果判断:样本琼脂糖电泳照片采用Quantity one分析软件进行灰度扫描,测定待测样本和内参β-actin的积分光密度(IA)。样本量的数值以目的片段IA/β-actin的IA的比值来表示。以乳腺癌(良性肿瘤)病灶组织的积分光密度比值/对应灶旁正常组织的积分光密度比值>1.5为阳性,>1.5以“+”表示,>2以“++”表示。
4.组织NF-κB p65蛋白Western blotting检测:乳腺癌、癌旁、乳腺良性肿瘤组织中蛋白质样品的制备参照PARISTM Kit使用说明书。采用Bradford法检测蛋白提取液的浓度。蛋白提取液与上样缓冲液按3∶1混匀,100℃变性5min,上样至12%SDS聚丙烯酰胺凝胶电泳2.5h;湿转法将蛋白转移至PVDF膜上;用含2%BSA的PBST封闭1.5h;用含兔抗人NF-κB p65多抗(1∶500)、兔抗人β-actin多抗(1∶500)一抗孵育液4℃过夜,PBST漂洗,HRP-羊抗兔的IgG(1∶300)室温孵育2h,PBST、PBS漂洗后用ECL发光试剂在暗室压片显色。结果判断:胶片经扫描后,采用Quantity one分析软件进行灰度扫描,具体方法类同于RT-PCR检测的积分光密度比值>1.5为阳性(+)。
5.血清NF-κB p65的ELISA检测:操作方法见试剂盒说明。浓度>40ng/ml为阳性,>40ng/m l为(+);>80ng/ml为(++)。
6.统计学方法:采用SPSS 11.0统计软件分析,计量资料采用均数±标准差±s)表示,采用t检验;计数资料采用χ2检验,Kappa一致性检验及Spearman秩相关分析,以P<0.05为差异有统计学意义。
结果
1.组织HE染色结果:显微镜下观察发现,41例癌组织标本癌细胞均占70%以上,而癌旁组织中无癌细胞浸润(图1)。

图1 乳腺癌及癌旁组织HE染色(HE,×200)
2.乳腺癌组织NF-κB p65的表达结果:41例乳腺癌组织中NF-κB p65 mRNA和蛋白积光密度比值>1.5的分别为87.9%和82.9% 。乳腺癌组织NF-κB p65 mRNA的RT-PCR产物电泳结果表明乳腺癌组织NF-κB p65 mRNA的表达较对应癌旁组织及乳腺良性肿块组织明显增加(图2)。组织Western blotting结果与RT-PCR结果相似,乳腺癌组织NF-κB p65蛋白表达较对应癌旁组织及乳腺良性肿块组织明显增加(图3)。
3.血清NF-κB p65的表达及其与组织NF-κB p65表达的关系:乳腺癌患者血清中NF-κB p65的含量(46.4±26.13ng/ml)明显高于对照组(22± 16.5ng/ml),两者差异有统计学意义(P<0.05)。血清NF-κB p65与组织NF-κB p65表达同为“+”的23例,同为“++”的4例,同为“-”的3例。采用Kappa一致性检验,Kappa=0.458,95%可信区间(0.319,0.630),可以认为具有一致性。采用相关(P<0.05),Spearman秩相关分析,rs=0.369,P<0.05,表达一致率为73.2%(表1)。

表1 血清与组织中NF-κB p65表达的相关性
4.血清NF-κB p65与患者临床病理特征之间的关系:80例乳腺癌患者血清NF-κB p65阳性率为80%,对照组为13.3%(表2)。不同年龄段、TNM分期和ER、PR表达情况的血清NF-κB p65表达差异均无统计学意义。而不同淋巴结转移程度及Her-2表达状况的血清NF-κB p65表达差异有统计学意义(P<0.05)。
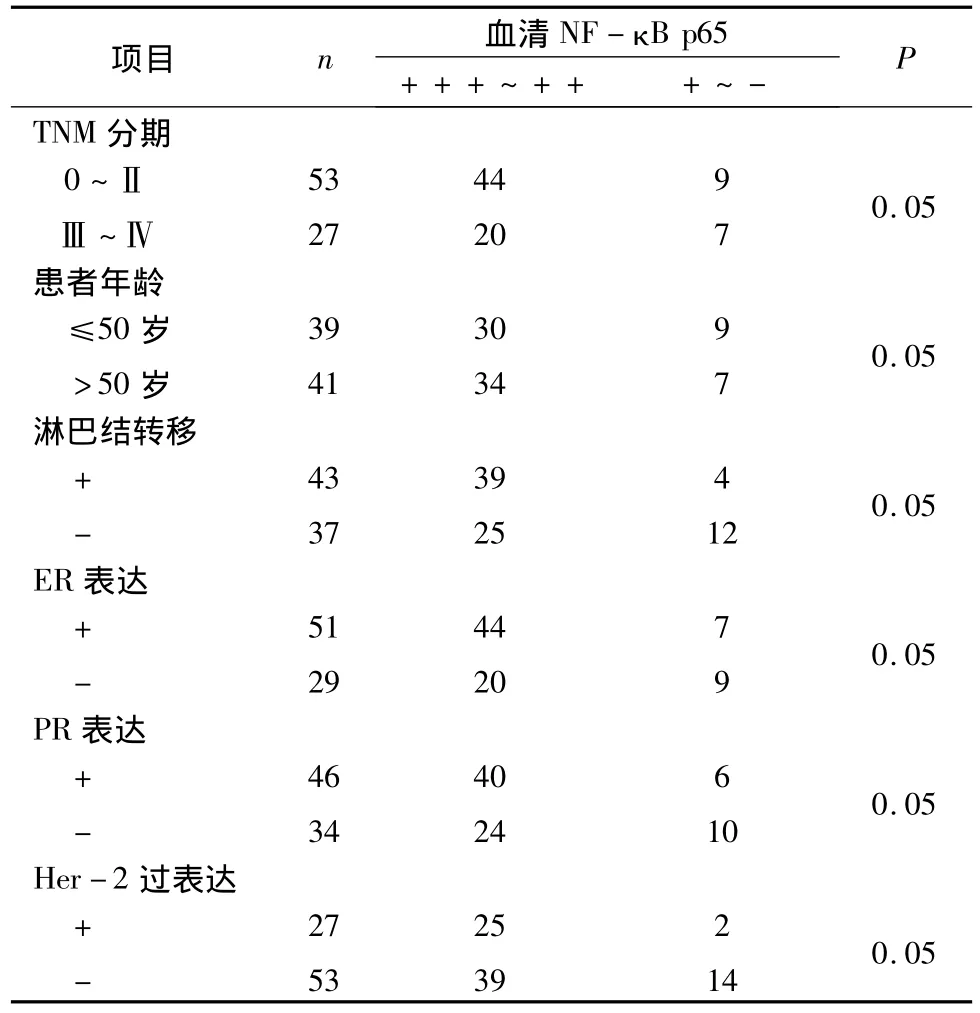
表2 血清NF-κB p65表达与乳腺癌临床病理指标的关系
讨论
NF-κB是具有多种生物活性的转录因子,正常细胞中NF-κB主要存在于胞质,与IκB结合,形成无活性的三聚体。当细胞受刺激时,NF-κB主要通过p65亚基在细胞核中调控多种基因的表达,在肿瘤形成和转移过程中发挥重要作用[5]。本研究结果表明,与对照组比(含良性肿块),NF-κB p65 mRNA和蛋白在乳腺癌组织中表达均明显升高,与文献报道的一致[6,7]。由于大部分肿瘤相关抗原可分泌入血液,血清学检测简单快速,且血清标本可在未手术时取得,减小对患者的创伤性。本研究检测了血清NF-κB p65浓度,发现乳腺癌患者NF-κB p65表达明显高于对照组,而且Kappa一致性检验结果表明乳腺癌患者NF-κB p65血清表达与组织表达具有一致性,提示检测血清NF-κB p65浓度可部分反应组织NF-κB的活性,对诊断恶性乳腺癌具有一定的价值。我们采用HE染色法对收集的标本进行选择,癌组织中癌细胞率在70%以上,而癌旁组织则无癌细胞浸润,降低了实验取材误差,然而我们还是发现癌旁组织NF-κB p65有一定程度的表达;同时Kappa系数一般要>0.7时,才表明吻合度好,所以血清检测不能完全取代组织NF-κB p65检测,这与癌旁炎症细胞表达NF-κB p65是否有关,需进一步研究。
目前多数国内外的研究表明,乳腺癌组织NF-κB p65的表达与乳腺癌的转移及Her-2高表达相关,本研究结果进一步表明乳腺癌患者血清NF-κB p65的表达与乳腺癌的转移及Her-2高表达相关,而这两个临床病理特征代表着乳腺癌的恶性程度,因此血清NF-κB p65检测可能是评判乳腺癌预后的指标之一。文献报道癌细胞NF-κB的表达与雌激素受体表达之间不一致,Jones等[6]认为NF-κB p65与ER、PR表达负相关,而Frasor等认为ER阳性时能增加NF-κB的活性,我们的研究表明血清NF-κB p65的表达与雌激素受体表达的相关性尚无统计学意义,因此我们认为血清NF-κB p65尚不能作为雌激素受体表达情况的预判指标。
总之,乳腺癌患者血清NF-κB p65浓度与对照组相比明显升高,且血清浓度能部分反应组织NF-κB p65的表达。同时血清学指标与临床病理特征关系的分析表明,血清NF-κB p65表达检测对预测乳腺癌转移与否和选择治疗方案也有一定的价值。
1 Vonach C,Viola K,Giessrigl B,et al.NF-κB mediates the 12(S)-HETE-induced endothelial to mesenchymal transition of lymphendothelial cells during the intravasation of breast carcinoma cells[J].Br JCancer,2011,105(2):263-271
2 Liu M,Sakamaki T,Casimiro MC,et al.The canonical NF-kappaB pathway governsmammary tumorigenesis in transgenic mice and tumor stem cell expansion[J].Cancer Res,2010,70(24):10464-10473
3 Bhaumik D,Scott GK,Schokrpur S,et al.Expression ofmicroRNA-146 suppresses NF-κB activity with reduction ofmetastatic potential in breast cancer cellsSuppression of NF-κB activity in cancer cells by miR-146[J].Oncogene,2008,27(42):5643-5647
4 童仕伦,李恒平,魏文.胃癌组织中核转录因子-κB表达与意义[J].中华实验外科杂志,2006,7(23):873-874
5 周洁,陈虎,郑海,等.Celecoxib可通过抑制核转录因子-κB活性诱导SGC7901/ADR细胞的凋亡[J].中华实验外科杂志,2010,9(27):1269-1271
6 Jones RL,Rojo F,A'Hern R,et al.Nuclear NF-κB/p65 expression and response to neoadjuvant chemotherapy in breast cancer[J].JClin Pathol,2011,64(2):130-135
