富勒烯的化学修饰技术及其修饰产物在疾病预报中的应用
2012-03-27李园园李志明郑志勇
李园园,李志明,郑志勇
富勒烯的化学修饰技术及其修饰产物在疾病预报中的应用
李园园1,李志明2*,郑志勇2
(1.漳州科技职业学院,福建 漳州 363202;2.漳州职业技术学院,福建 漳州 363000)
开发了N ,N -二乙基苯胺(DEA)-富勒醇(F)-异硫氰酸荧光素(FITC)磷光标记试剂(DEA-F-FITC)及建立DEA-F-FITC标记伴刀豆凝集素(Con A)亲和吸附(AA)固体基质室温燐光法(AA-SS-RTP)测定AFP-V新方法。该方法的灵敏度高(Pg/mL)为0.13(F)和 0.090(FITC),用于测定人血清样品中AFP-V的含量和人体疾病预报,结果都与酶联免疫法的相吻合。
富勒烯;化学修饰技术;应用
1 引言
肝癌(HCC)是人体最常见的恶性疾病之一。当前HCC的诊断有化学免疫法[1],荧光诊断法[2], 磁性共振法[3], 三维投影放射性疗法[4]等。遗憾的是上述诊断的方法仅处于定性、半定量水平。研究表明,AFP-V含量与原发性肝癌密切相关。Sato 等报道[5],AFP-V升高的肝硬化病人大多数在3~18个月内被诊断为肝癌患者。AFP-V预测HCC发生的正确率为94%[6]。国内外测AFP-V含量的方法有亲和电泳酶免疫法(LD =1.0×10–9ng/mL)[7]、亲和吸附 (LD =9.0×10–10 g/mL)法[8]、时间分辨荧光免疫法(竞争法的LD = 9.4 ×10–10 g/mL,夹心法的LD =3.0×10–10 g/mL)[9]、抗体亲和印迹法(LD< 4.0×10–7g/mL)[10]等。但诸类方法或是操作繁杂、费时、灵敏度不高, 难以满足生物试样中低含量AFP-V测定。显然,探索高灵敏、准确测定AFP-V的新方法与预报HCC,在生命科学领域具有重要学术价值和应用前景。
凝集素、糖、糖链结构的研究已成为当前生物医学领域中的热点和前沿课题。近年来,凝集素作为一种糖基探针,已用于糖蛋白、糖脂、糖结构及碱性磷酸酶研究[11-12]。因此,寻找凝集素的高效标记试剂,已成为生物分析的关键。文献报道了C50Cl10等富勒烯衍生物本身具有一定的发光特性。Caspar和Wang[13]曾用N ,N -二乙基苯胺(DEA)修饰C60,使其荧光大大增强。此研究测量的虽然是荧光信号, 显然其原理对磷光亦是适合的。
实验研究发现,DEA对F、FITC在ACM上发射的室温燐光(RTP)信号有显著的增强作用。由此设想,用DEA修饰F、FITC的产物标记Con A的产物(DEA-F-FITC-Con A)与AFP-V发生AA反应,探索高灵敏AA-SS-RTP测定痕量AFP-V的可能性。本研究为SS-RTP的发展提出新的出路,同时推动富勒烯修饰技术与应用的进展。
2 实验部分
2.1 仪器与试剂
LS-55型荧光分光光度计及固体前表面处理器,仪器参数:Delay 0.1ms,Gate 2.0ms,Cycle 20ms,Flash Count 1,Ex Slit 10nm,Em Slit 15nm,Speed 1500nm/min;KQ-250B型超声波清洗器;AE240型电子分析天平;0.50 µL平头微量注射器。
AFP-V、牛血清蛋白(BSA)、Con A购于sigma 公司,并保存于0-4℃冰箱中。临用时分别稀释成1.00、100.00(pg/mL)AFP-V、700.0 ng/mL Con A、10 mg/mL BSA、1.0×10–5mol/L F[14]; 1.0×10–5moL/L FITC;1%(V/V)DEA;0.10moL/L Na2CO3-NaHCO3缓冲液,0.067mol/L KH2PO4-Na2HPO4缓冲液;0.050mol/L Tris-HCl缓冲液;Tris-HCl-0.1%Tween-20洗涤缓冲液;10.0 mg/mL BSA包被液(0.1mol/L Na2CO3-NaHCO3稀释);Tris(三羟甲基氨基甲烷),HCl,NaCl,Tween-20,1.0 moL/LPb(Ac)2溶液;HAc等。除了BSA为生物试剂外,其余试剂为分析纯,水用三次亚沸蒸馏水。
聚酰胺素膜(PAM)、ACM、硝酸纤维素膜(NCM)购于路桥四甲生化塑料厂。预先剪切成Ф = 1.5 cm的圆片备用。
2.2 实验方法
2.2.1 Con A的标记
用0.50μL微量进样器,将0.4μL不同浓度与用量的Con A(W/V,pH=7.4的KH2PO4-Na2HPO4缓冲溶液稀释)悬空点样在ACM的中心压痕(Ф=4 mm)处,然后取出ACM,在ACM的中心压痕处加0.4μL标记试剂(1.50mL 1% DEA-0.40mL1.0×10–5mol/L F-5.00 mL 1.0×10–5mol/L FITC)乙醇溶液。在37℃时静置反应2h,得Con A与DEA-F-FITC反应而生成的标记产物(DEA-F-FITC-Con A)。取出标记产物,经洗涤液冲洗,超声波振荡重复洗涤3次,除去ACM上未反应的标记试剂,用滤纸吸干,备用。根据DEA-F-FITC-Con A与AFP-V AA反应产物的RTP测量结果,筛选DEA-F-FITC标记Con A的最佳浓度与用量。
2.2.2亲和吸附反应与室温燐光检测
采用夹心法进行亲和吸附反应。在ACM的中心压痕(Ф=4 mm)处,用0.5μL微量进样器点加0.40μL的Con A于同一压印痕处, 于4℃下放置过夜, 继而在BSA包被液中37℃浸泡0.5 h,用0.50μL微量进样器将0.4μL不同浓度的AFP-V溶液(用pH=9.12 Na2CO3-NaHCO3缓冲溶液逐级稀释)悬空点样在PAM的中心压痕(Ф=4 mm)处,于37℃下温育2 h,再洗涤3次,用滤纸吸干;然后点加0.4μL已标记的Con A (DEA-F-FITC-Con A)于同一印痕处,于37℃下温育2 h,再洗涤3次,用滤纸吸干;浸入Pb(Ac)2溶液中,10s后取出,于(90 ±1)℃下干燥2min,扫描其燐光光谱,记录试剂空白(DEA-F-FITC-Con A+Con A)的p1和试样(DEA-F-FITC-Con A- AFP-V- Con A)的p2,平行测定7份,计算∆p(p2-p1)。
2.2.3样品处理
取1.00 mL A、B、C、D、E、F人血清,加入0.50mL 0.05 mol/L Tris-HCl缓冲液(含0.50 mol/L NaCl),混匀10min,离心弃上清液后,再加入1.0mL缓冲液。混匀10min,置于4℃备用。然后加入Sepharose 4B 吸附剂,离心弃上清液,用0.010mol/LTris-HCl 缓冲液稀释至pg级,在振荡器上振摇300 r/min 20min。经200 r/min离心5min,按实验方法测定上清液中的AFP-V同时做加入标准回收率实验,并与漳州市中医院ELSIA法临床检测的结果比较。
3 结果与讨论
3.1 亲和吸附产物的SS-RTP光谱


图1 DEA- F-FITC-Con A-AFP-V- Con A法磷光光谱(F)
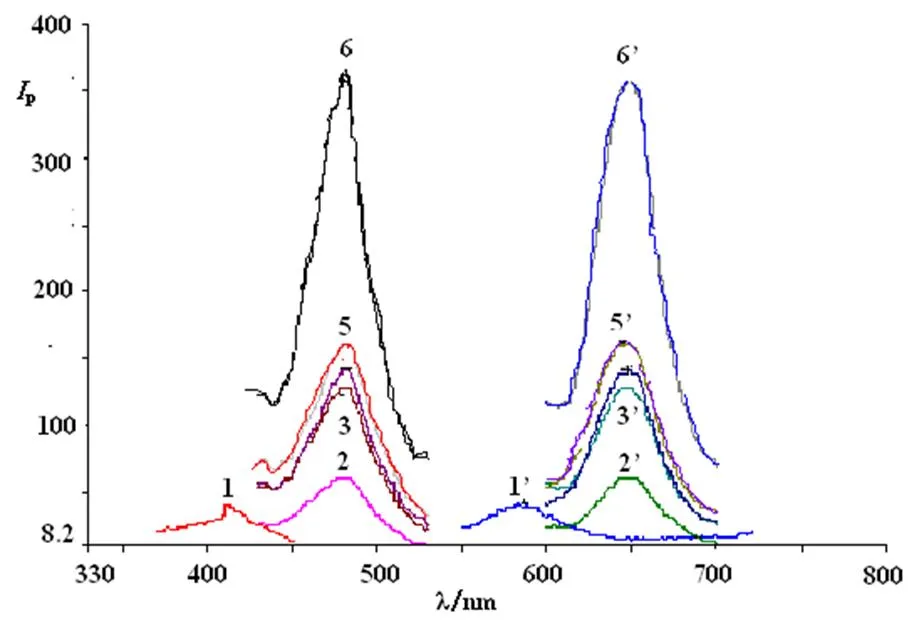
图2 DEA- F-FITC-Con A-AFP-V- Con A法磷光光谱(FITC)
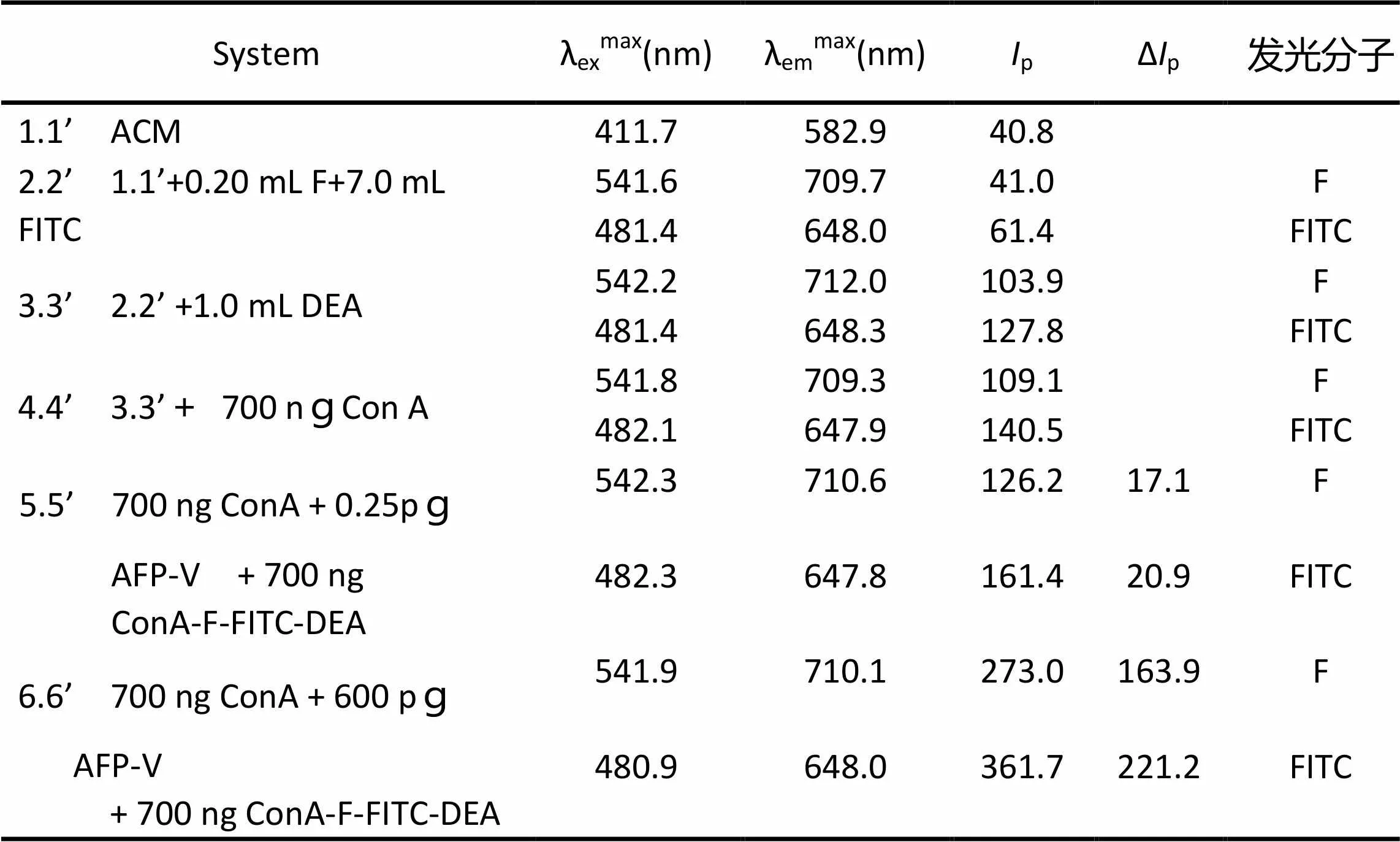
表1 DEA- F-FITC-Con A-AFP-V-Con A体系的磷光特性(F和FITC)
3.2 最佳测定条件
3.2.1试剂浓度与用量
对于40.0 fg AFP-V,按实验方法检测F和FITC的p值,分别考察试剂浓度和用量对体系的Δp值的影响。结果表明,试剂浓度与用量为0.40mL 1.0×10–5mol/L F、5.0 mL 1.0×10–5mol/L FITC、1.50 mL 1.0%DEA 时,体系的Δp值最大且稳定。
3.2.2固体基质
对于40.0 fg AFP-V,固体基质分别为ACM、PAM、NCM时,体系中F的Δp依次为30.1、12.6与8.4 ,FITC的Δp依次为 45.8、23.5与11.0。结果表明:采用ACM时FITC和F的Δp值都最大。
3.2.3增敏剂
对于40.0fg AFP-V,增敏剂分别为DEA、十二烷基磺酸钠、聚丙烯酸钠、溴代十六吡啶时,体系中F的Δp依次为30.1、12.5、16.6与24.4,FITC的Δp依次为 45.8、32.9、39.3与45.5。结果表明:采用DEA时F和FITC的Δp值最大值,故采用DEA为增敏剂。
3.2.4离子微扰效应
对于40.0 fg AFP-V,离子微扰剂分别为1.00 mol/L的Hg2+、Ba2+、Pb2+、Ag+时,体系中F的Δp依次为26.3、22.1、30.1与17.5,FITC的Δp依次为40.0、33.7、45.8与26.6;当Pb2+浓度分别为 0.1、0.5、1.0、1.5、2.0和2.5时,体系中F的Δp依次为26.7、29.9 、30.1、30.0、29.9与29.9,FITC的Δp依次为40.3、43.7、45.8、45.3、45.5 与45.5。选取1.00mol/L Pb2+为离子微扰剂时,Δp值最大且稳定。
3.2.5. 烘干温度与时间
对于40.0 fg AFP-V,分别研究了烘干温度和时间对体系的Δp的影响。结果表明,烘干温度分别为60、70、80、90、95(℃)时,体系中F的Δp依次为20.1、23.5、26.8、30.1与27.8,FITC的Δp依次为30.6、35.7、40.8、45.8与41.5;当烘干时间分别为0.5、1.0、1.5、2.0与2.5(min)时,体系中F的Δp依次为7.5、15.1、22.6、30.3 与 25.7,FITC的Δp依次为11.5、23.0、34.5、45.8与41.5;其中90℃、2min时Δp值最大且稳定。
3.2.6氧气及湿度
对于40.0 fg AFP-V,按实验方法考察氧气及湿度对体系的Δp的影响。结果表明,通干燥N2分别为5、10、15、20、25、30、35 min时,体系F的∆p依次为30.2、30.1、29.9、30.1、30.2、29.8、30.1,FITC的Δp依次为45.7、45.8、45.6、45.8、45.6、45.7、45.8;不通干燥N2,时间为5、10、15、20、25、30、35 min时,体系F的∆p依次为30.1、28.3、25.0、20.2、17.3、14.2、10.3,FITC的Δp依次为45.4、41.5、39.8、35.7、30.9、27.6、24.7。表明,在通干燥的N2的条件下体系是稳定的。
3.2.7 RTP发射的稳定性
在上述条件下,体系放置时间为10、20、30、40、50、60 和70 min时,F的Δp依次为30.1、30.1、30.1、30.1、30.1、29.9 和29.9,FITC的Δp依次为45.8、45.8、45.8、45.8、45.8、45.7和45.3;体系在50 min内Δp值几乎不变,重现性好。
3.3 工作曲线、检出限和精密度
用F-FITC-DEA标记Con A,亲和吸附方式测定AFP-V,其含量与Δp值成线性关系。工作曲线、线性系数、检出限(按3b/,= 11计算)和相对标准偏差 (%)等列于表2。表明亲和吸附方式测定AFP-V的灵敏度高、线性范围宽和精密度好。
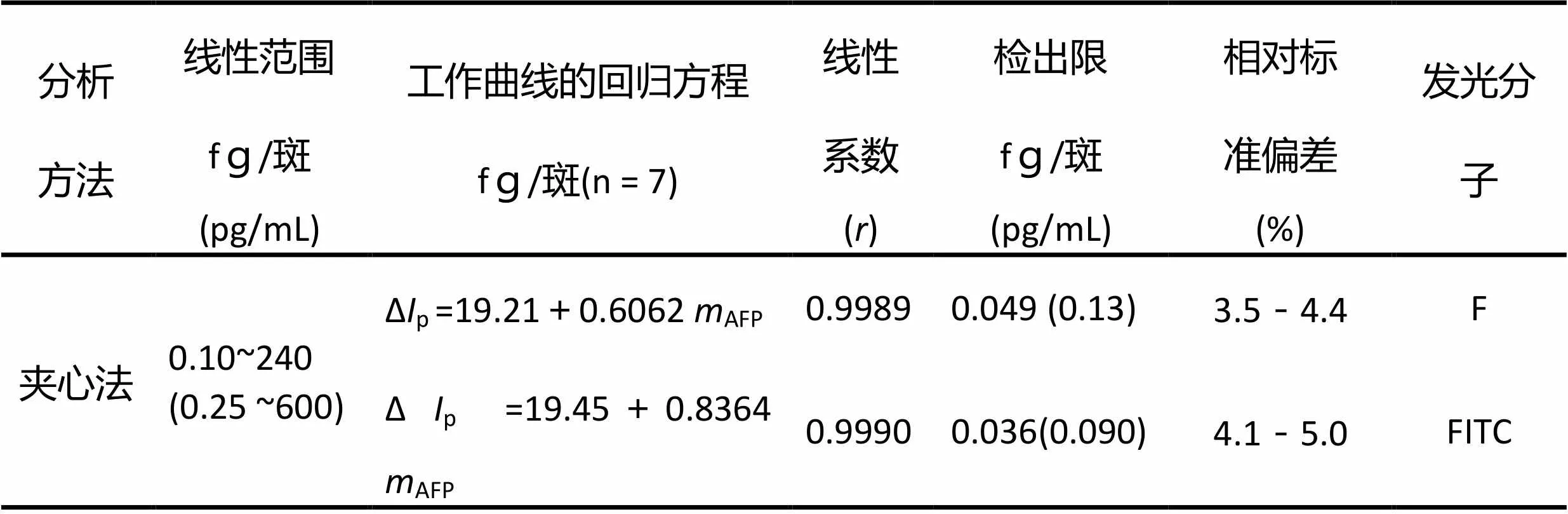
表2 方法的检出限、精密度
3.4 人血清中AFP-V含量的测定与人体疾病预报
取1.00 mL上清液,按实验方法测定上清液中的AFP-V, 同时做加入标准回收率实验,并与漳州市中医院ELSIA法临床检测的结果比较(表3)。
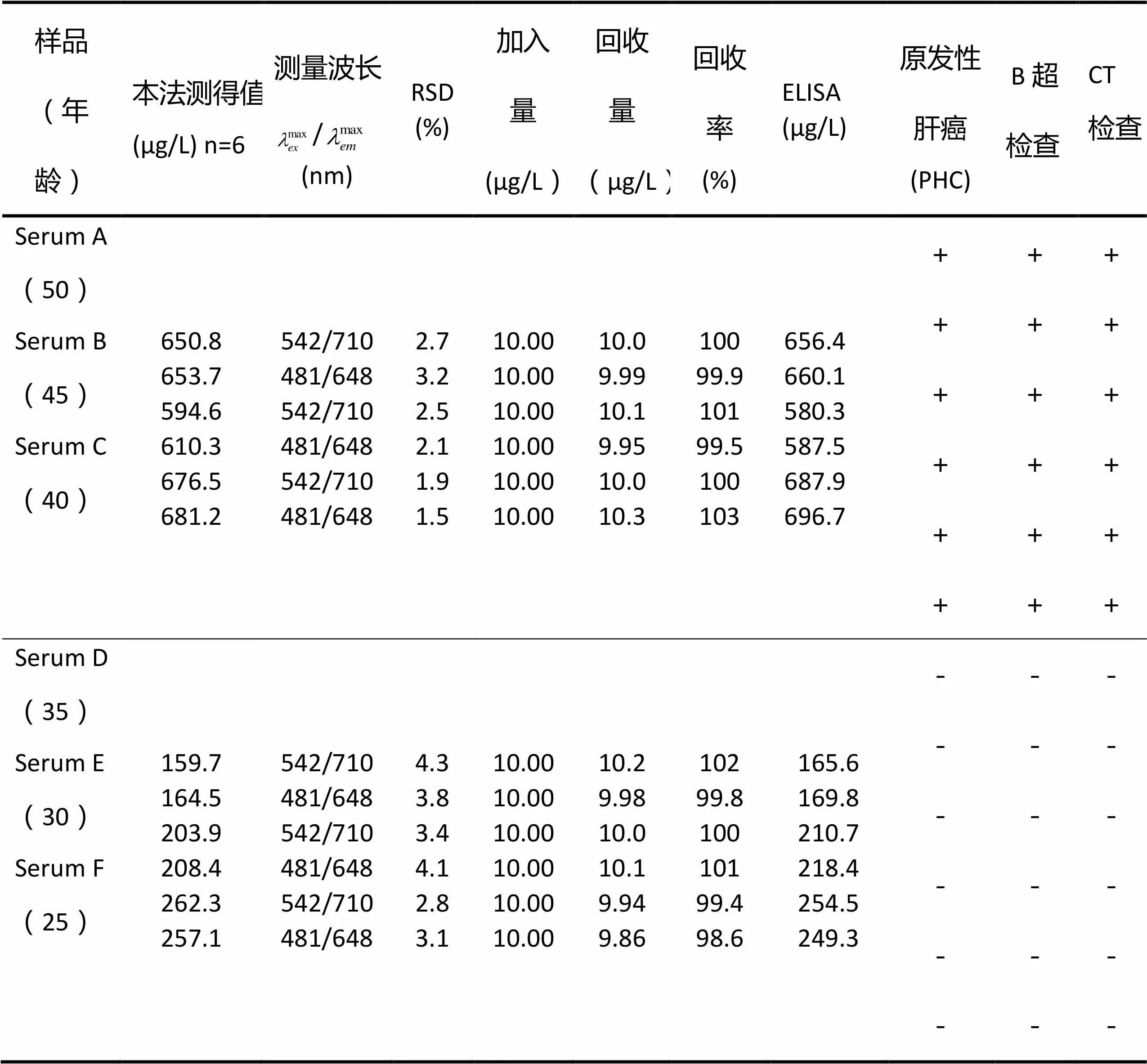
表3 人血清中AFP-V含量的分析结果
注:“+”表示有占位性病变,“-”未见占位性病变。
由表3可见, 本法的RSD%为1.5-4.3(%),回收率%为98.4-103(%)。无论选用F或FITC法测定人血清样品中AFP-V的含量,其结果与酶联免疫法(ELISA)的相吻合。根据AFP-V含量>355.6μg/L,临床诊断A、B、C患有PHC;AFP-V含量<355.6μg/L,临床诊断D、E、F为健康人。此后,对A、B、C进行治疗,4周后用本法测定血清中AFP-V含量<355.6μg/L,表明已达到健康人的水平。经B超、CT等检查,未见占位性病变。由此表明,本方法不仅适用于人血清中AFP-V含量的测定,还可用于人体疾病的测报。
4 结语
将高灵敏的SS-RTP与AA反应的高特异性相结合,建立了灵敏、准确测定痕量AFP-V新方法。新的F-FITC磷光标记试剂的开发与应用,不仅提高了AA-SS-RTP的灵活性和适应性,而且为F、凝集素提供了新的应用领域。
[1] G. Becker, A. Schmitt-Graeff, V. Ertelt, et al. Allgaier. CD117 (c-kit) expression in human hepatocellular[J]. Clinical Oncology, 2007,19(3):204-208.
[2] Constance Lay Lay Saw, Malini Olivo, William Wei Lim Chin, et al. Superiority of N-methyl pyrrolidone over albumin with hypericin for fluorescence diagnosis of human bladder cancer cells implanted in the chick chorioallantoic membrane model[J]. Journal of Photochemistry and Photobiology B: Biology,2007,86(3):207-218.
[3] Hui Xu PhD, Xuan Li MD, Jing-Xia Xie MD, et al. Diffusion-Weighted Magnetic Resonance Imaging of Focal Hepatic Nodules in an Experimental Hepatocellular[J]. Academic Radiology, 2007,14(3):279-286.
[4] Tae Hyun Kim M.D., Dae Yong Kim M.D., Joong-Won Park M.D.,et al. Dose–volumetric parameters predicting radiation-induced hepatictoxicity in unresectable hepatocellular carcinoma patients treated with three-dimensional conformal radiotherapy[J]. International Journal of Radiation Oncology Biology Physics, 2007,67(1):225-231.
[5] Y. Sato, K. Nkata, Y. Kato. Early recognition of hepatocellular carcinoma based on altered profiles of alpha-fetoprotein[J]. N Engl J Med, 1993,328(25):1802- 1806.
[6] Tu ZX, Yin ZF, Wu MC. Prospective study on the diagnosis of hepatocellular carcinoma by using alpha-fetoprotein reactive to Lentil lectin[J]. Chin Med Sci J , 1992,7(4) : 191- 195.
[7] 齐为民,张丽君,刘树林,等.亲和电泳酶免疫法快速测定AFP 异质体[J].免疫学杂志,2001,17(4):313-317.
[8] 汪子伟,卓广超,冷建杭,等.甲胎蛋白异质体的亲和吸附法测定[J].中国肿瘤,2003,12(2):120-121.
[9] 韩玲,陈杞. 人甲胎蛋白异质体直接固相时间分辨荧光免疫测定[J].上海免疫学杂志,1993,13(4):227-228.
[10] 庞春梅,沈鼎明,王景. 血清AFP异质体印迹法和γ-GTⅡ定性、定量检测对原发性肝癌诊断价值的探讨[J].重庆医科大学学报,2000, 25(3):259-264.
[11] Ying, X.; Hu, D.W.; Low, Y.C.; et al. One-step method of labeling triticum vulgare lectin and cellulose with colloidal gold probe[J]. Electron Microscopy Society, 2000,19(2):179-183.
[12] Allen; Allen, L.C.V.; Breur, M.J.; et al. A comparison of two techniques for the determination of serum bone-specific alkaline phosphatase activity in dogs[J]. Sci. 2000,68(3):231-235.
[13] Caspar J V, Wang Y. Excited State Electron Transfer of Fullerenes. Singlet States Versus Triplet States[J]. Chem. Phy s. L ett. , 1994,218:221-228.
[14] Tian-Bao LI,Ke Xiong HUANG,Xin Hai LI, et al. Studies on the Rapid Preparation of Fullerols and Its Formation M echanism[J]. Chem. J Chinese Universities,1998,19(6):858-860.
Chemically Modified Technique of Fullerene and its Application in Diseases Prediction
LI Yuan-yuan1, LI Zhi-ming2, ZHENG Zhi-yong2
(1.Zhangzhou college of science & technology Zhangzhou, 363202, China 2.Zhangzhou Institute of Technology, Zhangzhou, 363000, China)
The phosphorescent labeling reagent N, N-dimethylaniline-fullerol-fluorescein isothiocyanate (DEA-F-FITC) has been developed. A new affinity adsorption-solid substrate-room temperature phosphorimetry (AA-SS-RTP) for the determination of alpha-fetoprotein variant (AFP-V) had been established, based on DEA-F-FITC as a labeling reagent of concanavalin agglutinin (Con A). This method has high sensitivity (The detection limits (Pg/mL) are 0.13 for F and 0.090 for FITC, respectively), which has been applied to the determination of trace AFP-V in human serum and the forecast of human diseases, and the results agreed well with those obtained by enzyme-linked immunoassay.
Fullerene; Chemically modified technique;Application
2012-09-30
福建省教育厅科技项目资助(JB11308)
李园园(1983-),女,山东菏泽人,助教。主要从事化学方面研究。 通讯作者联系电话0596-2660301,电子邮件:zzylzm@163.com。
O613.71
A
1673-1417(2012)04-0007-06
(责任编辑:季平)
