柳枝稷种子愈伤组织诱导及分化
2012-03-13许文志张新全黄琳凯
许文志,张新全,黄琳凯,马 啸
(四川农业大学动物科技学院,四川 雅安 625014)
柳枝稷(Panicumvirgatum)为禾本科黍属草本植物,起源于北美洛基山脉以东、55° N以南的大草原,是一种植株高大、多年生暖季型丛生C4植物,通常被用于放牧、水土保持以及生态建设等[1]。柳枝稷生产量大,根系发达,耐贫瘠、洪涝和干旱,能够抵抗多种病虫害,易于收割贮存[2],能够用于生产能源等特性,因此,国内外许多学者认为柳枝稷是一种具有较大发展潜力的能源作物[3-4]。在美国,柳枝稷作为一种模式能源作物,对其的研究方兴未艾[5]。其中,采用转基因技术增强柳枝稷的抗逆性、提高光合效率、增加生物产量、降低木质素含量和提高乙醇产率等方面已成为目前的研究热点[6]。为此,研究并创建较为高效的组织培养体系是遗传转化体系建立的基础和前提。本研究以柳枝稷成熟种子为外植体,采用两步法灭菌,以MS培养基为基本培养基,研究不同质量浓度2,4-D与6-BA组合对愈伤组织诱导的影响,不同质量浓度GA3对愈伤组织分化的影响,以期建立稳定的柳枝稷组织培养体系。
1 材料与方法
1.1试验材料及处理 试验材料为美国弗吉尼亚理工大学提供的高转化率柳枝稷材料HR8的成熟种子,该材料是从Alamo中经过筛选得到。取脱壳后的柳枝稷种子,用自来水冲洗,去掉杂质,再用自来水浸泡12 h,冲洗后置于4 ℃冰箱内备用。
1.2方法
1.2.1种子灭菌试验 取处理后4 ℃保存的种子,用滤纸吸干表面水分,称取9份,每份10 g。以两步法对种子进行灭菌,即先用70%乙醇处理一定时间,用无菌蒸馏水冲洗后,再用0.1% HgCl2处理,两步处理完成后再用无菌蒸馏水充分洗涤种子3次(表1)。
灭菌处理后的种子接种于愈伤组织诱导培养基上,培养基组成为MS、5 mg·L-12,4-D、0.15 mg·L-16-BA、3%蔗糖和0.5%琼脂。每种处理组合的培养皿中接种50粒种子,5次重复。培养皿置于25 ℃黑暗培养,每隔3 d观察一次,记录发芽种子数、出愈种子数、污染种子数,以发芽及出愈的种子为存活种子,计算种子存活率及出愈率。
1.2.2培养基配置 以MS为基本培养基,根据试验设计的各种组合附加不同种类及浓度的激素,同时调节培养基中琼脂、蔗糖含量,然后将培养基pH值调至6.0。最后在121~126 ℃下高压灭菌20 min,移于接种室备用。
1.2.3愈伤组织诱导 愈伤组织诱导培养基:MS+2,4-D+6-BA组成9种2,4-D与6-BA不同质量浓度组合的培养基(表1)。每种培养基附加0.7%琼脂和3%蔗糖。

表1 种子灭菌处理时间和愈伤组织诱导培养基激素浓度
每种组合的培养基接种灭菌后的种子50粒,8次重复,置于(23±1) ℃黑暗培养。培养4 d后,每天观察并记录出愈情况,包括愈伤组织生长速度、数目、形态特征、颜色变化等,统计愈伤组织数。
1.2.4继代培养 继代培养基:MS+2,4-D(3、4、5 mg·L-1)3种不同的培养基,每种培养基附加0.8%琼脂和3%蔗糖。分装至三角瓶中,以封口膜封口,灭菌后备用。
选取愈伤组织色泽淡黄而纯净、表面干燥、紧实、体积较大的出愈种子,在无菌条件下剥离出愈伤组织,接种于继代培养基上,每种培养基分别接种15瓶,每瓶接种2~3块愈伤组织。置于(23±1) ℃黑暗培养,每天记录愈伤组织生长速度、形态特征、颜色变化等。
1.2.5分化培养 分化培养基:MS+GA3(0.1、0.2、0.5、1.0 mg·L-1)4种不同的培养基。每种培养基附加0.7%琼脂和3%蔗糖,灭菌后再加入已过滤除菌的激素。
选取愈伤组织色泽淡黄而纯净、表面干燥、紧实、体积较大的愈伤组织块,接种于分化培养基上,每种培养基分别接种15瓶,每瓶接种2~3块愈伤组织。置于27 ℃、光照16 h·d-1、光照强度为10 000 lx及温度25 ℃、黑暗8 h·d-1变温培养。每天记录愈伤组织形态特征、颜色变化、出芽数、幼芽形态特征及幼芽高度。
分化培养14 d后,将生长有幼芽的愈伤组织块取出,无菌条件下在培养皿中用滤纸吸掉愈伤组织块表面培养基,然后转接于生根培养基中。生根培养基为1/2 MS附加0.7%琼脂和3%蔗糖。
1.3数据分析 每日观察记录的数据,经汇总后,分别按照以下公式计算:
所得结果用Excel 2003进行F检验,用SPSS 17.0进行多重比较。
2 结果
2.1种子灭菌效果 成熟种子在愈伤组织诱导培养基上,3 d后大部分种子开始出芽。6 d后,部分种子盾片处长出白色水浸状、柔软松散的愈伤组织,并且少量未发芽的种子也有愈伤组织长出;同时,极少量种子四周有乳白色液体渗出至培养基表面,此为种子灭菌不彻底所致。带菌种子只出现在70%乙醇10 s、0.1% HgCl25 min处理和70%乙醇10 s、0.1% HgCl215 min处理的部分培养皿中,两处理带菌种子数平均都为1粒。15 d后,芽生长明显,愈伤组织变大且表面变干燥、质地变紧实,带菌种子芽腐烂且四周菌斑变大,没有发芽也没长出愈伤组织的种子不再有变化,证明种子已经死亡。记录15 d时各培养皿发芽种子数及出愈种子数,计算种子存活率及出愈率(图1)。
F检验(两因素三水平)表明,70%乙醇处理对种子存活率的影响达到显著水平(F=3.84);0.1%HgCl2处理对出愈率影响显著(F=4.47)。只有70%乙醇10 s、0.1% HgCl25 min处理和70%乙醇10 s、0.1% HgCl215 min处理有少量种子带菌,即0.1% HgCl2处理5 min、70%乙醇处理时间分别为10和15 s,其他各处理均无带菌种子,说明已经灭菌彻底。各处理种子存活率及出愈率最高的均为70%乙醇20 s、0.1% HgCl25 min处理,分别为75%和30%。在种子彻底灭菌的同时,要获得较多的愈伤组织,应先用70%乙醇处理20 s,用无菌蒸馏水冲洗后,再用0.1% HgCl2处理5 min,处理完成后再用无菌蒸馏水充分洗涤种子3次。
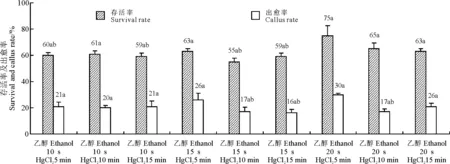
图1 灭菌时间对种子存活率和出愈率的影响
2.2愈伤组织诱导 经70%乙醇处理20 s,0.1% HgCl2处理5 min的成熟种子,大多数能在各愈伤组织诱导培养基发芽生长。培养4 d后,逐渐长出愈伤组织,随后愈伤组织变大且表面变干燥、质地变紧实(图2)。培养21 d后,存活种子全部长出愈伤组织,其中大部分愈伤组织色泽淡黄而纯净、
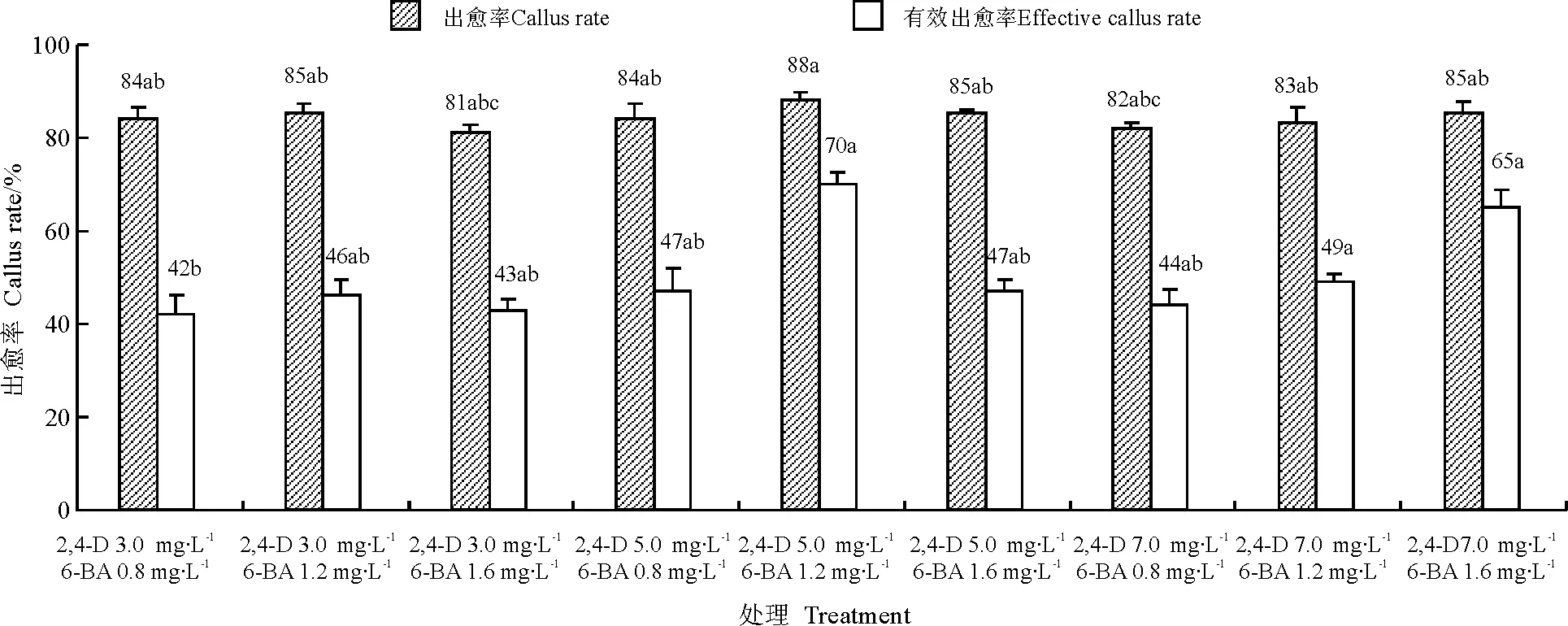
图2 不同愈伤组织诱导培养基出愈率及有效出愈率
表面干燥、紧实、体积较大,为质量较好,具有分化潜力的愈伤组织块。统计出愈种子数及愈伤组织质量较好的出愈种子数,计算出愈率及有效出愈率。
各处理出愈率差别不明显,最大的88%,最小的81%。有效出愈率差别较大,最大的70%,最小的42%。为了得到足够多的高质量愈伤组织,采用MS+5 mg·L-12,4-D+1.2 mg·L-16-BA,附加0.7%琼脂和3%蔗糖的培养基配方进行愈伤组织诱导。
2.3继代培养 愈伤组织块继代培养7 d后,大部分愈伤组织块增大,色泽内部淡黄表面白色,紧实而干燥。个别愈伤组织块表面有油状物,结构松散,且随机出现在各三角瓶内。其中在附加4 mg·L-12,4-D的培养基上,愈伤组织块增大明显,表面出现白色颗粒状凸起。培养14 d后,附加4 mg·L-12,4-D的培养基上,大部分愈伤组织块长到原来体积的两倍大小,表面干燥,结构紧实。附加3 mg·L-12,4-D的培养基上,只有少量愈伤组织块体积显著增大,大部分增大不明显,表面具油状物结构松散的愈伤组织块比附加4和5 mg·L-12,4-D的两种培养基都多。附加5 mg·L-12,4-D的培养基上,部分愈伤组织块出现褐化现象。培养28 d后,各三角瓶内愈伤组织块均发生不同程度的褐化。综合考虑,附加4 mg·L-12,4-D、0.8%琼脂、3%蔗糖的MS为最佳继代培养基。继代14 d后再次继代处理,或者转接至分化培养基进行分化。一次继代连续培养超过21 d后,愈伤组织出现褐化,分化成苗的能力降低。
2.4分化培养 愈伤组织块在分化培养基上光照培养。7 d后,白色颗粒状凸起即可出现绿色的芽点。14 d后,部分绿色芽点分化成苗,每块愈伤组织平均7个苗,平均1.3 cm高,新芽颜色嫩绿直立向上生长;部分愈伤组织块上的绿色芽点没有变化,且周围开始褐化。还有部分愈伤组织块严重褐化,表面变坚硬。添加不同质量浓度GA3的各培养基上,分化出芽的愈伤组织数不同(图3)。随着GA3质量浓度逐渐增加,愈伤组织的分化率逐渐提高,添加0.5 mg·L-1GA3时,分化率最大,为30.56%。当添加的GA3质量浓度超过0.5 mg·L-1后,愈伤组织分化率下降。因此,应选择添加0.5 mg·L-1GA3的MS作为分化培养基。
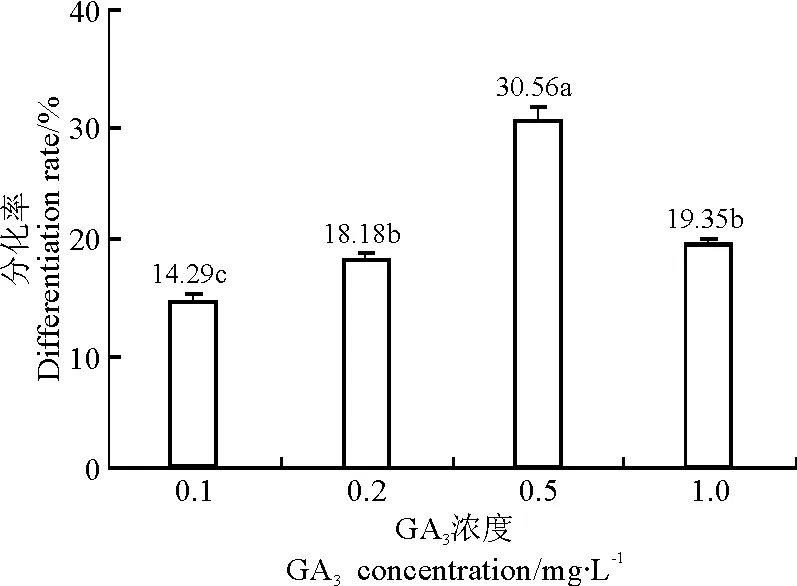
图3 愈伤组织分化率
将分化出芽的愈伤组织块转接至1/2 MS附加0.7%琼脂、3%蔗糖的生根培养基上培养。部分原来带有须根的愈伤组织块幼芽继续生长,且逐渐长出少量根;部分原来没有须根可见的愈伤组织块,幼芽生长缓慢,但根系生长较快较多;还有一部分有幼芽的愈伤组织块不能生根,幼芽生长数天后开始失水。
待愈伤组织块生根后,去掉培养瓶的封口膜,在培养基表面加入少量无菌水,形成水膜防菌。置于室温光照培养3 d,每天更换一次无菌水。3 d后,将苗取出,冲洗干净培养基,移栽至经过灭菌处理的沙土盆中,置于室温光照培养。待炼苗结束后,即可搬至室外培养。大部分苗可以长成完整植株且健康生长,少量苗在移栽后其根部逐渐腐烂,幼苗逐渐死亡。
3 讨论
3.1HgCl2对种子活力的影响 采用两步法灭菌,处理适当,可达到彻底灭菌的效果[7-8]。HgCl2对种子有一定的毒害作用,处理时间过长,会使部分种子失去活力,无法发芽,也不能诱导出愈伤组织[9]。因此,既要最大可能保存种子活力又要达到彻底灭菌的目的,应选择适当的浓度,处理适当的时间。在试验中,用HgCl2处理后,要用无菌水反复冲洗种子,防止残留的HgCl2继续毒害种子。用HgCl2处理甜荞(Fagopyrumesculentum)时,灭菌效果很好,但种子萌发率显著降低[10];用HgCl2处理日本结缕草(Zoysiajaponica)后再用无菌水多次冲洗,可以降低HgCl2对种子的毒害[11],这与本研究结果一致。
3.2激素对愈伤组织诱导的影响 2,4-D对植物愈伤组织诱导起决定作用[12-14]。在培养基中添加2,4-D可以提高植物细胞生长素含量,从而诱导胚性细胞的生长,诱导出愈伤组织[15]。在一定范围内,随着2,4-D质量浓度的增加,诱导率增高。Linaeero和Vazquez[16]指出,过高或过低浓度的2,4-D都不利于愈伤组织的形成和分化再生,过高浓度的2,4-D处理易引起愈伤组织褐化死亡。本研究表明,5 mg·L-12,4-D对柳枝稷成熟种子的愈伤组织诱导率最高,偏高或者偏低的浓度,对愈伤组织的诱导都不利。
在植物愈伤组织诱导过程中,添加一定量的细胞分裂素,如6-BA,可改良愈伤组织的质量,从而提高植物分化再生频率[17-18]。杨茹等[19]指出,在已有2,4-D的诱导培养基中加入少量的BA能对愈伤组织的诱导产生促进作用。本研究中,添加6-BA对柳枝稷愈伤组织诱导率并无显著影响,但是可以明显改善愈伤组织的质量,并且添加1.2 mg·L-16-BA效果最佳,这与Somleva等[20]在柳枝稷转基因研究中所使用的浓度一致,但与孟敏等[21]以幼穗为外植体研究柳枝稷再生时使用0.15 mg·L-16-BA有很大差异,这可能是由于所采用的品种不同,所取外植体部位也不同。
另外,还有其他因素也影响柳枝稷种子愈伤组织的诱导,如种子的品质、品种等[22]。同一品种中,成熟完全、颗粒饱满的种子,愈伤组织诱导率较高,且愈伤组织质量较好,容易分化成苗;瘦瘪的种子,愈伤组织诱导率低,且愈伤组织质量较差,不易继代增殖,无法分化成苗。不同品种的种子由于其遗传物质存在差异,内源激素组成不同,对外源激素的响应也不同。影响柳枝稷愈伤组织诱导的其他因素还有待进一步试验研究。
3.3愈伤组织分化的影响因素 愈伤组织的质量为影响其分化的主要因素。愈伤组织块较干燥、色泽内部淡黄外表白色、结构紧实、表面有白色颗粒状凸起的愈伤组织容易分化成苗。一般在白色凸起的部位先呈现绿色,最后发育成芽。表面湿润、松软的愈伤组织块不易分化出芽。颜色暗黄的愈伤组织块在光照下极易褐化,不具有分化能力。因此,在进行柳枝稷遗传改良及其他处理时,应选择状态良好的愈伤组织块。
2,4-D对愈伤组织的分化有一定的抑制作用[23]。在柳枝稷愈伤组织诱导阶段添加7 mg·L-12,4-D的愈伤组织块,继代一次后进行分化,与添加低浓度2,4-D诱导的愈伤组织相比,不易分化成苗。但是将所有愈伤组织继代3次以后,诱导阶段添加不同浓度2,4-D的愈伤组织块分化能力并无明显差别。因为继代培养基均添加4 mg·L-12,4-D,已经消除了前期2,4-D浓度差异的影响。
继代培养的时间也可影响愈伤组织的分化。继代3次,培养45 d以内,愈伤组织持续增大,质量较好。超过45 d后,愈伤组织有的开始褐化,有的变得坚硬,两种状态的愈伤组织块均无法再分化。
4 结论
以柳枝稷成熟种子为外植体,先用70%乙醇处理20 s,再用0.1% HgCl2处理5 min;灭菌后的种子接种于MS+5 mg·L-12,4-D+1.2 mg·L-16-BA+0.7%琼脂+3%蔗糖的愈伤组织诱导培养基上;21 d后,将愈伤组织转接于MS+4 mg·L-12,4-D+0.8%琼脂+3%蔗糖的继代培养基上继代2~3次;然后转接在MS+0.5 mg·L-1GA3+0.7%琼脂+3%蔗糖的分化培养基上,14 d后即有苗长出;最后在1/2 MS上诱导生根,室内炼苗1周后,移栽至沙土中,可以很好地发育成苗。
[1]Comis D.Switching to switchgrass makes sense[J].Agricultural Research,2006(6):1169-1178.
[2]Bouton J H.Molecular breeding of switchgrass for use as a biofuel crop[J].Current Opinion in Genetics & Development,2007,17:553-558.
[3]Sanderson M A.Upland switchgrass yield,nutritive value,and soil carbon changes under grazing and clipping[J].Agronomy Journal,2008,100(3):510-516.
[4]程序.能源牧草堪当未来生物能源之大任[J].草业学报,2008,17(2):1-8.
[5]范希峰,侯新村,左海涛,等.边际土地类型及移栽方式对柳枝稷苗期生长的影晌[J].草业科学,2010,27(1):97-102.
[6]刘吉利,朱万斌,谢光辉,等.能源作物柳枝稷研究进展[J].草业学报,2009,18(3):332-240.
[7]杨宇,金强,王新建.二步灭菌法在植物组织培养中的应用[J].北方园艺,2010(7):143-144.
[8]刘丽娟,李红梅,刘雪莲.不同处理方法对外植体消毒效果比较研究[J].北方园艺,2009(10):86-87.
[9]余泽高,黄喜梅.大穗黑麦草成熟种子愈伤组织诱导及分化的研究[J].河南农业科学,2004(12):7-10.
[10]郝建平,张江涛.8种甜荞的种子消毒及愈伤组织诱导和增殖条件[J].植物研究,2001,21(1):68-72.
[11]刘拥海,俞乐,崔铁成.日本结缕草愈伤组织的诱导和植株再生[J].草业科学,2010,27(3):107-111.
[12]曾升坚,卞建春,方钲,等.多年生黑麦草成熟种子愈伤组织的诱导和植株再生研究[J].安徽农业科学,2009,37(35):17343-17345,17364.
[13]Bai Y,Qu R.Factors influencing tissue culture responses of mature seeds and immature embryos in turf-type tall rescue[J].Plant Breeding,2001,120(2):239-242.
[14]Bhaskaran S,Smith B H.Regeneration in cereal tissue culture:a review[J].Crop Science,1990,30(6):1328-1336.
[15]钱海丰,薛庆中.激素对高羊茅愈伤组织诱导及其分化的影响[J].中国草地,2002,24(1):46-49,60.
[16]Linacero R,Vazquez A M.Somatic embryogenesis from immature inflorescences of rye[J].Plant Science,1990,72(2):253-258.
[17]徐定炎,何阳鸭.种坯处理、不同激素浓度在暗培养条件下对多年生黑麦草愈伤组织诱导的影响[J].浙江林业科技,2003,23(2):16-19.
[18]陈智勇,易自力.提高高羊茅愈伤组织诱导率的研究[J].草业学报,2003,12(4):69-71.
[19]杨茹,袁庆华,曹致中,等.2,4-D和BA对黑麦草不同外植体愈伤组织诱导与分化的影响[J].中国草地学报,2008,30(4):34-39.
[20]Somleva M N,Tomaszewski Z,Conge B V.Agrobacterium-mediated genetic transformation of switchgrass[J].Crop Science,2002,42(6):2080-2087.
[21]孟敏,李华军,徐开杰,等.柳枝稷的组织培养技术研究[J].安徽农业科学,2009,37(4):1477-1478.
[22]江巨鳌,赵运林,陈智勇,等.高羊茅愈伤组织再生系统的建立[J].湖南农业大学学报(自然科学版),2003,29(5):385-387.
[23]刘文真,玄松南,陈惠哲,等.几种作用因子对多年生黑麦草组织培养影响的研究[J].林业科学研究,2004,17(1):95-101.
