新牧一号苜蓿MvP5CS基因的克隆和功能分析
2012-03-13张富春陈全家
张 桦,张富春,曾 光,张 博,陈全家
(1.新疆草地资源与生态重点实验室,新疆 乌鲁木齐 830052;2.新疆生物资源基因工程重点实验室 新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;3.新疆农业大学农业生物技术重点实验室,新疆 乌鲁木齐 830052)
脯氨酸是植物在逆境中主要的渗透调节物质之一,研究表明,在胁迫条件下,脯氨酸不仅是生物大分子的保护剂或羟基的清除剂,还是植物从逆境胁迫条件中恢复正常过程中迅速、有效的氮源、碳源和还原剂[1]。生物体内,由谷氨酸经过两步连续的还原后合成脯氨酸,Δ1-二氢吡咯-5-羧酸(P5C)为中间产物,催化该反应的酶为Δ1-二氢吡咯-5-羧酸合成酶(Δ1-pyrrline-5-carboxylate synthetase,P5CS,EC2.7.2.11/1.2.1.41)。该酶是双功能酶,具有γ-谷氨酰激酶和谷氨酰γ-半醛脱氢酶活性,催化从谷氨酸合成脯氨酸的最初两步反应,其活性受脯氨酸反馈抑制[2]。目前已经克隆了多种植物Δ′-吡咯琳-5-羧酸合成酶基因,不同植物的P5CS基因在干旱和盐胁迫下表达量均上升[3-6]。说明P5CS基因的表达可以提高植物体内脯氨酸的含量,从而减缓胁迫的危害。
苜蓿(Medicagosativa)是世界上分布范围最广、种植面积最大的多年生豆科牧草,在我国也是最重要的牧草之一。在盐碱地同时种植苜蓿和啤酒大麦(Hordeumvulgare),苜蓿的生物量和蛋白质产量均高于啤酒大麦,可改良盐渍化土地。种植苜蓿不仅为动物带来了营养丰富的食物,还使原本退化严重的天然草地变成了高产、稳产的苜蓿栽培草地,对恢复草地生态具有极其重要的推广意义[7]。新牧一号苜蓿(M.variaXinmu-1)是从新疆天山中山带野生黄花苜蓿(M.falcata)杂种群体中选育而成[8],于1987年育成并进行品种登记,登记号018。经推广后,目前在新疆各地广泛种植。Wang等[9]对6种苜蓿的抗旱和抗盐性进行分析,新牧一号杂花苜蓿在200 mmol·L-1盐胁迫下发芽率仍为90%~95%,而其他苜蓿品种发芽率均低于新牧一号苜蓿。分析表明,新牧一号在盐、PEG胁迫后超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)和过氧化物酶(POD)表达量都比敏盐品种高。王玉祥等[10]综合比较了新疆6个品种苜蓿在不同盐胁迫处理下的发芽势、发芽率、株高、根长、可溶性糖含量和丙二醛含量,认为新牧一号抗逆性最强。但其耐盐能力仍然有限,要在盐碱地广泛种植,必须进一步提高耐盐能力。因为脯氨酸是植物在逆境下重要的渗透保护剂,与植物的抗逆性直接相关。本研究从克隆新牧一号苜蓿脯氨酸合成酶基因入手,研究新牧一号苜蓿P5CS基因的表达和作用,以期为进一步分析苜蓿的耐盐分子机制和抗逆分子育种打下基础。
1 材料与方法
1.1试验材料
1.1.1植物材料 新牧一号苜蓿种子由新疆农业大学草业工程学院提供。
1.1.2试验试剂 TRNzol 总RNA提取试剂,Taq DNA聚合酶试剂盒,凝胶回收试剂盒,DNA Marker购自天根生化科技有限公司。反转录试剂,pMD19-T载体试剂盒,SYBR Green Ⅰ荧光定量试剂盒购自宝生物工程(大连)有限公司。引物由上海生物工程技术服务有限公司合成。其余试剂均为国产分析纯。
1.2试验方法
1.2.1总RNA提取和RT-PCR 新牧一号苜蓿种子室温萌发10 d后,150 mmol·L-1NaCl处理过夜,称取0.1 g叶片于液氮中研磨,参照天根生化科技有限公司的TRNzol试剂盒提取说明书步骤提取总RNA。使用天根公司的反转录试剂盒合成cDNA。引物根据Genbank中紫花苜蓿相关基因设计序列为P3:ATGGCGAACGCCGACCCTTGTAG,P4:TCAAGTAGTTA GGTCTTTGTGGGTG。参照天根生化科技有限公司的cDNA反转录试剂盒说明书逆转录RNA合成cDNA第一链,所得cDNA用于PCR扩增。PCR扩增体系为cDNA 1 μL,dNTP mixture(10 mmol·L-1each)1 μL,Taq酶(5 U·μL-1)0.5 μL,Taq酶Buffer 2.5 μL,引物各1 μL,去离子水18 μL。PCR程序为94 ℃预变性3 min后,94 ℃变性1 min,47 ℃退火1 min,72 ℃延伸2 min 30 s,进行35个循环,最后72 ℃延伸10 min。琼脂糖电泳检测后按天根生化凝胶回收试剂盒所述方法回收目的条带。
1.2.2连接、转化、筛选和序列分析 参考TaKaRa产品说明书取pMD19-T 0.5 μL加回收的插入片段4.5 μL,再加入5 μL solution I,16 ℃连接12 h后,全量加入100 μL DH5α感受态细胞中,冰上放置30 min,42 ℃加热45 s后,在冰上放置1 min,加入890 μL LB培养基,37 ℃振荡培养60 min,涂布于含有Amp的LB平板培养基上,37 ℃过夜,对菌落进行编号后挑菌落于1 mL含Amp的LB培养基中,振荡培养16 h,进行菌液PCR,PCR扩增体系为菌液1 μL,dNTP mixture(10 mmol·L-1each)1 μL,Taq酶(5 U·μL-1)0.5 μL,Taq酶Buffer 2.5 μL,T载体的m13引物各1 μL,去离子水18 μL。PCR程序为94 ℃预变性3 min后,94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸2 min 30 s,进行35个循环,最后72 ℃延伸10 min。电泳检测后对阳性菌液提取质粒DNA进行酶切分析,阳性克隆分别命名为pMD19-T-MvP5CS,将阳性克隆交上海生物工程技术服务有限公司测序,对测序结果进行序列分析。
1.2.3荧光定量PCR分析MvP5CS的表达 新牧一号苜蓿种子发芽10 d后,用150 mmol·L-1NaCl胁迫,分别在0、1、3、6、12和24 h时取0.1 g叶片,分别用TRNzol试剂提取总RNA,紫外分光光度法测含量以定量总RNA,分别反转录得到cDNA。设计荧光定量PCR引物,根据在Genbank登录的苜蓿微管蛋白基因(EU664318STBZ)作为内参基因,以此基因部分序列设计引物,长度153 bp,ACT1:CGAGCGTGGATACTCTTTC,ACT2:CCATCAGGCAACTCATAGC;根据已测序的MvP5CS基因序列设计引物,MvP5CS特异引物长度262 bp,P5RT1:CTTGGCAATACGAAGTGGGA,P5RT2:AGCATGACCTAGAACAGGGA。
SYBR Green I实时荧光定量PCR 20 μL反应体系:ddH2O 7.2 μL,上下游引物各0.4 μL(10 μmol),SYBR primeEx Tag,上述cDNA样本1 μL。稀释cDNA成6个梯度,得到不同浓度的标准模板10~106,进行靶基因MvNHX1及内参基因actin的SYBR Green Ⅰ实时定量PCR反应,反应体系加入毛细管后使用LightCycler 2.0仪器进行PCR扩增。反应条件为95 ℃ 10 s,95 ℃ 5 s,55 ℃ 10 s,72 ℃ 20 s。设置温度改变速率均为20 ℃·s-1,循环45次。制备标准曲线并检测扩增效率。做溶解曲线分析是否为特异性扩增,程序为95 ℃ 0 s 20 ℃·s-1;65 ℃ 15 s 20 ℃·s-1;95 ℃ 0 s 0.1 ℃·s-1。以苜蓿actin基因为参照基因,检测新牧一号苜蓿样品中的MvP5CS基因的表达水平,以0 h样本为校准样本,1~24 h样本为待测样本,比较MvNHX1基因的表达差异,利用2-ΔΔCt进行相对定量分析,结果绘制成柱状图。
ΔCt0 h=0 hMvNHX1基因Ct值-actin基因Ct值;
ΔCt待测样本=待测样本MvNHX1基因Ct值-actin基因Ct值;
ΔΔCt=ΔCt待测样本-ΔCt0 h;
2-ΔΔCt=2-(ΔCt待测样本-ΔCt0 h)。
1.2.4植物表达载体pCAMBIA2300-MvP5CS构建 在MvP5CS上游引物加BamHI位点,下游引物加PstI位点,设计引物,mqP5CS1:CGGGATCCATGGCGAACGCCGACCCTTGTAG,mqP5CS2:GGCTGCAGTCAAGTAGTTAGGTCTTTGTGGGT。用此引物对pMD19-T-mvP5CS进行PCR后回收产物,用BamHI和PstI双酶切后与同样双酶切的植物表达载体pCAMBIA2300-35S连接后转化DH5α感受态细胞,筛选阳性克隆。连接转化筛选方法同1.3.2,将阳性载体分别命名pCAMBIA2300-MvP5CS。将阳性克隆交上海生物工程技术服务有限公司测序,对测序结果进行序列分析。
1.2.5MvP5CS基因转烟草功能的初步验证 将经过鉴定的植物表达载体pCAMBIA2300-MvP5CS用液氮冻融法转化农杆菌LBA4404。再用叶盘方法转化烟草[11-14],经过烟草叶片预培养、农杆菌侵染、共培养、选择培养和生根培养,待幼苗长出根系后,将苗移至盛有无菌土的花盆中。
获得T0代转基因烟草,并提取转基因植株和野生型植株的基因组DNA,进行PCR 检测。用MvP5CS基因特异中间片段引物MvP5CS-P3:ATGGCGAACGCCGACCCTTGTAG,MvP5CS-P4:ACTGACTGCGTCGTTCTCGT;nptⅡ上游引物:5′-AGGCTATTCGGCTATGACTGG-3′,nptⅡ下游引物:5′-GCGGTCCGCCACACCCAGCCG-3′,来检查目的基因在转基因植株中的表达情况。反应条件:94 ℃预变性3 min后,94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸2 min,进行35个循环,72 ℃延伸10 min,4 ℃保存,琼脂糖凝胶电泳检测结果。
1.2.6转基因烟草T1代的耐盐性分析 将转基因烟草T1代和非转基因烟草分别播种于含有0、100、150、200、250和300 mmol·L-1NaCl的平皿中,每皿放两层滤纸,50粒种子,观察种子的萌发情况,7 d后观察并记录试验结果。试验分析获得的所有结果都在同样的条件下重复3次,每次50粒。测定结果用SPSS 15.0进行方差分析,数据用平均数±标准偏差表示。
2 结果
2.1MvP5CS的克隆 通过RT-PCR扩增,在新牧一号苜蓿叶片cDNA中扩增出1条大小为2 100 bp左右的DNA片段,大小与预测相符(图1)。
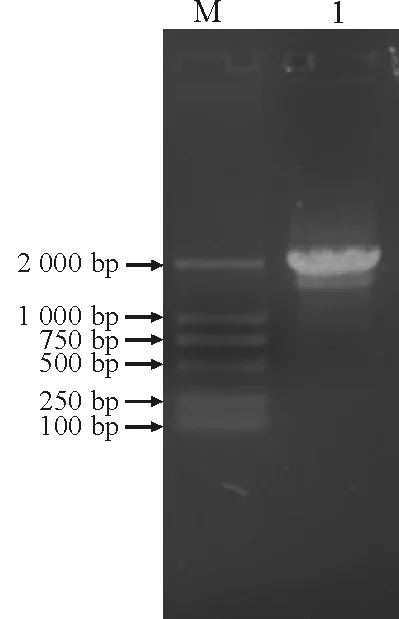
图1 MvP5CS基因RT-PCR扩增结果
将该片段回收后与pMD19-T载体连接转化,PCR和双酶切筛选阳性克隆,将阳性克隆命名为pMD19-T-MvP5CS(图2)。双酶切片段与RT-PCR片段大小一致。

图2 重组质粒pMD19-T- MvP5CS的酶切鉴定
2.2MvP5CS的序列分析 序列分析表明(图3),MvP5CS全长2 148 bp,编码715个氨基酸。用DNAMAN软件对本研究所得序列与GenBank中登记的一些物种P5CS氨基酸序列的相似度进行比较,MvP5CS氨基酸序列与紫花苜蓿MsP5CS(X98421)相似度为94.41%,与大豆(Glycinemax)GmP5CS(AY492005)相似度为89.93%,与拟南芥(Arabidopsisthaliana)AtP5CS(NM201912)相似度为63.88%,与水稻(Oryzasativa)OsP5CS(AY574031)相似度为75.56%,与蕃茄(Solanumlycopersicum)SlP5CS(U60267)相似度为76.71%。氨基酸序列比对显示,MvP5CS蛋白都包含有高等植物P5CS蛋白质的6个主要功能域:ATP结合位点,2个亮氨酸结构域,NADPH结合位点,谷氨酰激酶(GK)结构域和谷氨酸半醛(GSA)结构域,说明MvP5CS蛋白在新牧一号杂花苜蓿脯氨酸合成中起作用。从图3可以看到,除谷氨酰激酶(GK)结构域和1个亮氨酸结构域差异较大外,其他4个功能域的差异都较小,说明P5CS蛋白质的主要功能域相对保守。在MvP5CS的128位点发现苯丙氨酸,说明MvP5CS和其他已发现的P5CS酶一样,其活性可能被高浓度脯氨酸抑制。同时,新牧一号杂花苜蓿MvP5CS与紫花苜蓿MsP5CS相比,有37个氨基酸的缺失,这是否与脯氨酸的合成量有关,还需进一步研究。

图3 MvP5CS氨基酸序列与其他植物P5CS氨基酸序列的比较分析
2.3荧光定量PCR分析MvP5CS的表达 在RT-PCR扩增后进行熔解曲线分析(图4)。从熔解曲线看出,目标基因MvP5CS和参照基因actin的PCR扩增产物分别在82.5和83.5 ℃达到峰值,无非特异产物和引物二聚体,整个试验过程没有污染,目标基因和参照基因表达稳定。
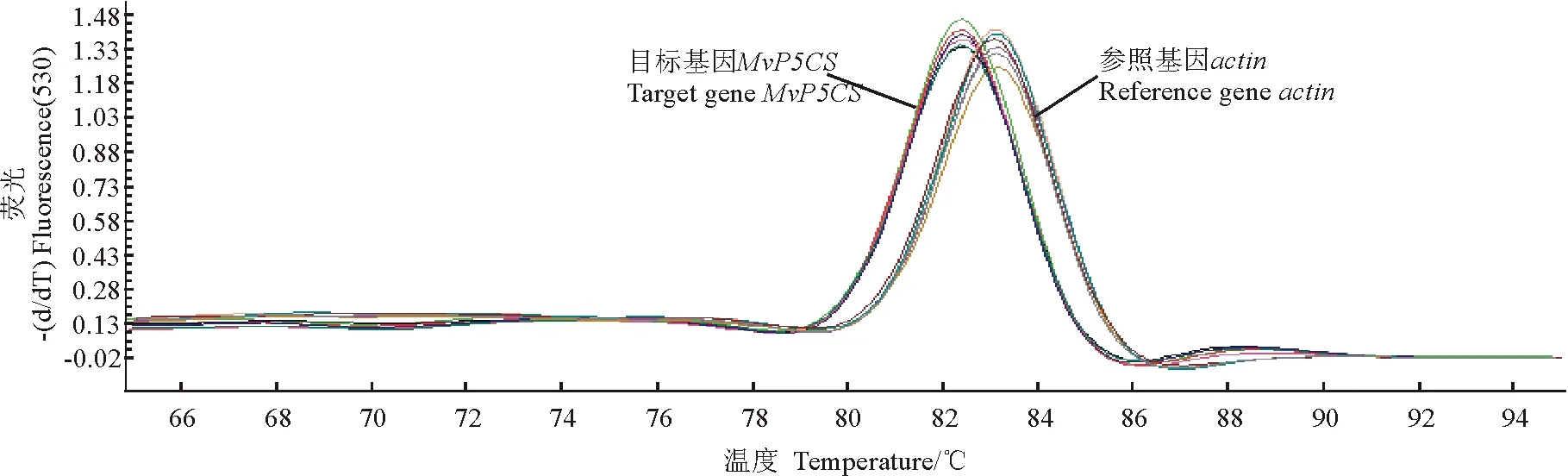
图4 MvP5CS基因和actin熔解曲线
以苜蓿actin基因为对照基因,特异性引物进行荧光定量PCR分析MvP5CS基因盐胁迫下的表达,采用的是相对定量2-ΔΔCt法计算MvP5CS盐胁迫下的表达。结果显示(图5),MvP5CS在盐胁迫后表达上调,12 h前表达量上升不明显,到24 h呈显著上升趋势,是胁迫前的31倍,说明苜蓿应对渗透胁迫时其可溶性渗透物质脯氨酸大量累积,使得在受到胁迫时有效地减轻胁迫,以维持细胞正常的膨压,增强苜蓿的抗逆性。
2.4植物表达载体构建 pCAMBIA2300-MvP5CS经BamHI和PstI双酶切后得到2 100 bp左右的片段,与实际大小一致(图6),表明pCAMBIA2300-MvP5CS植物表达载体构建成功。
2.5MvP5CS基因转烟草PCR检测 用nptⅡ基因引物和特异引物对转基因烟草T0代总DNA进行PCR扩增,同时以非转基因烟草作为对照。用nptⅡ基因引物检验MvP5CS基因烟草20棵,转MvP5CS基因烟草有16棵检测到了特异性条带,转化率80%(图7)。为证明以上获得的转基因烟草T0代植株是抗卡那霉素的阳性烟草植株,又用MvP5CS基因设计引物扩增特异中间片段对已筛选的抗性植株进行PCR检测,转MvP5CS基因烟草有15棵检测到了特异条带(图8),以上结果初步证明外源基因已经整合到了烟草植株的基因组中。

图5 MvP5CS基因在盐胁迫后不同时间的表达
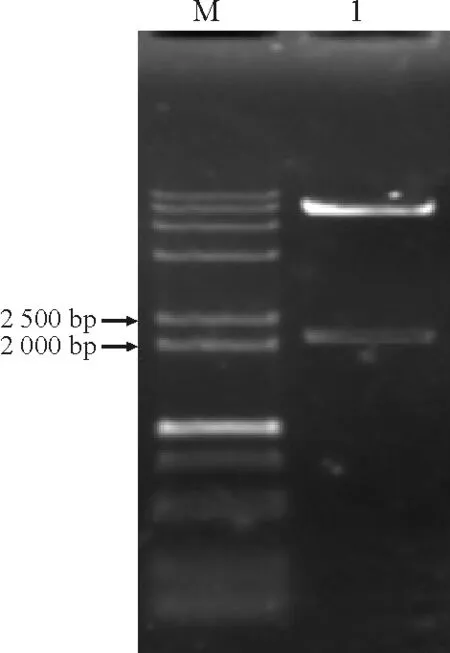
图6 pCAMBIA2300-MvP5CS酶切图谱

图7 转基因烟草T0代的nptⅡ基因PCR鉴定
2.6转基因烟草T1代的耐盐性分析 在无盐胁迫条件下,转MvP5CS基因烟草T1代植株的长势与非转基因烟草植株的长势没有较大差异,而在不同浓度盐胁迫条件下,转MvP5CS基因烟草T1代植株仍能正常生长,且转基因烟草T1代植株的长势明显好于非转基因烟草植株,根长和生物量也明显高于非转基因烟草植株(图9)。

图8 转基因烟草T0代基因中间片段的PCR鉴定
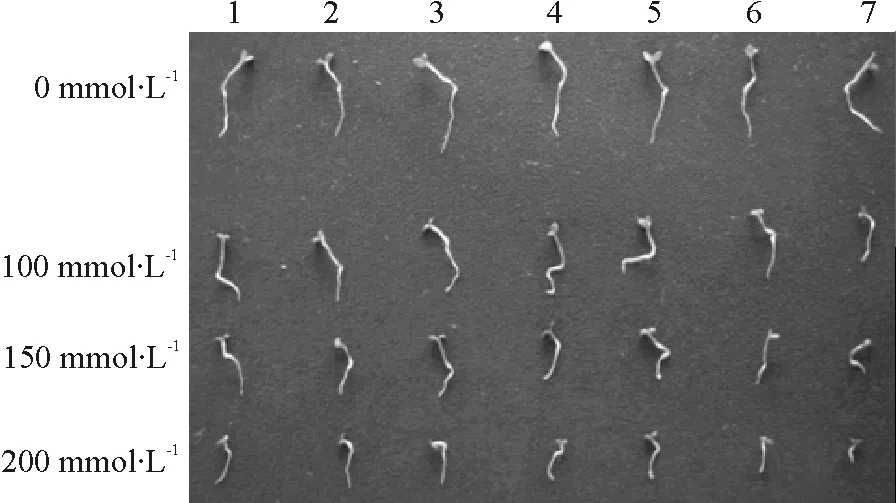
图9 不同浓度NaCl胁迫对烟草种子萌发的影响
正常条件下,转MvP5CS基因烟草T1代植株的萌发率与非转基因烟草植株的萌发率基本相同,而在不同浓度NaCl胁迫条件下,转MvP5CS基因烟草T1代植株的萌发率都显著高于非转基因烟草植株(图10)。方差分析表明,转基因植株与非转基因植株在盐胁迫下萌发率存在显著差异(P<0.05),说明转MvP5CS基因提高了烟草的耐盐性。
3 讨论
在胁迫条件下,植物中的脯氨酸积累是两条途径相互调控的结果,既增加了脯氨酸合成酶基因的表达量,同时又抑制了脯氨酸降解酶的活性,最终导致脯氨酸含量的增加,从而提高对胁迫的抗性[15]。已有研究表明,在一定的胁迫范围内,植物可通过自身细胞的渗透调节作用表现出对外界渗透胁迫的抵抗能力。在渗透胁迫下,植物体内会积累很多渗透调节物质,以维持细胞正常的膨压,增强植物的抗逆性。本试验从新牧一号苜蓿中克隆出MvP5CS基因,通过荧光定量PCR分析在盐胁迫下0~24 h的MvP5CS基因表达情况。结果显示,MvP5CS基因在盐胁迫后表达均上调,到24 h时,MvP5CS在盐胁迫下表达量是未胁迫时的31倍,P5CS酶是脯氨酸合成的关键酶,胁迫后大量表达说明苜蓿响应渗透胁迫时其脯氨酸大量累积可有效地减轻胁迫。将MvP5CS转入烟草,转基因烟草耐盐性得到提高,进一步证明该基因与耐盐性有关。

图10 不同浓度NaCl胁迫下转基因与非转基因烟草种子的发芽率
刘旻霞和马建祖[16]以甘南亚高山草甸植物为研究样本,分析了不同环境梯度条件下的6种植物叶片内脯氨酸含量,发现随着从阴坡、半阴半阳坡、阳坡环境的变化,脯氨酸含量都有不同程度的增加;而且植物品种的不同,脯氨酸含量的增加幅度有差异,进一步可以认为叶片内脯氨酸含量的高低可作为衡量植物抗逆性的指标。研究表明[17-19],转P5CS基因植物的脯氨酸含量均高于对照组,同时转P5CS基因植物的耐盐和抗旱性都明显提高。综上所述,将外源P5CS基因转入植物中可以提高转基因植物体内游离脯氨酸的含量,可以部分改善转基因植物抗胁迫的能力,尤其是耐盐、抗旱方面的能力。与农作物相比,牧草大多种植在生长条件相对恶劣的环境下,因此,培育具有某一或多个抗逆性的牧草品种,对改良牧草特性和扩大种植面积具有重要作用[20]。
MvP5CS基因的获得为进一步研究新牧一号苜蓿抗逆境胁迫的机制提供了理论依据,也为后续试验奠定了基础。因为脯氨酸的大量合成在抗逆反应中起主要作用,但大量的脯氨酸会反馈抑制P5CS酶的活性,下一步可以通过定点突变法,将MvP5CS中127位的苯丙氨酸突变为其他氨基酸,这样可以阻止脯氨酸的反馈抑制,从而得到更多的脯氨酸积累以应对胁迫。同时,该研究成果也可推广到其他植物,为转基因分子育种提高牧草和作物的抗逆性提供优越的基因资源。
[1]Delauney A J,Verma D P S.Proline biosynthesis and osmorgulation in plants[J].Plant Journal,1993,4(2):215-223.
[2]王镜岩,朱圣庚,徐长法.生物化学(下册)[M].第三版.北京:高等教育出版社,2002:345.
[3]Siwa-Drrtega C O,Ochoa-Alfaro A E,Beyes-Agwero J A,etal.Salt stress increases the expression ofp5csgene and induces proline accumulation in cactus pear[J].Plant Physiology and Biochemistry,2008,46(1):82-92.
[4]Wang Z Q,Yuan Y Z,Ou J Q,etal.Glutamine synthetase and glutamate dehydrogenase contribute differentially to proline accumulation in leaves of wheat (Triticumaestivum) seedlings exposed to different salinity[J].Journal of Plant Physiology,2007,164:695-701.
[5]Junghe Hur,Jung K H,Lee C H,etal.Stress-inducibleOsP5CS2 gene isessential for salt and cold tolerance in rice[J].Plant Science,2004,167:417-426.
[6]曹丽,孙振元,义鸣放,等.多年生黑麦草P5CS基因的cDNA克隆、表达及亚细胞定位[J].园艺学报,2010,37(9):1477-1484.
[7]赵银,柴琦,陈盈盈,等.盐渍化土壤改良措施的作物生产效应[J].草业科学,2009,26(4):55-58.
[8]闵继淳,肖凤.新牧一号杂花苜蓿的选育(1978-1988)[J].新疆农业大学学报,1989(4):10-15.
[9]Wang W B,Kim Y H,Lee H S,etal.Analysis of antioxidant enzyme activity during germination of alfalfa under salt and drought stresses[J].Plant Physiology and Biochemistry,2009,47: 570-577.
[10]王玉祥,陈爱萍,张博.不同苜蓿品种耐盐性初探[J].草业科学,2010,27(3):102-106.
[11]Kobayashi K,Cabral S,Calamante G,etal.Transgenic tobacco plants expressing thePotatovirusXopen reading frame 3 gene develop specific resistance and necrotic ring symptoms after infection with the homologous virus[J].Molecular Plant-Microbe Interaction,2001,14(11):1274-1285.
[12]Del P O,Lam E.Expression of the baculovirus p35 protein in tobacco affects cell death progression and compromises N gene-mediated disease resistance response to tobacco mosaic virus[J].Molecular Plant-Microbe Interaction,2003,16(6):485-494.
[13]徐刚标,卢孟柱,陆燕.ARF基因导入烟草的遗传转化研究[J].中国林业科技大学学报,2007,27(5):6-12.
[14]岳彩鹏,李品,黄象男,等.烟草愈伤组织的诱导及细胞悬浮培养体系的建立[J].烟草科技,2007,10:56-59.
[15]余叔文,汤章城.植物生理与分子生物学[M].第二版.北京:科学出版社,2001:752-769.
[16]刘旻霞,马建祖.6种植物在逆境胁迫下脯氨酸的累积特点研究[J].草业科学,2010,27(4):134-138.
[17]Hmida-Sayari A,Gargouri-Bouzid R,Bidani A,etal.Overexpression of Δ′-pyrroline-5-carboxylate synthetase increases proline production and confers salt tolerance in transgenic potato plants[J].Plant Science,2005,169:746-752.
[18]Zhu B C,Su J,Chan M C,etal.Overexpression of a delta(1)-pyrroline-5-carboxylate synthetase gene and analysis of tolerance to water- and salt- stress in transgenic rice [J].Plant Science,1998,139:41- 48.
[19]Razavizadeh R,Ehsanpour A A.Effects of salt stress on proline content,expression of delta-1- pyrroline -5- carboxylate synthetase,and activities of catalase and ascorbate peroxidase in transgenic tobacco plants[J].Biological Letters,2009,46(2):63-75.
[20]马江涛,王宗礼,黄东光,等.基因工程在牧草培育中的应用[J].草业学报,2010,19(6):248-262.
