尖叶胡枝子青贮微生物数量变化及发酵特性
2012-03-13司丙文王宗礼孙启忠张慧杰
司丙文,王宗礼,孙启忠,张慧杰,李 峰
(1.中国农业科学院研究生院,北京 100081;
2.中国农业科学院草原研究所,内蒙古 呼和浩特 010010)
尖叶胡枝子(Lespedezahedysaroides)为豆科多年生草本状半灌木[1],广泛分布于我国东北、华北、西北、西南、华南等地,具有耐干旱、耐贫瘠、抗寒、病虫害少等特性,是良好的水土保持和防止沙化的生态型牧草[2]。该牧草茎叶的粗蛋白、氨基酸、粗纤维等营养成分含量高,年生物量大,又是优良的饲用牧草。尖叶胡枝子资源丰富,但由于木质化程度高,适口性差,目前为止尚未得到合理的开发利用。青贮作为青绿饲料的有效贮藏手段,不仅能有效保存原料的营养价值,而且通过乳酸发酵能改善适口性,提高营养价值。然而,尖叶胡枝子含糖量比较少,缓冲能值高,是一种很难青贮的原料。近年来,青贮菌剂以及纤维素酶已经广泛应用在难青贮的豆科牧草中,并得到了良好的效果[3-6]。本研究分析了尖叶胡枝子表面附生的乳酸菌的种类及其产酸能力,并通过添加乳酸菌制剂和纤维素酶进一步研究青贮过程中微生物数量动态变化及青贮发酵品质,探讨适合尖叶胡枝子青贮的可行方法,为生产应用提供理论依据。
1 材料与方法
1.1青贮原料 2010年7月采自内蒙古赤峰市林西县良种场人工种植的尖叶胡枝子,取样时期为第1茬开花期。
1.2青贮添加剂 SNOW LACT-L:主要成分为鼠李糖乳杆菌(Lactobacillusrhamnosus)冻干粉,生产商为Snow Brand Seed Co.,Ltd,Sapporo,Japan。
纤维素酶:Acremonium cellulase粉剂,生产商为Meiji Seika Kaisha Ltd,Tokyo,Japan。羧甲基纤维素酶(CMCase),酶活性为27 000 U·g-1;β葡萄糖苷酶(β-glucosidase),酶活性为780 U·g-1;微结晶纤维素酶(Avicelase),酶活性为784 U·g-1;木聚糖酶(Xylanase),酶活性为13 000 U·g-1。
1.3试验设计 试验设添加乳酸菌(SL)、纤维素酶(AC)、乳酸菌和纤维素酶混合添加(SL+AC)以及不添加对照组(Control)4个处理,每个处理3次重复。乳酸菌和纤维素酶的添加量分别为0.000 5%和0.001 5%。
1.4青贮调制 尖叶胡枝子用粉碎机粉碎为2~3 cm,按照试验设计加入添加剂,添加量以鲜质量为基础,装入聚乙烯袋,每袋质量约200 g,用真空包装机抽真空并封口,在室温条件下分别贮藏2、5、10和30 d后开封取样,进行微生物计测,青贮60 d分析青贮的发酵品质、化学成分。
1.5微生物菌数的计测 在超净工作台中将待测样品开封取样,将样品剪碎,混匀,称取5 g于装有45 mL无菌水的100 mL三角瓶中,摇床180 r·min-1,室温振荡30 min,将此溶液依次稀释10~109倍。用平板培养计数法进行菌数计测。MRS培养基在37 ℃厌氧条件下培养48 h,BLB、PDA、NA培养基在37 ℃有氧条件下培养48 h后计数。
1.6乳酸菌生化特性试验与糖发酵试验 选取从新鲜尖叶胡枝子上分离纯化的2株乳酸菌,进行温度、耐酸耐盐、葡萄糖产气等生化试验和糖发酵试验[7-9],将这2株乳酸菌进行初步鉴定。
1.7乳酸菌16S rRNA 基因序列测定及系统进化分析 对菌株16S rRNA 基因片段进行扩增,引物序列为27 f:5′-AGAGTTTGATCCTGGCTCAG-3′和1 492 r:5′-AAGTCGTAACAAGGTAACC-3′,由上海桑尼生物科技有限公司合成。PCR反应体系(50 μL):Sapphire Amp Fast PCR Master Mix (购自日本株式会社)25 μL,引物27 f和1 492 r(20 pm)各2 μL,ddH2O 补足至50 μL,挑取培养24~48 h的乳酸菌单菌落于反应体系中混匀;PCR扩增程序:94 ℃ 5 min,94 ℃ 50 s,55 ℃ 50 s,72 ℃延伸2 min,30个循环后,72 ℃ 10 min,4 ℃保存。PCR 扩增产物在1%琼脂糖凝胶上电泳检测。将PCR扩增产物送至上海生工生物工程有限公司进行正、反测序。序列在GenBank数据库中进行BLAST同源性比对,用Mega 4.0软件分析菌株与参考菌种亲缘关系,利用软件中的cluster W 方法构建系统进化树。
1.8产酸速率测定 将分离并鉴定的乳酸菌分别按3%的接种量传入MRS液体培养基中,37 ℃恒温培养。每隔2 h测定不同菌株发酵液pH值[10]。
1.9生长曲线的测定 用待测菌株24 h的培养液,以3%的接种量接入MRS液体培养基中,于37 ℃培养箱中培养36 h,每隔2 h取一次样品,放于4 ℃冰箱中,最后以培养基为空白,在620 nm下测定样品的吸光度值,以培养时间为横坐标,相对应的吸光值为纵坐标,绘制生长曲线。
1.10青贮发酵化学成分测定 取青贮样品20 g,加入180 mL去离子水中,搅拌摇匀,放入4 ℃冰箱中静置24 h,取出用4层粗纱布过滤到烧杯中,再用定量滤纸过滤到三角瓶中,再用pH测定仪(雷磁PHS-3C)测定滤液pH值;采用滴定法测定青贮原料的缓冲能[11];采用苯酚-次氯酸钠比色法测定氨态氮(NH3-N)含量[12];采用烘箱干燥法测定干物质(DM)含量;采用凯氏定氮法测定粗蛋白质(CP)含量[13];采用范氏洗涤纤维法测定中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量[14];采用蒽酮-硫酸比色法测定可溶性碳水化合物(WSC)含量[15];使用SHIMADZE-10A型高效液相色谱仪检测滤液中的乳酸、乙酸、丙酸、丁酸含量[16]。青贮饲料品质评价采用弗氏Flieg评分法[17-18]。
1.11数据分析 基础数据整理用Excel软件,用SAS(12.0版)软件程序对数据进行方差分析。
2 结果与分析
2.1分离乳酸菌生化鉴定 从新鲜尖叶胡枝子材料中分离出2株乳酸菌,分别编号为LH29和LH33,显微镜观察发现LH29为球菌,LH33为杆菌。对这2株乳酸菌进行生化试验(表1)和糖发酵试验(表2)。菌株LH29革兰氏阳性,过氧化氢酶阴性,发酵葡萄糖不产气,属同型乳酸发酵类型,45 ℃生长,可发酵葡萄糖、木糖、果糖、熊果甘、核糖、海藻糖,不能发酵山梨醇,与戊糖片球菌发酵特性相似,故将LH29初步鉴定为戊糖片球菌(Pediococcuspentosaceus)[19]。菌株LH33革兰氏阳性,能够发酵苦杏仁甙、纤维二糖、七叶灵、果糖、葡萄糖、麦芽糖、乳糖、甘露糖、甘露醇、蜜二糖、棉籽糖、核糖、山梨醇、蔗糖和海藻糖,不能发酵鼠李糖,与植物乳杆菌发酵特性相似,故将LH33初步鉴定为植物乳杆菌(Lactobacillisplantarum)。
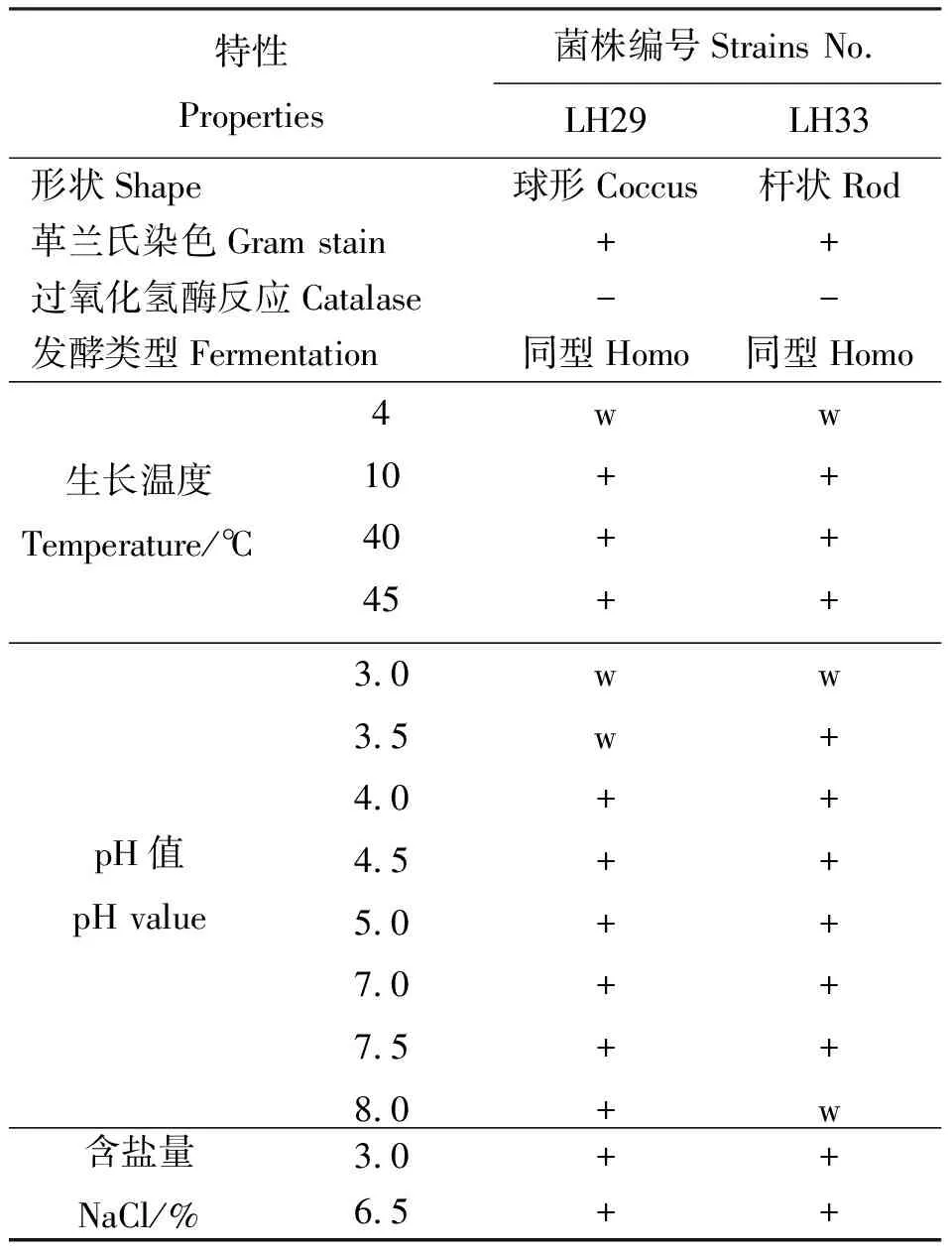
表1 分离菌株生理生化特性
2.2分离菌株16S rRNA 基因序列分析 菌株LH29和LH33经PCR扩增所获得的16S rRNA 基因部分序列长度分别为1 481和1 474 bp。在GenBank中进行16S rRNA基因同源性序列比对,结果显示,分离菌株LH29与多株P.pentosaceus菌株的16S rRNA 基因序列相似性均达99%,与菌株P.pentosaceusMJK7(登录号AB494722.1)的同源性达100%;经比对菌株LH33与多株L.plantarum菌株的16S rRNA 基因序列相似性均超过99%,利用MEGA4.0 软件将分离菌株与部分参考菌株(表3)基于16S rRNA 基因序列构建系统发育树(图1),结合菌株形态学及生化特性,可将菌株LH29和LH33分别鉴定为戊糖片球菌和植物乳杆菌。
2.3分离菌株产酸速率和生长速度比较 菌株LH29和LH33是从新鲜的尖叶胡枝子上分离的两株乳酸菌,它们的产酸能力和生长速度对青贮品质有很大影响。比较LH29和LH33的产酸速率(图2)发现,0~4 h LH29的pH值下降的速度略快于LH33,而LH33在发酵6~12 h pH值下降趋势比LH29更为明显,LH33和LH29在发酵12 h后的pH值分别达到4.2和4.4。
菌株LH29和LH33生长迅速,几乎观察不到迟缓期(图3),很快进入对数生长期(2~8 h),10 h后生长趋于平缓,进入生长稳定期,培养到36 h未见到衰退期。比较而言,对数生长时期LH29生长速度较LH33快,对应产生乳酸较多,pH值下降较快;而进入生长稳定期后,菌株LH33的吸光值高于LH29,同时对应的LH33的pH值也要低于LH29。
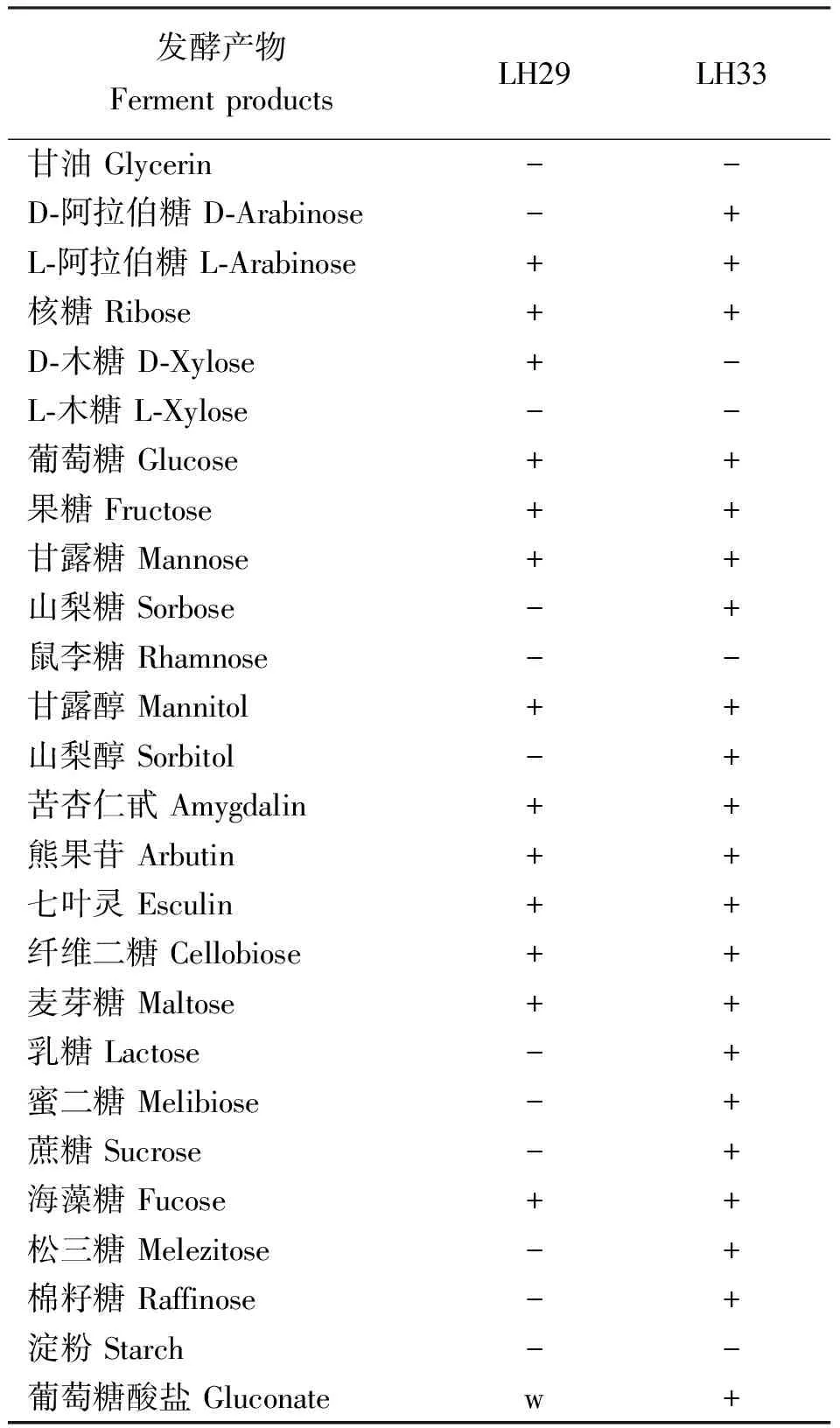
表2 分离株菌的糖发酵结果
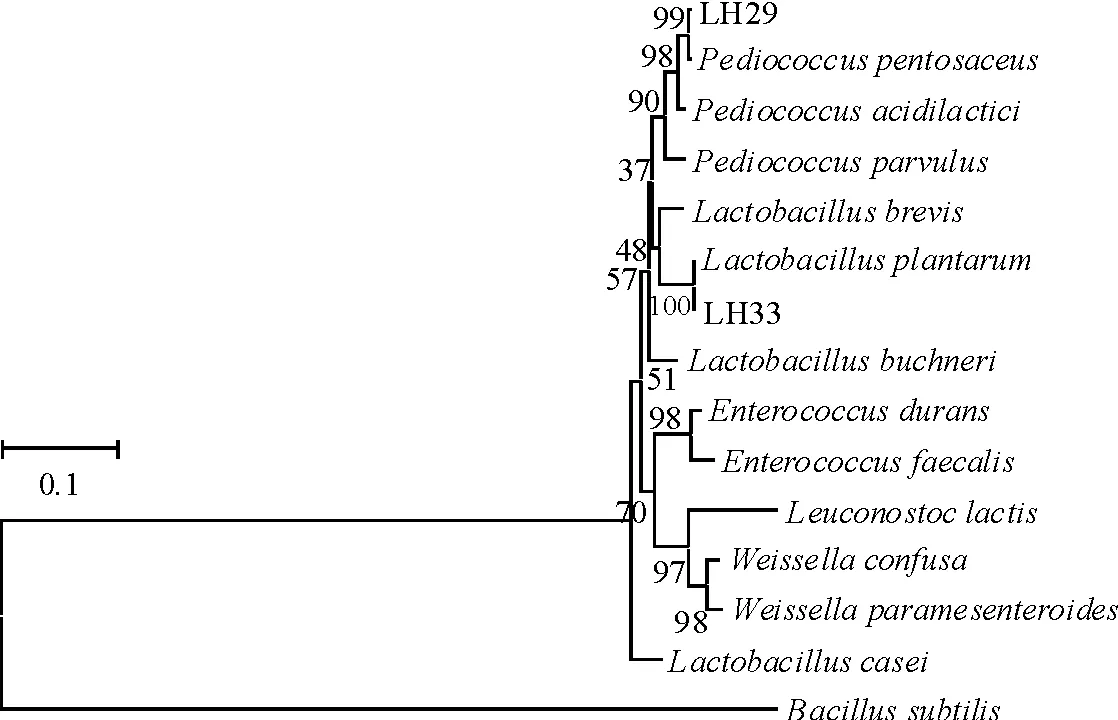
图1 分离菌株16S rRNA序列系统进化树
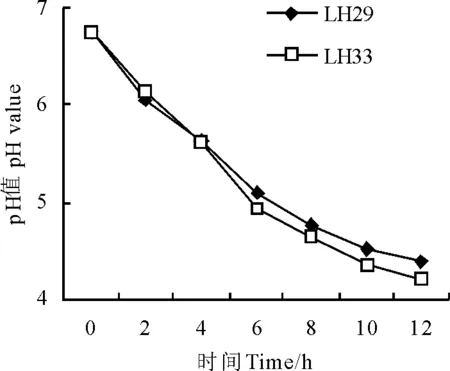
图2 分离株菌产酸速率曲线

图3 分离株菌生长曲线
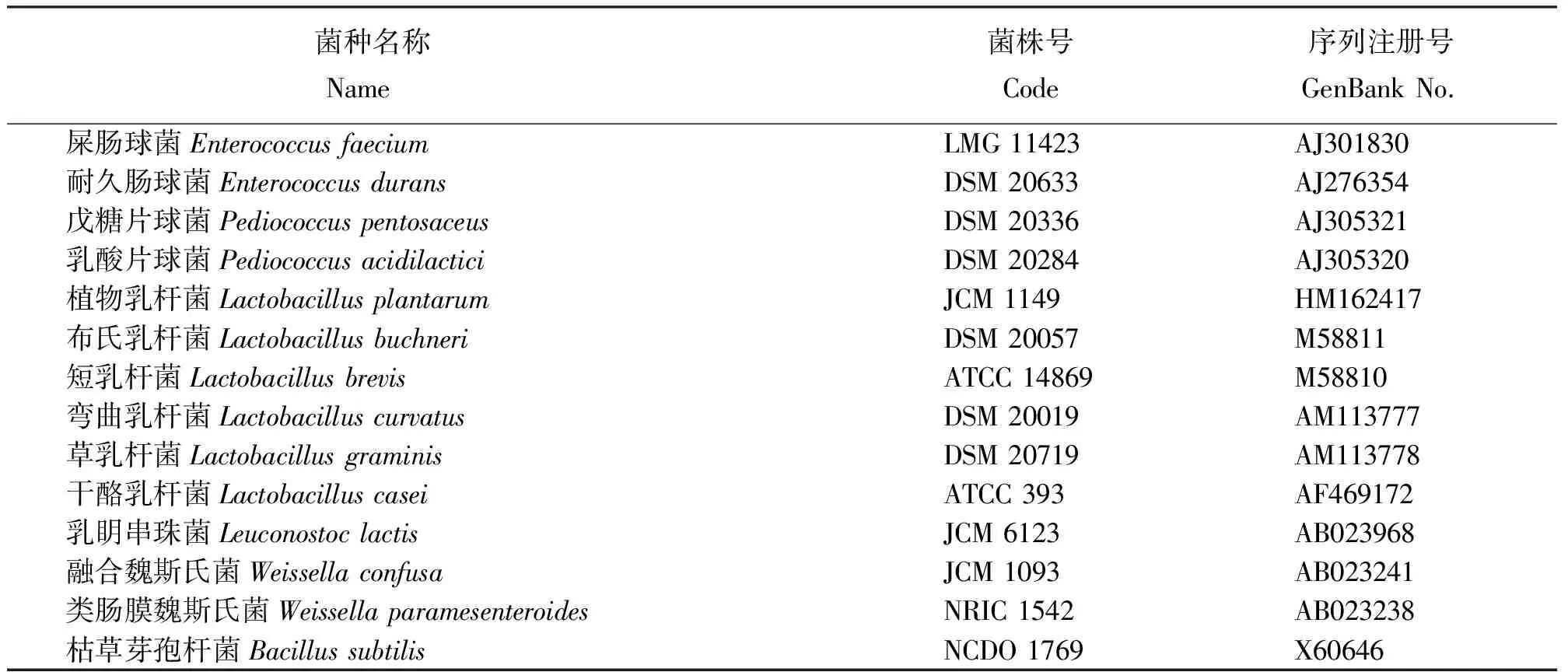
表3 构建系统进化树的乳酸菌参考菌株
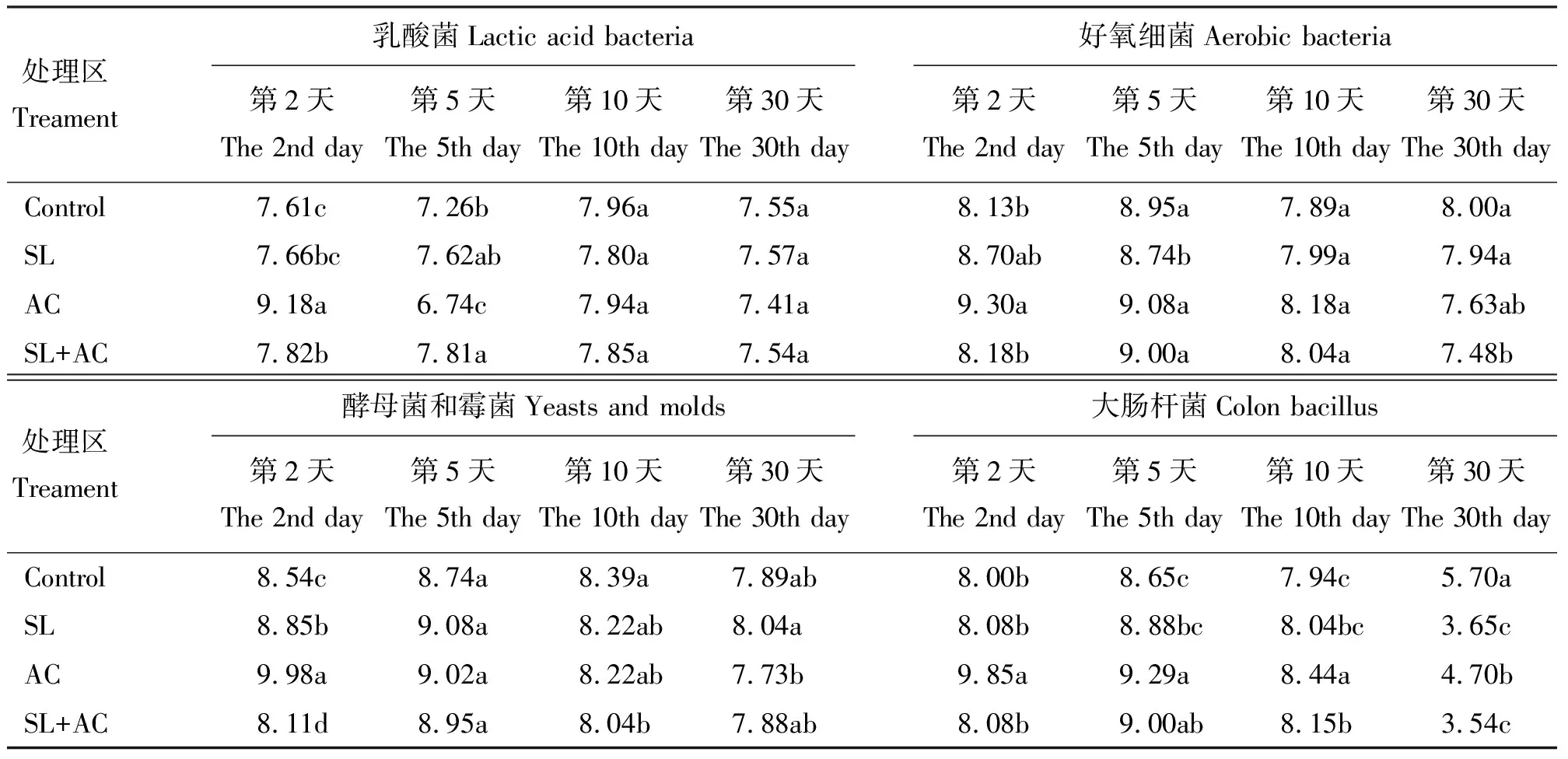
表4 尖叶胡枝子青贮发酵过程中微生物数量的变化
在设定的试验条件下,菌株LH33的生长情况和产酸能力比LH29要好。
2.4青贮过程中微生物数量的变化 自然条件下生长的饲草表面附生着大量微生物,试验测得每克尖叶胡枝子上附生的乳酸菌数量为3.70 cfu,好氧细菌为5.60 cfu,酵母菌与霉菌为6.65 cfu,大肠杆菌为3.90 cfu,乳酸菌的数量远少于霉菌、酵母、好氧细菌以及大肠杆菌的数量,原料表面附生的乳酸菌数均未达到良好发酵所需的105cfu·g-1的最低水平[20]。尖叶胡枝子发酵过程中微生物数量的动态变化如表4所示,在发酵第2天,添加AC处理组的乳酸菌数量最多,SL+AC添加组的乳酸菌的数量显著高于对照组(P<0.05);第5天,AC添加组乳酸菌数量下降很快,显著低于其他添加组及对照组(P<0.05);在第10天至第30天,乳酸菌数量无明显变化,维持在107~108cfu·g-1,各组间无显著性差异(P>0.05)。好氧细菌在发酵的第2天和第5天数量较多,后缓慢下降,第30天,SL+AC添加组好氧细菌数量显著低于对照和SL添加组(P<0.05)。酵母菌和霉菌在发酵的第2天,AC添加组数量最多,显著高于其他组(P<0.05),以后数量逐渐减少,在发酵第30天,SL添加组酵母菌和霉菌数量显著高于AC添加组。大肠杆菌数量在发酵最初几天数量较多,在发酵第30天,各处理组大肠杆菌数量从108cfu左右迅速下降为104cfu左右,对照组的大肠杆菌数量显著高于其他添加组(P<0.05)。
2.5尖叶胡枝子青贮发酵品质 尖叶胡枝子青贮发酵品质结果显示(表5),与对照相比,添加SL和SL+AC处理的pH值显著低于对照组(P<0.05),添加AC处理的pH值也低于对照组,但差异不显著(P>0.05);添加SL、AC及SL+AC处理的乳酸含量均显著增加(P<0.05);添加AC及SL+AC处理的乙酸含量显著低于对照组(P<0.05);添加AC处理的丙酸生成量显著高于对照及其他处理,SL+AC处理丙酸的生成量最少;对照组的丁酸含量显著高于其他处理(P<0.05);添加SL和SL+AC处理的总酸含量显著高于对照组和添加AC组(P<0.05);对照组的氨态氮含量最高,添加SL+AC处理的氨态氮含量显著低于SL和AC处理组。
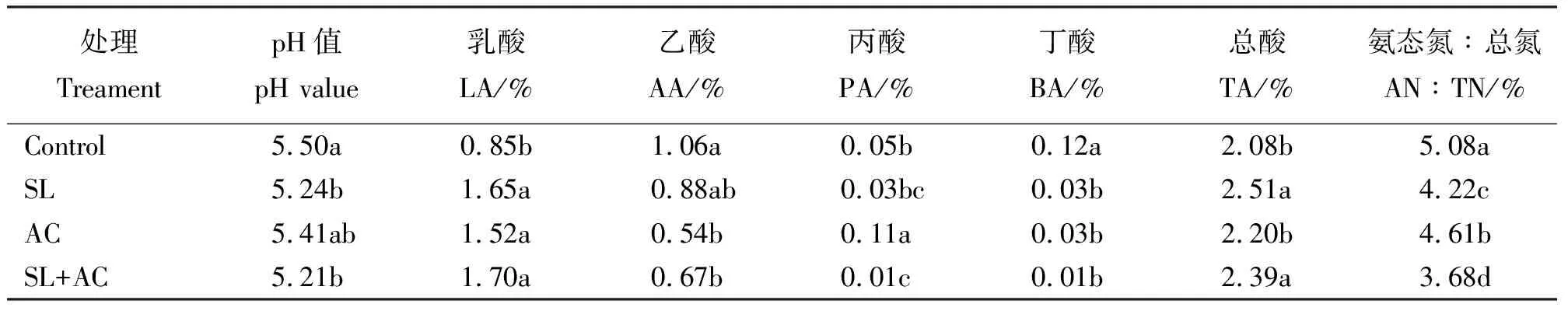
表5 尖叶胡枝子青贮饲料的发酵品质
2.6尖叶胡枝子青贮饲料化学成分 尖叶胡枝子青贮饲料化学成分(表6)显示,各处理组的干物质含量无显著差异(P>0.05);SL、AC及SL+AC处理的可溶性碳水化合物含量显著高于对照(P<0.05);各添加组的中性洗涤纤维含量显著低于对照组(P<0.05);添加AC处理的酸性洗涤纤维含量显著低于对照及其他处理(P<0.05);添加SL处理的粗蛋白含量与添加AC处理无显著差异(P>0.05),但显著高于对照及SL+AC处理(P<0.05);SL+AC处理的粗脂肪含量显著高于对照和其他处理。
2.7青贮品质评价 对照组中乙酸占总酸的比例高于50%,表现为乙酸发酵类型。而添加剂处理组中乳酸占总酸的比例均高于60%,表现为乳酸发酵类型(表7)。
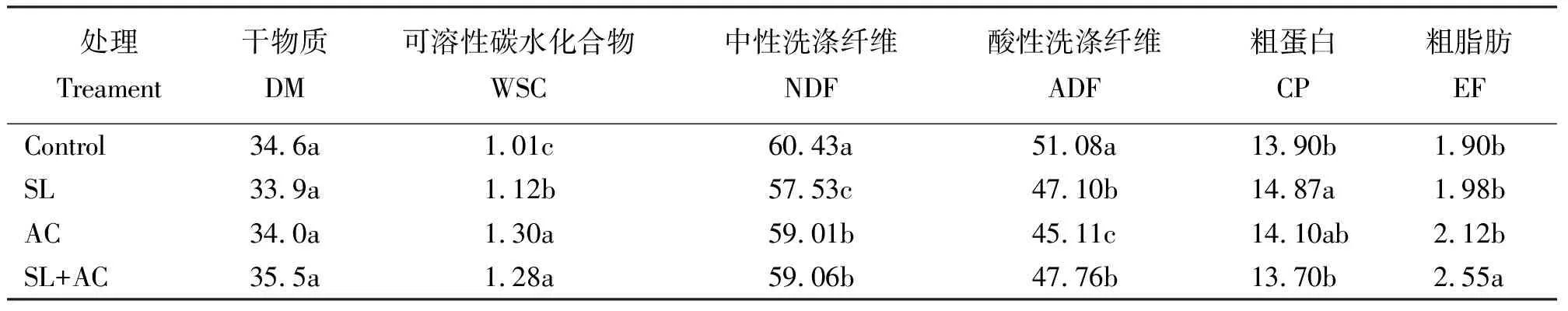
表6 尖叶胡枝子青贮饲料的化学成分
根据弗氏Flieg评分法和各种有机酸占总酸的比例,对各处理的青贮品质进行评分(表8),对照组的青贮品质为劣,SL处理组为良,AC处理组和SL+AC处理组得分为优。
3 讨论
自然环境下,不同作物上附生的乳酸菌无论从种类上还是数量上都是不同的,其种类和数量对青贮的发酵品质有较大的影响。本研究从新鲜的尖叶胡枝子上分离出2株乳酸菌,分别是戊糖片球菌和植物乳杆菌。从这2株菌的生长曲线及产酸速率曲线上看,戊糖片球菌在青贮发酵初期生长速度及产酸速率优于植物乳杆菌,在发酵中后期植物乳杆菌表现更好。植物乳杆菌产酸能力强、生长速度快,适合作青贮饲料乳酸菌添加剂的菌种。研究表明,青贮饲料发酵初期,片球菌起着非常重要的作用[21]。实际应用情况表明,由于不同乳酸菌菌株在青贮过程中起的作用不同,单独使用一种菌株有时并不能达到让人满意的青贮效果,乳酸菌青贮添加剂通常都是植物乳杆菌和其他菌种结合组成的混合物,一般情况下,选用乳酸球菌,乳酸球菌在发酵初期繁殖旺盛,乳酸杆菌则在发酵的整个过程中起到了主导作用。
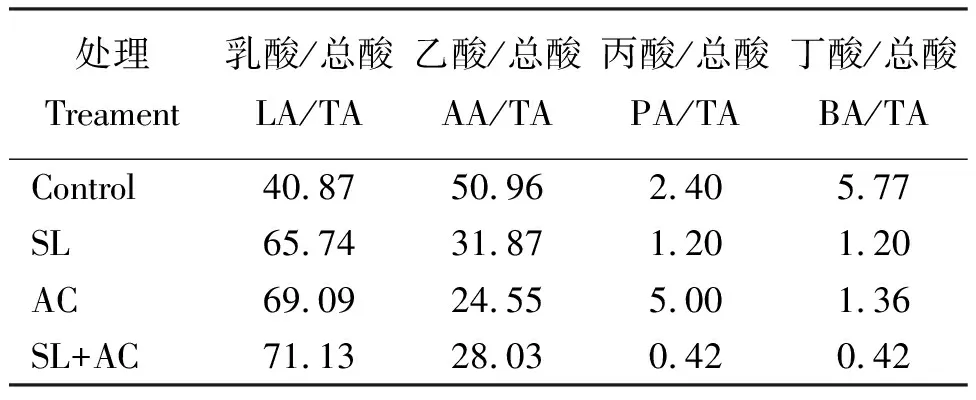
表7 尖叶胡枝子青贮有机酸占总酸比例
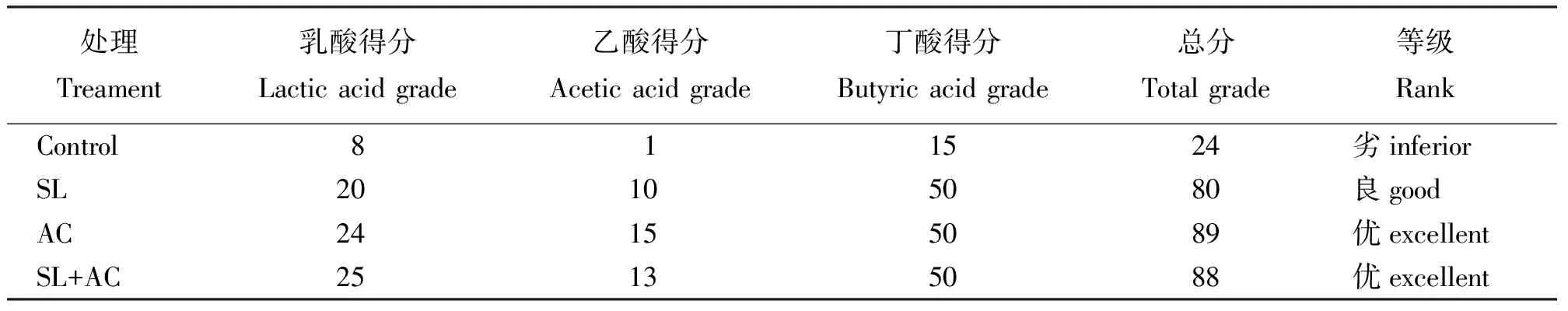
表8 尖叶胡枝子青贮饲料的Flieg评价
青贮原料发酵开始后,由于各种微生物利用原料中的糖分生长繁殖,数量较青贮原料上的有较大的增长,在尖叶胡枝子发酵过程中,添加纤维素酶处理的乳酸菌、好氧细菌、酵母菌和霉菌、大肠杆菌在发酵最初都保持较高数量,这可能与原料用粉碎机粉碎及纤维素酶可破坏青贮料细胞壁使其内容物流出[22],为各类微生物生长提供充足底物有关系。到发酵后期,由于乳酸菌利用可溶性糖发酵,降低了pH值,抑制了酵母菌和霉菌、大肠杆菌的生长,其数量下降很快,同时乳酸菌的数量也有一定减少。
从试验结果看,直接青贮pH值较高,氨态氮及丁酸生成量较多,乳酸含量少, Flieg青贮饲料评分等级为劣,这可能是由于尖叶胡枝子属于豆科牧草,缓冲能较高,可溶性碳水化合物含量较少,未能达到调制优质青贮饲料所需要的8%~10%含量[23],同时原料草表面附着乳酸菌数量很少,且不良菌种(酵母菌、霉菌和好氧细菌等)的数量远高于乳酸菌的数量。本试验选用的2种添加剂因其主要成分为乳酸菌和纤维素酶,保证了青贮发酵初期发酵所需的足够乳酸菌数量及可溶性糖含量,并通过乳酸菌发酵产生大量乳酸降低了pH值,抑制了不良微生物的活动,提高了粗脂肪含量,降低了粗蛋白降解,减少了发酵过程中营养物质的损失,改善了青贮饲料的发酵品质。
4 结论
从新鲜尖叶胡枝子原料中分离出2株乳酸菌,一株为植物乳杆菌,另一株为戊糖片球菌。在发酵初期戊糖片球菌产酸速率优于植物乳杆菌,在发酵中后期后者产酸速率优于前者。
在尖叶胡枝子青贮过程中,纤维素酶添加组的乳酸菌数量在贮藏后第2天达到最大值,其他组在第10天达到最大值,然后缓慢下降,发酵第30天,乳酸菌的数量维持在107cfu左右,好氧细菌、酵母菌、霉菌及大肠杆菌的数量也有所减少,大肠杆菌减少更明显。
添加剂处理组与对照组相比,pH值、氨态氮及丁酸含量显著降低(P<0.05),乳酸含量明显提高(P<0.05),发酵品质好于对照,其中添加纤维素酶及乳酸菌和纤维素酶混合添加处理的青贮饲料发酵品质Flieg等级为优。
[1]徐春波.胡枝子属牧草种质资源描述规范和数据标准[M].北京:中国农业出版社,2008.
[2]陈默君,贾慎修,黄兆华.中国饲料植物志(第二卷)[M].北京:中国农业出版社,1989.
[3]王莹,玉柱,于艳冬.添加剂对扁蓿豆青贮饲料影响的研究[J].草业科学,2010,27(2):129-133.
[4]玉柱,魏馨,于艳冬,等.添加剂对尖叶胡枝子青贮发酵品质及体外消化率的影响[J].草业学报,2009,18(5):73-79.
[5]王莹,玉柱.不同添加剂对紫花苜蓿发酵品质的影响[J].中国草地学报,2010,32(5):80-83.
[6]孙启忠,玉柱,樊丽娟,等.添加剂在四种灌木类饲用植物青贮中的应用[J].中国农业科技导报,2009,11(5):130-133.
[7]Kandler O,Weiss N Bereys.Manual of Systematic Bacteriology[M].Baltimore:Williams & Wilkins,1986:1047-1245.
[8]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-313.
[10]张慧杰,玉柱,王林,等.青贮饲料中乳酸菌的分离鉴定及优良菌株筛选[J].草地学报,2011,19(1):137-141.
[11]Playne M J,McDonald P.The buffering constituents of herbage and silage[J].Journal of the Science of Food and Agriculture,1966,17:264-268.
[12]Broderica G A,Kang J H.Automated simultaneous determination of ammonia and amino acids in ruminal fluid andinvitromedia[J].Journal of Dairy Science,1980,33:64-75.
[13]Krishnamoorthy U,Muscato T V,Sniffer C J,etal.Nitrogen fractions in selected feed stuffs[J].Journal of Dairy Science,1982,65:217-225.
[14]Van Soest P J,Robertson J B,Lewis B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74:3583-3597.
[15]McDonald D,Henderson A R.Determination of watersoluble carbohydrates in grass[J].Journal of the Science of Food and Agriculture,1964,15:395-398.
[16]许庆方,玉柱,韩建国,等.高效液相色谱法测定紫花苜蓿青贮中的有机酸[J].草原与草坪,2007(2):63-67.
[17]张子仪.中国饲料学[M].北京:中国农业出版社,2000.
[18]李改英,陈玉霞,廉红霞,等.苜蓿青贮品质评定指标体系及测定方法的概述[J].草业科学,2010,27(8):151-154.
[19]王炜宏,杜晓华,张家超,等.内蒙古鄂尔多斯地区酸粥发酵液中乳酸菌的分离鉴定[J].食品与生物技术学报,2010,29(2):265-270.
[20]Tengerdy R P,Weinberg Z G,Szakacs G,etal.Ensiling alfalfa with additives of lactic acid bacteria and enzymes[J].Journal of the Science of Food and Agriculture,1991,55:215-228.
[21]Cai Y.Identification and characterization ofEnterococcusspecies isolated from forage crops and their influence on silage fermentation[J].Journal of Dairy Science,1999,82(11):2466-2471.
[22]许庆方,韩建国,玉柱.青贮渗出液的研究进展[J].草业科学,2005,22(11):90-93.
[23]刘建新,杨振海.青贮饲料的合理调制与质量评定标准[J].饲料工业,1999,20(3):4-7.
