氮与pH互作对菊苣4项生理指标的影响
2012-03-13杜金鸿王佺珍吴春会
解 宝,陈 果,杜金鸿,王佺珍,吴春会
(西北农林科技大学动物科技学院草业科学系,陕西 杨凌 712100)
菊苣(Cichoriumintybus)是以菊粉果聚糖形式积累能量的一种多年生宿根菊科植物,起源于地中海、中亚和北非,早在古希腊和古罗马时代就已被种植[1-3]。在我国主要分布于西北、华北、东北等暖温带地区,常见于山区、田边及荒地[4]。菊苣在欧洲栽培甚多,常被用作叶类蔬菜牧草和饲料、制糖原料及香料等。菊苣根中含有丰富的聚糖和芳香族物质,可提高消化器官的活动能力,具有大面积推广种植的价值,因此对于菊苣的研究备受关注[5]。菊苣自20世纪80年代引入我国后,又培育出大叶型牧草品种。由于其品质优良,已成为我国最有发展前途的饲料和经济作物[6]。
1 材料与方法
1.1试验材料 试验材料为西北农林科技大学王佺珍副教授在西北农林科技大学农一站试验地种植的菊苣。该品种有很强的耐土壤酸、碱性,但过高的酸性土壤抑制其增长。
1.2试验设计 于2010年在西北农林科技大学农一站全自动草业科学温室内进行盆栽试验。选取生长状况近似一致的菊苣幼苗种植于直径25 cm、高30 cm的塑料桶中,每盆7株。栽培基质为经冲洗、消毒过的河沙。栽植前用清水将菊苣苗根系所带土壤冲洗干净。
氮素和pH两个因素处理采用完全设计。氮素设置为3个水平,分别为0.5、1.0、2.0倍的Hoagland营养液N1(65.305 mg·L-1)、N2(130.61 mg·L-1)、N3(261.22 mg·L-1);pH也设置为3个水平,分别为pH1(5.5)、pH2(7.0)、pH3(8.5)。共9个组合,每个组合重复3次。
1.3测定指标与方法 叶绿素测定采用吸光度法[17],称取0.1 g新鲜叶片,加80%的丙酮研磨提取后在波长652 nm处测定光密度(Optical Density,OD)值,并计算叶绿素含量(mg·g-1)。 丙二醛(MDA)采用李合生[18]的巴比妥酸(TBA)显色法测定,过氧化物酶(POD)活性的测定采用愈创木酚法[19],超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法[20]。
2 结果与分析
2.1氮与pH对菊苣4种生理指标的影响
2.1.1氮处理对4种生理指标的影响 菊苣叶片叶绿素和MDA含量在不同氮质量浓度作用下差异不显著(P>0.05);但叶绿素在N2处理下含量最高,MDA含量最低(表1)。而POD与SOD活性变化表现一致:N1(低氮)>N2(中氮)>N3(高氮),且两者都表现出N1显著高于N2、N3处理(P<0.05)。
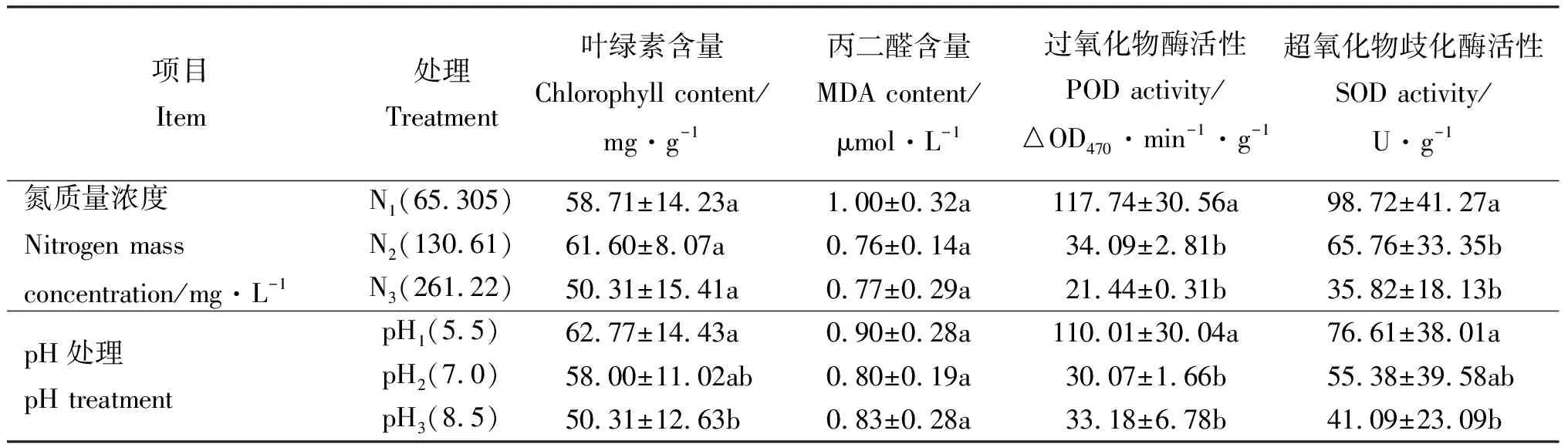
表1 不同氮质量浓度、pH对菊苣叶片4个生理指标的影响
2.1.2pH处理对4种生理指标的影响 菊苣叶片叶绿素含量随pH水平升高而降低,且pH1与pH3差异显著(P<0.05),pH2与pH3差异不显著(P>0.05)。MDA在不同水平的pH处理下差异不显著,但在pH2中性时,含量最低(表1)。POD活性在pH1时最高,分别为pH2和pH3的3.66倍和3.32倍。SOD活性随pH水平升高却呈现出下降趋势,且在pH3时达到最低值,pH1与pH3差异显著(P<0.05)。
2.2菊苣对氮与pH互作的生理反应
2.2.1氮与pH对菊苣叶片叶绿素含量的互作效应 从互作效应分析结果(图1-Ⅰ)可以看出,氮处理与pH可以同时对菊苣叶片叶绿素产生影响。在N3、pH1处理下,叶绿素含量达到最高;在N1、pH1和N3、pH3处理下,叶绿素含量较低,它们之间差异不显著(P>0.05),但二者与其他组合差异显著(P<0.05)。同时发现,在N1处理下,叶绿素含量随pH水平升高而升高,且pH1与pH2、pH3差异显著(P<0.05);在N2处理下,叶绿素含量随pH升高而降低,但3个处理间差异不显著(P>0.05);在N3处理下,叶绿素含量随pH升高而降低,且pH1、pH2与pH3差异显著(P<0.05)。
2.2.2氮与pH对菊苣叶片MDA含量的互作效应 氮与pH对菊苣叶片MDA(图1-Ⅱ)互作效应结果显示,在N3、pH1处理下,MDA含量为所有处理组合中最低,其次为N2、pH2组合,且与其他组合间差异显著(P<0.05)。在pH1处理下,MDA含量随氮质量浓度升高而降低,且N1、N2与N3差异显著(P<0.05)。在pH2处理下,N2表现出最低值,且与其他两者差异显著(P<0.05)。在pH3处理下,N2表现出最低值,但与其他两者差异不显著(P<0.05)。N1、pH1组合下,MDA含量为1.13 μmol·g-1,为所有组合中的最大值。
2.2.3氮与pH对菊苣叶片POD活性的互作效应 氮与pH互作对菊苣叶片POD(图1-Ⅲ)活性结果显示,在N1、pH1处理时受到强烈胁迫,POD活性明显上升,且其他处理组合间差异不显著(P>0.05),N3、pH3处理时活性最低。在pH一定时,POD活性表现为N1>N2>N3。说明氮浓度的升高可以缓解pH对菊苣生长的胁迫作用,使POD活性下降。
2.2.4氮与pH对菊苣叶片SOD含量的互作效应 对于菊苣叶片SOD活性的互作效应(图1-Ⅳ),在N1、pH1组合下SOD活性最高。在N3与pH2和pH3处理下,SOD活性较低,且与其他组合差异显著(P<0.05)。在N3处理下,SOD在pH1水平活性最高,且与其他两者差异显著(P<0.05)。在N1和N2处理下,SOD在pH2水平活性最低,而在pH1和pH3水平活性较高,且各组合间差异不显著(P>0.05)。在N3处理下,SOD活性随pH水平升高而降低,且在pH1水平最高,与其他两者差异显著(P<0.05)。在pH一定时,SOD活性表现为N1>N2>N3。
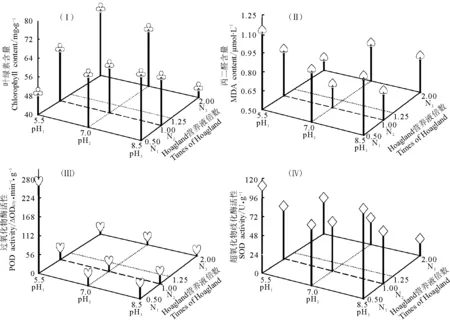
图1 氮与pH互作对叶绿素(Ⅰ)、MDA(Ⅱ)、POD(Ⅲ)和SOD(Ⅳ)的影响
2.34种生理指标的双因素方差分析 分别以氮浓度(0.5、1.0和2.0倍的Hoagland营养液)和pH水平(5.5、7.0和8.5)代表不同处理,对菊苣叶片叶绿素和MDA含量、SOD和POD活性与氮、pH之间的关系进行双因素方差分析(表2)。表2中F=方差(MS)/误差(Error),F值越大差异越大[21]。菊苣叶片的叶绿素含量双因素方差分析结果表现为pH水平的F值远大于氮浓度的F值,即pH处理对黄菊苣叶片叶绿素含量的影响远大于氮处理。但菊苣叶片MDA含量、SOD和POD活性的双因素方差分析结果表现为氮浓度的F值远大于pH水平的F值,即氮处理对黄菊苣叶片MDA含量、SOD和POD活性的影响远大于pH处理。
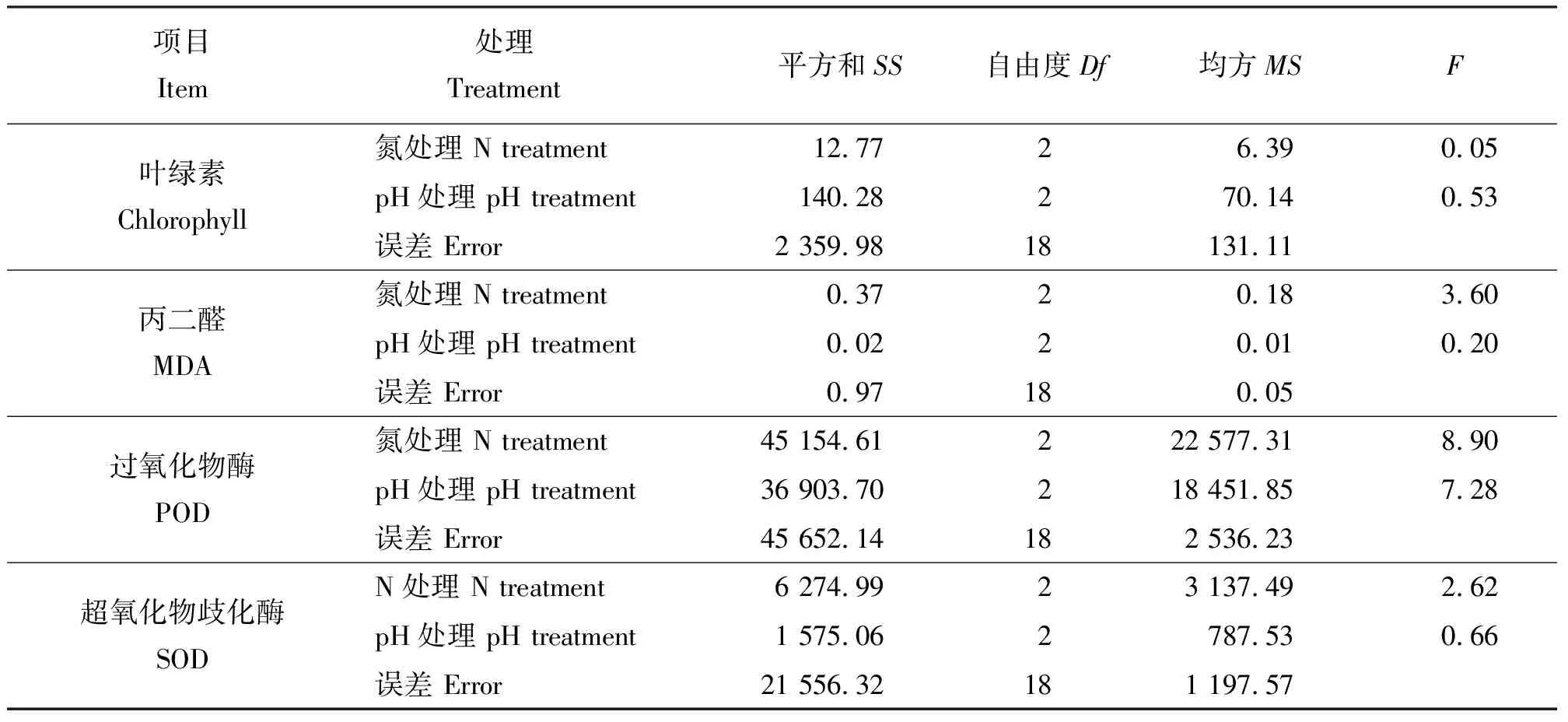
表2 双因素方差分析结果
3 讨论与结论
本试验采用3种不同氮浓度与3种普遍存在的土壤pH相互组合,模拟出9种类似于菊苣生境的土壤环境,通过比较其4种生理指标的变化,从而找到菊苣生长的最佳生境。结果表明,氮与pH对菊苣生长都有影响,且在一定范围内高浓度氮会促进菊苣生长,菊苣对pH适应范围较大,氮处理对菊苣生长影响明显比pH处理大。
Nakaji等[22]和Clement等[23]研究发现,叶片中氮含量的增加会改变与光合作用有关的酶的浓度和活性;在一定浓度范围内,氮含量的增加会引起核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)浓度和活性及叶绿素含量的增加,从而增加光合速率,但过量的氮则会引起植物体内的营养失衡,对光合作用产生不利影响。正常生长发育的植物细胞内存在精确的pH调控,细胞的代谢活动、DNA复制、细胞分裂等均随pH变化而被激活或抑制[24]。因此,当植物受到氮与pH胁迫时,其体内叶绿素和丙二醛含量及过氧化物酶和超氧化物酶活性会发生显著变化。
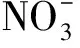
正常生长条件下,植物体内活性氧的产生和清除之间保持着一种动态平衡,当植物遭受胁迫时,这种平衡就被破坏,首先影响的是生物膜。往往发生膜脂过氧化作用,丙二醛是膜脂过氧化作用的最终分解产物,其含量可以反映植物遭受逆境伤害的程度。菊苣叶片丙二醛含量,在受到氮或pH胁迫时,虽然叶片细胞膜和叶绿素受到了不同程度的破坏,但各处理的丙二醛含量差异不显著,推测在胁迫发生时,植物本身可以通过自身的机制加以调节,使其细胞膜的破坏降到最小,丙二醛的含量变化甚微。丙二醛在高氮低pH和中氮中pH互作时含量较低,其他组合互作对菊苣生长产生胁迫,丙二醛含量显著上升。在受到胁迫时,植物体内活性氧产生与清除的动态平衡被打破,造成活性氧的积累,而过氧化物酶、超氧化物酶是植物体内活性氧清除系统中的2种重要抗氧化酶,能有效阻止活性氧在植物体内的积累,通常状况下过氧化物酶与超氧化物酶变化是协同变化的[27]。菊苣在受到低氮或低pH及低氮低pH互作胁迫时,过氧化物酶活性显著增加。因为植物在遭受逆境胁迫时,产生的氧自由基数量增多,为了抵抗逆境对植物造成的伤害,超氧化物歧化酶的活性增加,以便清除氧自由基,减少膜脂过氧化[28]。超氧化物酶活性在低氮或低pH及低氮低pH与低氮高pH胁迫时,活性明显增加。
综上所述,菊苣受到氮或pH胁迫时叶绿素含量显著下降,丙二醛含量变化不显著,其抗氧化酶系统中,超氧化物酶、过氧化物酶协同作用,维持了植物体内活性氧的产生和清除之间的动态平衡。从双因素方差分析结果可以得到,适度地提高氮浓度可以降低酸碱对植物生长的危害。植物的抗逆反应是一个涉及到众多基因,受多途径调控的复杂过程,有关菊苣在氮及酸碱胁迫下超氧化物酶、过氧化物酶活性诱导的分子机理尚需进一步深入研究。
[1]Awad W A,Ghareeb K,Bohm J.Evaluation of the chicory inulin efficacy on ameliorating the intestinal morphology and modulating the intestinal electrophysiological properties in broiler chickens[J].Journal of Animal Physiology and Animal Nutrition,2011,95:65-72.
[2]Mulabagal V,Wang H B,Ngouajio M,etal.Characterization and quantification of health beneficial anthocyanins in leaf chicory (Cichoriumintybus)varieties[J].European Food Research and Technology,2009,230:47-53.
[3]Plmuier W.Chicory improvement[J].Revueder Agriculture,1972,4:567-585.
[4]孟林,张国芳,李潮流,等.饲用菊苣引种及其高产栽培技术研究[J].草业学报,2005,14(1):82-88.
[5]程林梅,高洪文,赵茂林,等.菊苣组织培养与植株再生的研究[J].草业学报,2002,11(4):105-107.
[6]王佺珍,崔健.牧草菊苣及其利用潜力II利用价值和开发潜力[J].草业科学,2010,27(2):150-156.
[7]程林梅,孙毅,王亦学,等.菊苣农杆菌介导转化受体系统的研究(简报)[J].草业学报,2008,17(1):130-134.
[8]谷俊涛,赵红梅,刘祝玲,等.农杆菌介导白三叶草高效遗传转化和转基因植株再生[J].草业学报,2007,16(2):84-89.
[9]赵甍,王秀伟,毛子军,等.不同氮素浓度下CO2浓度、温度对蒙古栎(Quercusmongolica)幼苗叶绿素含量的影响[J].植物研究,2006,26(3):337-341.
[10]Pons T L,van der Werf A,Lambers H.Photosynthetic nitrogen use efficiency of inherently slow-and-fast-growing species:possible explanations for observed differences[A].In:Roy J,Garnier E(eds).A Whole-Plant Perspective of Carbon-Nitrogen Interactions[C].The Hague:SPB Academic Publishing,1994:61-77.
[11]张耀鸿,张富存,李映雪,等.外源氮输入对互花米草生长及叶特征的影响[J].生态环境学报,2010,19(10):2297-2301.
[12]Brown K R,Thompson W A,Weetman G F.Effects of N addition rates on the productivity ofPiceasitchensis,Thujaplicata,andTsugaheterophyllaseedlings.1.Growth rates,biomass allocation and macroelement nutrition[J].Trees-Structure and Function,1996,10:189-197.
[13]徐晓锋,苗艳芳,张菊萍,等.保护地土壤氮、磷积累及影响研究[J].中国生态农业学报,2008,16(2):292-296.
[14]赵彦坤,张文胜,王幼宁,等.高pH对植物生长发育的影响及其分子生物学研究进展[J].中国生态农业学报,2008,16(3):783-787.
[15]Ruan J Y,Gerendas J,Hardter R,etal.Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea (Camelliasinensis)plants[J].Annals of Botany,2007,99:301-310.
[16]潘静娴,黄丹枫,王世平,等.育苗基质pH对甜瓜穴盘苗营养特性的影响[J].植物营养与肥料学报,2002,8(2):251-253.
[17]盛宏达.植物生理学实验指导[M].西安:陕西科学技术出版社,1986.
[18]李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[19]陈建勋,下晓峰.植物生理学试验指导[M].广州:华南理工大学出版社,2002.
[20]张志良.植物生理学试验指导[M].北京:高等教育出版社,2001.
[21]冯建永,庞民好,张金林,等.复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探[J].草业学报,2010,19(5):77-86.
[22]Nakaji T,Fukami M,Dokiya Y,etal.Effects of high nitrogen load on growth,photosynthesis and nutrient status ofCryptomeriajaponicaandPinusdensifloraseedlings[J].Trees-Structure and Function,2001,15: 453-461.
[24]周文彬,邱报胜.植物细胞内pH的测定[J].植物生理学通讯,2004,40(6):724-728.
[25]贾文庆,刘会超.NaCl胁迫对白三叶一些生理特性的影响[J].草业科学,2009,26(8):187-189.
[26]吴杏春,林文雄,洪清培,等.模拟酸雨对草坪草若干生理指标的影响[J].草业科学,2004,21(8):88-92.
[27]王艳芳,韩冰,张占雄,等.锡林郭勒草原克氏针茅抗旱生理变化的研究[J].草业科学,2006,23(2):22-26.
[28]张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
