脆性X智力低下蛋白在大肠杆菌中的表达及纯化
2012-03-06李芳芳崔芳芳邹检平
李芳芳 郭 永 崔芳芳,3 丁 宁 张 嵘 邹检平,*
1.国家人口计生委科学技术研究所(北京,100081);2.沈阳药科大学生命科学与生物制药学院;3.河南大学药学院
脆性X综合征(FXS)是一种常见的遗传性智力低下综合征,其发病率仅次于唐氏综合征,男性为1/4 000,女性为 1/6 000[1]。FXS 患者在智障人群中所占比例为2.6% ~8.7%[2],目前尚无有效的治疗方法,国外非常重视 FXS的筛查,以早期检出FXS患者,针对性地对患儿进行生活技能训练。有些国家(如以色列、芬兰)已在孕妇中进行常规筛查,防止患儿出生[3]。早期进行FXS筛查诊断可以对患儿进行早期干预,同时,对其家庭进行完善的基因型检测,可以指导优生优育,防止智力低下人口的出生,从而提高人口素质[4]。因此深入研究FXS,开发一种快速、简便、价廉、可靠的诊断方法意义深远。脆性X智力低下蛋白(FMRP)在成人和胎儿大脑和睾丸组织内都有高水平表达[5],因此本研究中选择以人脑 cDNA文库为模板进行 PCR扩增,获得FMR1基因后在大肠杆菌表达系统中完成FMRP重组表达,经亲和纯化得到GST-FMRP融合蛋白,为下一步FMRP抗体的制备以及FXS的快速、高通量检测方法确立奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 GST融合蛋白的表达载体pGEX-6P-1由本所张传领博士惠赠;表达宿主菌BL21(DE3)pLysS感受态细胞购自北京天根公司。1.1.2酶与试剂 人脑 cDNA文库(质粒 DNA)和DNA marker购自TaKaRa;谷胱甘肽-琼脂糖凝胶4B凝胶纯化柱及填料购自GE Healthcare;苯甲基磺酰氟(PMSF)、还原型谷胱甘肽、异丙基硫代半乳糖苷(IPTG)、二硫苏糖醇(DTT)、溶菌酶及十二烷基肌氨酸钠(NLS)购自Merck;PhusionTM超保真DNA聚合酶、限制性内切酶、dNTP、T4 DNA连接酶及蛋白Ladder购自NEB;质粒提取及胶回收试剂盒购自QIAGEN;0.45μm PVDF膜及鼠抗人 FMRP单克隆抗体购自Millipore;鼠抗GST单克隆抗体及辣根酶标记山羊抗小鼠IgG(H+L)购自中杉金桥公司;Western blotting发光试剂购自SANTA CRUZ;其余试剂均为国产分析纯。
1.1.3 特异扩增 FMR1的引物 根据 FMR1 cDNA序列合成特异性上下游引物,在其5'和3'末端分别引入限制性内切酶EcoR I和Sal I的识别位点,所有引物均由 Invitrogen公司合成。上游引物:5'-CCGGAATTCGAGGAGCTGGTGGTGGAAG-3';下游引物:5'-CGCGTCGACTTATCCATTCACGAGTGGTTGC -3'。
1.2 方法
1.2.1 重组表达质粒pGEX-FMR1的构建 以人脑cDNA文库为模板PCR扩增FMR1:98℃预变性30s,98℃变性 10s,65℃ 退火 30s,72℃ 变性 45s,35个循环后72℃10min。回收纯化以上PCR产物,用EcoR I和Sal I双酶切;与同样用EcoR I和Sal I双酶切的表达载体pGEX-6P-1连接,构建出表达FMRP前端融合GST蛋白的重组表达载体,转化BL21(DE3)pLysS感受态细胞。菌落PCR进行阳性克隆检测,提取阳性克隆的pGEX-FMR1质粒后进行测序确认。
1.2.2 融合蛋白的诱导表达 将pGEX-FMR1质粒转化大肠杆菌BL21(DE3)pLysS,挑取单克隆,摇床220rpm/min、37℃培养过夜后以1:50接种于50m l LB培养基,继续培养约2h至 OD600=0.4~1.0,加入终浓度为0.5mM 的 IPTG,诱导 1、3、5、7h各取1ml菌悬液4 000rpm/min离心10min收集菌体,加入500μl 1×SDS上样缓冲液(50mM Tris-HCl,100mM DTT,2%SDS,0.1% 溴酚蓝,10% 甘油),沸水煮5min后10%SDS-PAGE进行融合蛋白检测。以pGEX-6P-1空载体转化BL21(DE3)pLysS细胞作为对照,同时每组设立以等体积H2O代替IPTG的非诱导阴性对照。
1.2.3 融合蛋白的纯化 挑取单克隆接种培养过夜后以1:50接种于50m l LB培养基,继续培养至OD600=0.4 ~1.0,加入IPTG 终浓度为0.5mM 诱导7h,将培养物4 000rpm/min离心5min收集菌体,以5ml冰浴的 STE(10 mM Tris- HCl,pH 8.0,150 mM NaCl,1mM EDTA)洗涤菌体一次,以 3ml含100μg/ml溶菌酶的 STE重悬,冰浴15min后加入DTT至终浓度5mM,PMSF至终浓度1mM,10%NLS至终浓度1.5%。涡旋5~10s混匀,冰上超声破碎30s,间隔 90s,共 5 次,13 000rpm/min 4℃ 离心10min。取上清,加入1ml 10%TritonX-100(终浓度3%),涡旋5~10s,准备上柱加样。
以5ml PBS洗谷胱甘肽-琼脂糖凝胶4B填料,小于2 000rpm/min离心,弃上清,PBS重复洗涤两次。以储存缓冲液(50mM HEPES缓冲液,pH 7.4,150mM NaCl,5mM DTT,10% 甘油)重悬装柱,加入处理好的样品。以1ml Elution缓冲液(75mM HEPES 缓冲液,pH 7.4,150mM NaCl,5mM DTT,10mM还原型谷胱甘肽,0.1%Triton X-100)洗脱。收集洗脱液,每管约100μl,SDS-PAGE检测每管洗脱液。
2 结果
2.1 重组表达质粒pGEX-FMR1的构建
以人脑cDNA文库为模板进行PCR扩增获得FMR1基因(图 1)。经胶回收、双酶切、连接至pGEX-6P-1载体转化BL21(DE3)感受态细胞。菌落PCR检测出两个阳性克隆(图2),琼脂糖凝胶电泳显示产物略小于2 000bp,与预期结果一致。提取阳性克隆的质粒由华大基因公司进行序列测定,确保编码区准确、无突变。测序结果经NCBI在线BLAST,结果显示11号阳性克隆序列与FMR1 transcript variant ISO10一致,为1 640bp,12号阳性克隆序列与transcript variant ISO7一致,为1 836bp。
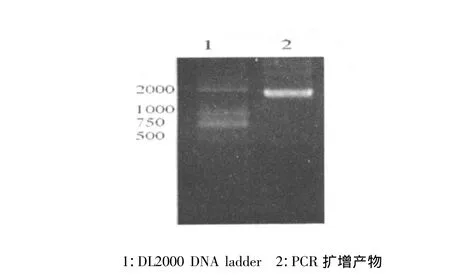
图1 PCR扩增的FMR1基因的凝胶电泳图
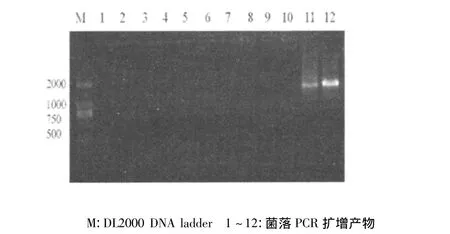
图2 PCR鉴定菌落含阳性重组克隆菌
2.2 融合蛋白GST-FMRP的表达
pGEX-FMR1 ISO10和pGEX-FMR1 ISO7质粒分别转化BL21(DE3)pLysS宿主菌。FMR1 ISO7为1 836bp,可编码蛋白约68.9kDa;FMR1 ISO10大小为 1 640bp,可编码蛋白大小约 48.7kDa。含pGEX-FMR1 ISO10质粒的宿主菌经0.5mM IPTG诱导,在约75 kDa处有明显蛋白表达,与预期结果相符(FMRP ISO10为 48.7kDa,GST标签蛋白约26kDa)有文献报道对于FMRP的大肠杆菌重组表达、真核细胞重组表达及体外表达由于产量过低都不够理想[6]。本实验中含pGEX-FMR1 ISO7质粒的宿主菌,经0.5mM IPTG诱导在预期的约95 kDa处(FMRP ISO7为 68.9kDa,GST标签蛋白约26kDa)也没有明显蛋白表达(图3)。
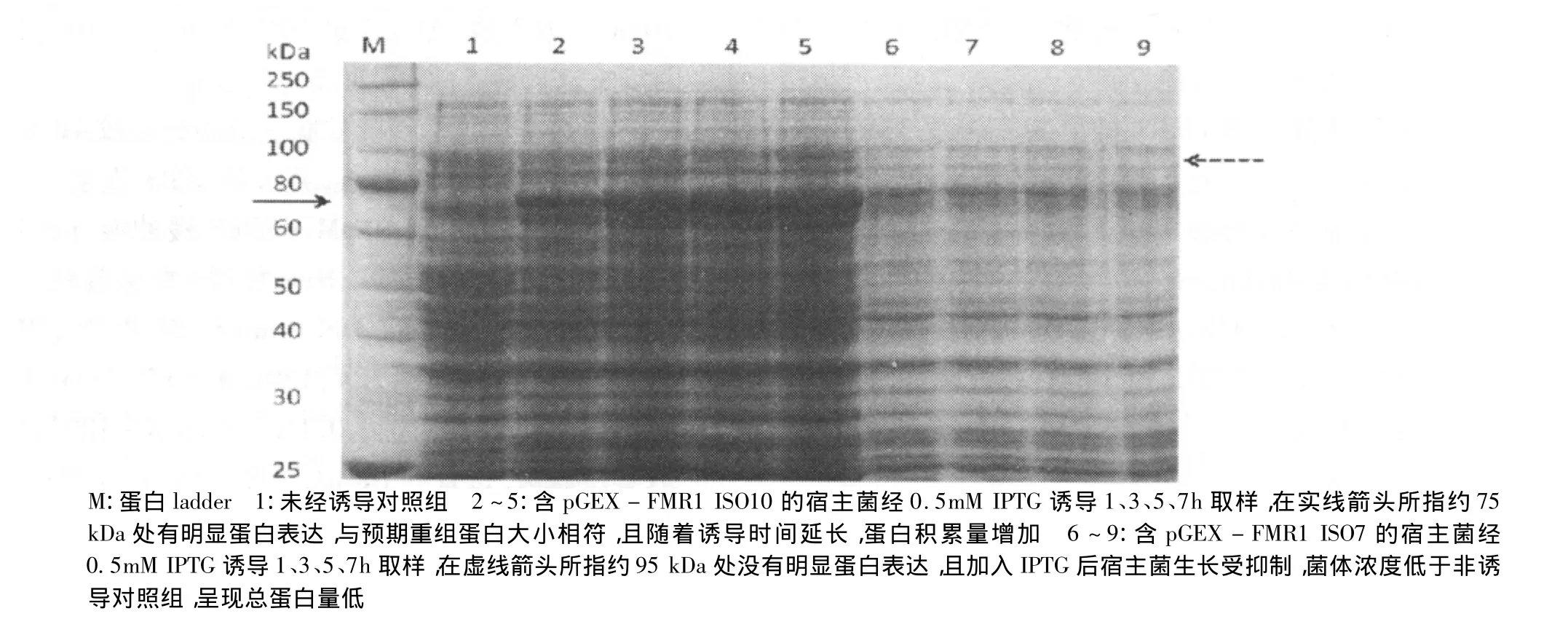
图3 SDS-PAGE分析融合蛋白GST-FMRP ISO10及ISO7的表达差异
2.3 融合蛋白GST-FMRP ISO10的纯化
谷胱甘肽-琼脂糖凝胶4B凝胶柱和NLS应用在GST-FMRP ISO10的纯化过程中。10%SDSPAGE和 Western blot检测蛋白纯化产物,SDSPAGE凝胶电泳显示纯化蛋白约为75kDa(图4),对纯化产物以鼠抗人FMRP单克隆抗体和鼠抗GST单克隆抗体分别进行Western blot检测,结果均呈阳性(图5)。
3 讨论
FXS成因是脆性X智力低下基因1(FMR1)所编码的FMRP的表达降低或缺失。FMR1基因位于X染色体的长臂远端 Xq27.3区的脆性部位,由17个外显子和16个内含子组成,全长约38kb,在哺乳动物间高度保守[7]。FMR1基因5'非翻译区存在一段数目可变的(CGG)n重复序列,其上游250bp处存在一个CpG岛。(CGG)n三核苷酸重复序列的异常扩增、CpG岛的异常甲基化以及基因缺失和基因点突变都可导致FMR1的非正常翻译,引起FMRP表达降低甚至缺失,从而造成临床症状[8,9]。
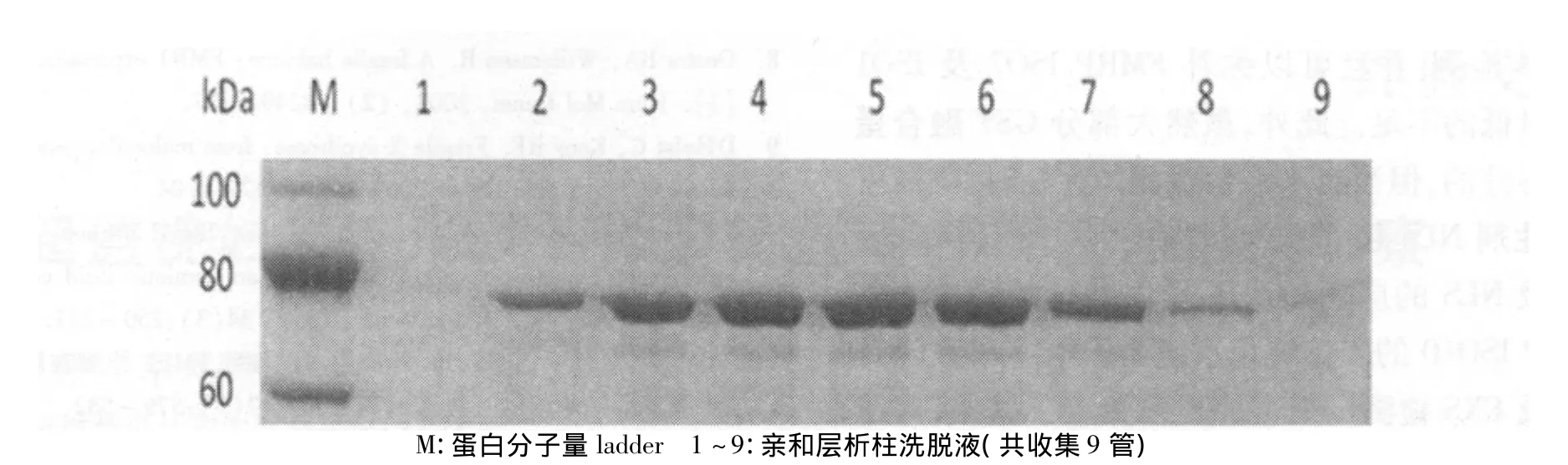
图4 SDS-PAGE电泳分析亲和纯化产物GST-FMRP ISO10
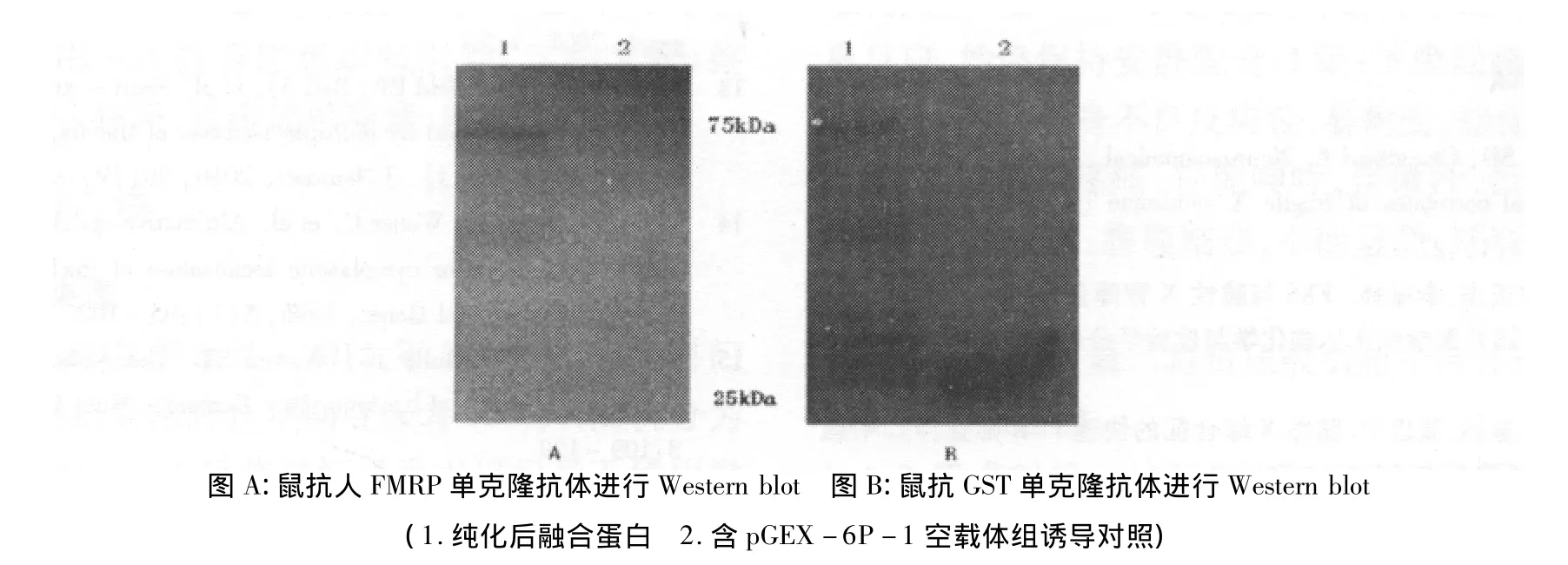
图5 Western blot分析蛋白纯化产物GST-FMRP ISO10
至今对于FXS已有多种筛查和诊断方法,以PCR技术、细胞遗传学方法和Southern blot方法应用最广,然而每种方法均存在各自的局限性,所以对FXS简易、快速诊断方法的研究仍是热点之一。FXS最终取决于FXS患者各种组织尤其是神经细胞的FMRP表达水平,FMRP的缺失与否可以作为FXS诊断的分子标记,Willemsen等[10]创立的FMRP免疫细胞化学方法—快速抗体检测法检测FMRP水平,比细胞遗传学方法和基因检测方法能更直接反映和解释FXS患者的临床表现[11]。应用抗体法检测FMRP的表达可以筛查出包括FMR1基因内(CGG)n重复序列的不稳定扩增,CpG岛的异常甲基化,以及编码区发生缺失或错义点突变等各种原因所致的FXS。所以开发针对FMRP检测高效、快速、高通量的FXS筛查方法迫在眉睫[12]。但目前国内进行FMRP快速抗体检测所采用的多为进口人FMRP单克隆抗体,还需配备免疫组化染色等相关试剂[4,11],无完整的试剂盒,不仅价格昂贵,而且由于配套试剂的不统一,可能会影响检测结果的可比性。我们的目标是制备出具有自主知识产权的、特异性高、亲合性强的人FMRP单克隆抗体,在此基础上,辅以全套抗体检测法所需试剂,开发成为FXS检测试剂盒,降低FXS检查成本,简化实验准备,方便使用。
FMR1基因因其复杂的选择性剪接而有多种剪接异构体,理论上人类FMRP剪接异构体至少可能有20种[13]。主要涉及外显子12和14,以及外显子15和17的多个选择性剪接位点[14]。目前,已有5种剪接异构体在不同组织内检测到[15]。FMR1 ISO7与FMR1 ISO1全序列相比,缺少外显子12(共63bp),全长1 836bp,针对FMRP ISO7的重组表达实验遇到蛋白表达量过低的问题,加入IPTG后宿主菌生长受抑制,OD600检测其菌体浓度低于非诱导对照组。此外,实验中通过改变IPTG诱导浓度(0.125、0.25、0.5、1、2、4 mM)及调整诱导表达温度(25℃及37℃)都不能增加FMRP ISO7的蛋白表达量,无法进行纯化;FMR1 ISO10缺少外显子12和14,全长1 640 bp,由于外显子14包含196bp,所以造成其后阅读框移码,出现翻译提前终止密码子。真核细胞中,无义突变介导的mRNA降解能够选择性地降解含有PTC的mRNA[16]。但本研究在大肠杆菌 BL21(DE3)pLysS中成功地将FMR1 ISO10在PTC之前序列部分进行重组表达和纯化。FMRP含有两种类型的RNA结合序列:两个KH结构域和一个RGG框[17]。FMRP ISO10含有两个KH结构域,所以制备的抗体可以应用于FXS检测,并且可以弥补FMRP ISO7及ISO1等表达量低的不足。此外,虽然大部分GST融合蛋白是可溶性的,但当有不溶性包涵体存在时,阴离子表面活性剂NLS可起到溶解作用[18],所以GST促溶标签及NLS的应用解决了蛋白纯化的困难。整套FMRP ISO10的表达纯化系统为FMRP单克隆抗体制备及FXS检测试剂盒的开发奠定了基础,对于FXS筛查,做出早期诊断,防止智力低下人口的出生,提高人口素质有着深远意义。
1 Koukoui SD,Chaudhuri A.Neuroanatomical,molecular genetic,and behavioral correlates of fragile X syndrome [J].Brain Res Rev,2007,53(1):27-38.
2 杨芳,白玉杰,李家林.FXS与脆性 X智障蛋白的相关性研究进展[J].国外医学临床生物化学与检验学分册,2005,26(5):299-301.
3 李东至,廖灿,黄以宁.脆性X综合征的快速PCR筛查[J].中国优生与遗传杂志,2005,13(2):31 -32.
4 罗序峰,钟建民,张晓珍,等.发根脆性X智力低下蛋白检测法诊断脆性 X综合征[J].中国当代儿科杂志,2009,11(10):817-820.
5 Tamanini F,Willemsen R,van Unen L,etal.Differentialexpression of FMR1,FXR1 and FXR2 proteins in human brain and testis[J].Hum Mol Genet,1997,6(8):1315 -1322.
6 Evans TL,Mihailescu MR.Recombinant bacterial expression and purification of human fragile X mental retardation protein isoform 1[J].Protein Expr Purif,2010,74(2):242 -247.
7 Eichler EE,Richards S,Gibbs RA,et al.Fine structure of the human FMR1 gene[J].Hum Mol Genet,1993,2(8):1147 -1153.
8 Oostra BA,Willemsen R.A fragile balance:FMR1 expression levels[J].Hum Mol Genet,2003,(2):R249 -257.
9 D'Hulst C,Kooy RF.Fragile X syndrome:from molecular genetics to therapy[J].JMed Genet,2009,46(9):577 -584.
10 Willemsen R,Los F,Mohkamsing S,et al.Rapid antibody test for prenatal diagnosis of fragile X syndrome on amniotic fluid cells:a new appraisal[J].JMed Genet,1997,34(3):250 -251.
11 钟建民,吴华平,陈勇,等.外周血淋巴细胞FMRP检测在脆性X综合征中的应用[J].江西医药,2007,42(7):579 -582.
12 Khaniani MS,Kalitsis P,Burgess T,etal.An improved Diagnostic PCR Assay for identification of Cryptic Heterozygosity for CGG Triplet Repeat Alleles in the Fragile X Gene(FMR1)[J].Mol Cytogenet,2008,1:5.
13 Banerjee P,Schoenfeld BP,Bell AJ,etal.Short- and long-term memory aremodulated by multiple isoforms of the fragile X mental retardation protein[J].JNeurosci,2010,30(19):6782 -6792.
14 Sittler A,Devys D,Weber C,etal.Alternative splicing of exon 14 determines nuclear or cytoplasmic localisation of fmr1 protein isoforms[J].Hum Mol Genet,1996,5(1):95 -102.
15 Penagarikano O,Mulle JG,Warren ST.The pathophysiology of fragile x syndrome[J].Annu Rev Genomics Hum Genet,2007,8:109-129.
16 Nicholson P,Mühlemann O.Cutting the nonsense:the degradation of PTC - containing mRNAs[J].Biochem Soc Trans,2010,38(6):1615-1620.
17 Shinahara K,Saijo T,Mori K,et al.Single-strand conformation polymorphism analysis of the FMR1 gene in autistic and mentally retarded children in Japan[J].JMed Invest,2004,51(1 -2):52-58.
18 Frangioni JV,Neel BG.Solubilization and purification of enzymatically active glutathione S - transferase(pGEX)fusion proteins[J].Anal Biochem,1993,210(1):179 -187.
[责任编辑:王丽娜]
