游泳池水氯化消毒对游泳训练效果影响的组织病理学与代谢组学研究
2012-03-06李江华王智慧朱小娟葛耀军
李江华,王智慧,朱小娟,葛耀军
1 前言
由于使用和投加方便,价格低廉,氯化消毒一直是游泳池水处理的主要方式。然而研究表明,传统的含氯消毒剂,如液氯、漂白粉(次氯酸钙)等,在杀死水中致病微生物的同时,又与水中的其他化学物质发生反应,生成了各种新的毒性物质,统称为氯化消毒副产物[17]。游泳池水质问题,近年来在西方发达国家已经引起了高度重视,目前,美国、澳大利亚等游泳强国已基本淘汰了旧的氯化消毒方式,被称为第四代杀菌消毒剂的二氧化氯已经成为游泳池水处理的主要方式,国际泳联(FINA)制定的游泳池水质卫生标准也已经对某些氯化消毒副产物的含量做出了明确的规定[16]。在国内,虽然毒性及危险性极大的液氯也已经逐步退出游泳池水处理市场,但是投放次氯酸钙仍然是游泳池水处理的主要方式。据报道,长期在传统氯化消毒游泳池水中游泳可能导致呼吸功能受损,患哮喘的几率显著提高[17]。至于传统的氯化消毒对游泳训练效果的影响,目前鲜见有相关的报道,我国与游泳强国游泳水平的差距是否与游泳池水质有关也不清楚。进行本项目的研究,一方面,可以了解传统氯化消毒对游泳训练效果的影响,为游泳项目训练提供科学依据;另一方面,利用组织病理学和基于核磁共振(NMR)的代谢组学方法进行分析,对这种影响产生的原因及其生理、生化机制进行研究,为发展相应的预防方法或措施提供理论支持。
2 研究对象与方法
2.1 研究对象
3周龄健康雄性SD大鼠12只,由南昌大学实验动物科学部提供,清洁级实验动物。平均体重207.1±43.9g,采用国家标准大鼠饲料分笼喂养(饲料由南昌大学实验动物科学部提供),自由饮食,室温20℃~24℃,自然光照。
2.2 分组与训练
12只SD大鼠随机分为对照组(C组)与实验组(E组),每组各6只,分别进行为期10周的渐增负荷游泳训练。实验组游泳池水按照普通游泳池水质标准投入次氯酸钙,使余氯量达到国家标准(0.3~0.5mg/L);对照组游泳池水为经过美的净水机过滤后的自来水,不添加任何消毒剂。每周训练5天,每天1次,每次训练持续时间以大鼠个体是否出现疲劳为准。负重量:正式训练第1周负重量为大鼠平均体重的2%,以后每2周在原有基础上增加1%,一直增加至大鼠平均体重的5%为止;疲劳标准:大鼠鼻尖2次沉于水中5s以上,判断为疲劳[7],出现疲劳的大鼠停止训练,并及时捞出。
2.3 游泳测试与取样
10周训练结束后,首先利用代谢笼收集尿样(24h),EP管密封,-80℃冰箱保存,以备一维核磁共振氢谱(1H NMR)测试与代谢组学分析。尿样收集完后,进行负重耐力游泳能力测试:测试时统一使用自来水为游泳用水,负重量约为平均体重的5%,入水开始计时,游至力竭停止计时,分别记录每只大鼠游泳至力竭的时间。力竭标准:大鼠水中旋转、运动协调性明显下降,水淹没鼻尖,身体下沉至水面超过10s[27]。负重耐力游泳能力测试完成后,大鼠休息2天(48h),断头处死,取肺脏进行组织病理切片。
2.41H NMR测试与组织病理切片
尿样于室温下解冻,每个尿液样品取400μl,加入200μl磷酸缓冲液(0.3M,pH7.4),10%重水(D2O,锁场),0.05%TSP(内标)。静置10min,再于4℃、13 000g离心10min,取上清入5mm核磁管进行1H NMR测量,磁场共振频率400.13MHz,谱宽16.02ppm,扫描次数32,温度30℃,预饱和方式压水峰,脉冲序列NOESYPR1D。
从肺的同一部位切一小块,4%的多聚甲醛缓冲固定液中固定12h,常规组织病理切片,HE染色,光学显微镜下观察。
2.51H NMR代谢组学分析
与传统生物学将生命现象与少数几个生物学指标进行相关研究的方法相反,代谢组学利用整体的分析方法对生命系统进行研究,通过测量样本中的所有的代谢产物来反映生物体对不同刺激的反应[3]。由于哺乳动物的代谢产物主要通过尿液排出,基于核磁共振(NMR)的代谢组学研究通常以尿液作为研究对象,利用1H NMR产生数据。氢原子在不同分子中的化学环境不同,在1H NMR中显示出不同的吸收峰,其中峰的数量就是氢的化学环境的数量,而峰的强度(也称为面积),就对应处于某种化学环境中的氢原子的数量。由于尿液1H NMR完整地反映了该实验对象的代谢表型与代谢特征,被称为“代谢指纹图谱”。简而言之,尿液1H NMR上不同的谱峰代表了尿液中不同的代谢物,谱峰的面积则反映了该代谢物的相对浓度;哺乳动物的代谢产物基本上都包含氢,而NMR是目前惟一既能定性又能在微摩尔范围对所有含氢代谢物同时进行定量分析的技术[13]。
2.5.1 谱图处理与产生数据
Jiangxi Normal University,Nanchang 330022,China.
利用软件MestReC4.9.9.6对所测得的1H NMR进行手动相位和基线校正,以TSP共振峰为参考调零。然后对10~0.04ppm进行分段积分,每段0.04ppm,为了消除核磁共振采集信号过程中压水峰所造成的影响,去除了水峰和尿素峰附近6.2~4.4ppm这一区段。结果从每张氢谱获得了204个相应的积分数据。在模式识别和进行数理统计与分析前,每段的积分数据相对于每张氢谱的总积分进行标准化处理[5]。
2.5.2 模式识别
哺乳动物尿液中的代谢物组成复杂,众多的小分子代谢物通常会在1H NMR产生成千上万的共振峰[19],要想解读如此复杂的信息,就必须借助以计算机信息技术为基础发展起来的模式识别技术[9]。偏最小二乘法(PLS)是一种集多元线性回归法和主成分分析(PCA)的基本功能于一体的、对高维度数据具有强大的处理能力的模式识别方法[4]。本研究采用SIMCA-P 10.0软件包(瑞典,Umetrics-AB,Umea)进行PLS模式识别和自变量因子重要性程度分析。
2.6 统计学分析
3 结果
3.1 耐力游泳测试成绩
实验组大鼠游泳至力竭的时间为28.97±2.55min,对照组游泳至力竭的时间为39.15±9.85min,使用氯化消毒水进行游泳训练的实验组明显低于对照组,结果具有显著性意义(P<0.05)。
3.2 组织病理学检测
大体解剖可见,大鼠肺的颜色和大小均正常,未见有明显渗出、增生、水肿、萎缩等病变。切片镜下观察显示,无论是实验组还是对照组,大部分大鼠肺泡壁出现了毛细血管扩张充血,肺泡腔可见有水肿液(图1),但是没有发现器质性病变迹象,实验组和对照组检测结果基本一致,没有明显差异。

图1 大鼠肺组织电镜图(HE×100)
3.3 代谢组学
3.3.1 模式识别结果
PLS模式识别结果如图2所示,在以第一主成分(t1)为横坐标,第二主成分(t2)为纵坐标的散点图上,实验组和对照组样本被明确地分开了,而同组的样本则各自聚集。这一结果表明,经过10周的渐增负荷游泳训练后,实验组大鼠代谢表型(1H NMR代谢指纹图谱)与对照组相比出现了明显的、有群体性特征的变化。

图2 偏最小二乘法(PLS)模式识别效果图(t1vs.t2)
3.3.21H NMR谱峰重要性分析与代谢标志物的发现
代谢组学通过代谢指纹图谱来对生命系统进行研究,1H NMR谱上成千上万的共振峰代表着不同的代谢物,但是这些代谢物在样本分类中的重要性并不相同,许多谱峰强度的组间差异很小,在分类中的作用甚至接近于零。如图2所示,PLS分析通过提取主成分t1和t2达到了降维的目的,使得实验组和对照组样本在二维图上出现了明显的类聚现象,但是哪些代谢物在样本分类中起主要作用?或者说主要是哪些代谢物的共振峰使得实验组和对照组的样本出现了图2中的类聚现象?PLS分析在实现降维的同时,还能对自变量因子的重要性进行分析,即1H NMR谱上某一化学位移区段上谱峰的重要性程度可以用变量投影重要性指标(variable importance in projection,VIP)来量化[4],据此可以发现组间差异大、在样本分类中的重要性也高的谱峰及其所代表的代谢物。本研究中,VIP值较高的前3个、能较大程度反映实验组大鼠与对照组大鼠代谢表型差异的1H NMR谱区段依次为1.92~1.88ppm(VIP:2.62)、2.40~2.36ppm(VIP:2.45)4.00~3.96ppm(VIP:2.29)。谱峰归属结果如图3所示,可见10周氯化消毒游泳池水游泳训练所引起的代谢表型变化的主要代谢标志物为:γ-氨基丁酸、丙酮酸和马尿酸。

图3 一维核磁共振氢谱(1H NMR)重要区段代表性的代谢标志物图
3.3.3 实验组与对照组代谢标志物相对含量的比较
VIP值较高的前3个1H NMR谱区段相对积分值比较结果如图4所示,实验组大鼠的4.00~3.96ppm区段明显高于对照组,而在1.92~1.88ppm和2.40~2.36ppm这2个区段的相对积分值则明显低对照组,差异均具有非常显著性意义。由于每段1H NMR谱相对积分值在一定程度上反映该区段主要物质的相对浓度,结合图3谱峰归属的结果可以得出:实验大鼠尿液中马尿酸的相对含量较高,而γ-氨基丁酸、丙酮酸的相对含量则较低。
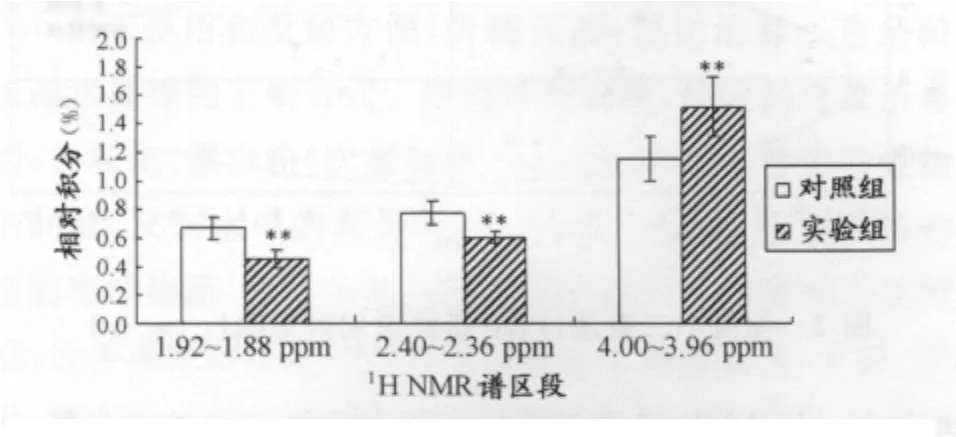
图4 重要的3个1H NMR谱区段相对积分值比较示意图
4 讨论
4.1 游泳池水氯化消毒的副作用的组织病理学分析
流行病学调查显示,游泳池水氯化消毒对人体健康的危害主要体现在肺功能受损和引起哮喘。有研究显示,经常在氯化消毒游泳池中游泳,会导致肺上皮细胞渗透性增加[20],有引起哮喘和其他呼吸性疾病的危险[24]。Thickett等人[28]通过对救生员和游泳教练的研究发现,空气中的三氯化氮(一种氯化消毒副产物,Ncl3)浓度达到100~570mg/m3就可能引起职业性的哮喘。当然,除哮喘以外,游泳池水氯化消毒副产物可能还与多种身体不适反应有关[21]:研究显示,Ncl3可能对救生员与游泳者的眼睛和上呼吸道具有强烈的刺激作用,Nystad等人[25]发现,游泳池游泳可引起幼儿呼吸道和耳朵感染反复发作;王春[11]曾对北京的部分游泳人群进行过问卷调查,调查结果显示,43.3%的人在游泳后感觉到皮肤干燥、发痒、眼睛干涩充血和眼睛疼痛。
本研究组织病理学检测结果显示,经过10周(约两个半月)的游泳训练后,实验组和对照组大鼠的肺未见有器质性病变,只是大部分大鼠肺泡壁出现了毛细血管扩张充血,肺泡腔可见有水肿液,但是这种现象在实验组与对照组均存在,两组之间没有明显的差异。可见,按国家标准对游泳池水进行氯化消毒并不会引起肺出现器质性病变,肺泡壁毛细血管充血和肺泡腔内的水肿液可能是因为大鼠在游泳训练中,尤其是游泳能力测试过程中(要求游至力竭)呛水过多所引起,休息一段时间应该就能自行康复。当然,本实验只进行了10周,游泳池水氯化消毒更长期的影响还有待于进一步实验验证。
4.2 氯化消毒游泳池水对训练效果影响的代谢组学分析
代谢组学(metabonomics)是新近发展起来的一种系统生物学研究方法,它研究的是生物体代谢产物的综合组成以及机体在内外刺激条件下的代谢反应[26]。目前,代谢组学的研究正处于高速发展的阶段,其应用已经波及到基础生命科学、药物研发、疾病生理等诸多方面,尤其是在环境毒理学研究领域,由于代谢组学具有整体性强(信息量大)、灵敏性高、时效性好等优点,许多传统生物学方法难以观察到的毒理学现象或毒理学变化都可以借助于这一技术平台进行观察与研究[3]。
4.2.1 氯化消毒游泳池水与大鼠代谢表型特征图谱
代谢组学利用反映整体的代谢物图谱直接认识生物体的生理和生化状态[6],模式识别的结果(图2)证明,经过10周游泳训练后,实验组大鼠1H NMR代谢指纹图谱与对照组相比出现了明显的、有群体性特征的变化。这意味着实验组大鼠的代谢表型发生了特征性的变化,并且这种变化可能与大鼠的游泳训练效果有关。
4.2.2 相关代谢标志物与耐力游泳能力
经过对1H NMR谱上众多的共振峰进行重要性分析和谱峰归属(图3),本研究发现,10周氯化消毒游泳池水游泳训练所引起的代谢表型变化的主要代谢标志物为γ-氨基丁酸、丙酮酸和马尿酸,并且实验组大鼠尿液中马尿酸的相对含量较高,而γ-氨基丁酸、丙酮酸的相对含量则较低。尿液1H NMR谱上反映的代谢物种类成千上万,但是具有显著性差异的代谢物却非常少,如果没有系统生物学的整体分析技术,发现这些代谢标志物几乎是不可能的。
研究表明,马尿酸(Hippurate)在肝脏中的线粒体合成,它的合成依赖于线粒体氧化磷酸化提供三磷酸腺苷(ATP)的能力[18],因此,尿液中马尿酸的含量反映了肝细胞的机能状态[2,12]。临床上,马尿酸检验是肝功能测试指标之一,它的主要作用是测知肝脏的解毒能力[10],在职业医学中和环境毒理研究中也常常测定尿液中的马尿酸来反映环境污染的程度[14]。本研究中,实验组大鼠尿液中马尿酸相对含量较高,这反映了它们的肝脏代谢活动较强。从这一现象,结合组织病理学检测结果分析,10周氯化消毒水游泳训练没有引起大鼠肝功能的损害,反而在氯化消毒副产物的刺激下,肝脏机能表现较为亢进。肝脏是人体最重要的代谢器官:我们的心脏能够有力和有规律地跳动;我们吃的食物能够完全被消化和吸收;我们的大小脑,能够保持正常的功能,我们的肌肉能够保持结实和富有弹性—这一切都依靠着肝脏,肝脏解毒机能长期处于亢奋状态可能也会影响到游泳训练的效果。
尿液中γ-氨基丁酸和丙酮酸的相关研究目前还不多,它们与运动能力或者训练效果关系的直接研究更未见有报道出现,但是相关文献早已证明了尿液中γ-氨基丁酸和丙酮酸的存在[8,22,23]。γ-氨基丁酸是一种抑制性神经递质,它的上升是引起运动性疲劳的重要因素之一[15];丙酮酸则位于无氧氧化供能和有氧氧化供能的交界点上,是生物体基本代谢极为重要的中间产物,它在无氧条件下产生乳酸,以糖酵解的形式供能,在有氧条件下,通过三羧酸循环完全氧化供能,同时,丙酮酸还可通过乙酰CoA和三羧酸循环实现体内糖、脂肪和氨基酸间的互相转化[1]。因此,实验组大鼠尿液γ-氨基丁酸、丙酮酸的相对含量较低可能意味着它们的能量产生机制和清除γ-氨基丁酸的能力受到了损害,从而导致它们游泳训练效果下降和测试成绩较差。
5 结论
按标准剂量对游泳池水投放含氯消毒剂进行氯化消毒没有引起受训大鼠的肺出现器质性病变,但是对耐力游泳训练效果有一定的不良影响,氯化消毒副产物诱发的肝脏解毒功能亢奋和机体代谢表型的变化可能是这一影响产生的主要原因。
[1]崔黎黎,宫德正,李晓,等.丙酮酸钙对小鼠力竭运动后抗氧化损伤作用的机制[J].中国康复,2009,24(3):147-148.
[2]郭永征.经ALSS治疗的乙肝肝衰竭患者的尿液代谢组学研究[D].浙江大学硕士学位论文,2011.
[3]李江华,范叶飞,刘文锋.基于核磁共振(NMR)的代谢组学方法应用于运动人体科学研究的魅力与障碍[J].中国运动医学杂志,2010,29(5):611-614.
[4]李江华,范叶飞,刘文锋.偏最小二乘法在体育科研中的应用与实践[J].中国体育科技,2010,46(6):138-141.
[5]李江华,刘承宜,沙海燕,等.高水平男子中短距离游泳成绩预测代谢组学模型[J].体育学刊,2010,17(4):103-106.
[6]刘昌孝.代谢组学与医药科学研究[J].中国医学科学院学报,2009,29(6):712-718.
[7]刘刚,张缨,冯美云,等.1,6一二磷酸果糖对疲劳性游泳大鼠自由基和血尿酸、血肌酐代谢的影响[J].北京体育大学学报,1998,21(2):8-10.
[8]麻春玲,谢雯.高危人群护好你的肝[J].生活与健康,2010,(7):6-9.
[9]邱玉洁,夏圣安,叶朝辉,等.生物医学核磁共振中的模式识别方法[J].波谱学杂志,2005,22(1):99-112.
[10]屈忠廉.马尿酸测试的临床意义及其准备[J].护理杂志,1956,(1):24-25.
[11]王春.对北京市部分游泳场(馆)池水余氯含量的调查报告[J].化学教育,2004,(9):32-34.
[12]王伟明,黄育华,熊振芳,等.肝气郁结证大鼠尿液代谢组学研究[J].中西医结合肝病杂志,2010,20(2):102-105.
[13]吴惠丰.基于NMR的稀土生物效应代谢组学研究[D].中国科学院长春应用化学研究所博士学位论文,2005.
[14]杨军,郑法雷.马尿酸与尿毒症[J].国外医学泌尿系统分册,1989,9(4):145-147.
[15]张蓉,李峰,王莹莹,等.运动性疲劳大鼠谷氨酸、γ-氨基丁酸受体含量变化及中药的调节作用[J].中国中医药信息杂志,2010,17(7):43-45.
[16]郑大华,傅文华.国家游泳中心池水水质问题分析[J].给水排水,2008,34(4):71-79.
[17]朱小娟,李江华,仇银燕.游泳池水消毒副产物的研究与控制[J].给水排水,2010,36(7):162-167.
[18]AOYAMA H,KAMIYAMA Y,UKIKUSA M,et al.Clinieal significance of hippurate-synthesizing capacity in surgical patients with liver disease:a metabolic tolerance test[J].J Lab Clin Med,1986,108(5):456-460.
[19]BECKONERT O,KEUN H C,EBBELS TMD,et al.Metabolic profiling,metabolomic and metabonomic procedures for NMR spectroscopy of urine,plasma,serum and tissue extracts[J].Nat Protocols,2007,2(11):2692-2703.
[20]BEMARD A,CARBONNELLE S,MICHEL O,et al.Lung hyperpermeability and asthma prevalence in schoolchildren:unexpected associations with the attendance at indoor chlorinated swimming pools[J].Occup Environ Med,2003,60:385-394.
[21]BERNARD A,CARBONNELLE S,NICKMILDER M,et al.Non-invasive biomarkers of pulmonary damage and inflammation:Application to children exposed to ozone and trichloramine[J].Toxicol Appl Pharmacol,2005,206:185-190.
[22]EWASCHUK J B,NAYLOR J M,BARABASH W A,et al.High-performance liquid chromatographic assay of lactic,pyruvic and acetic acids and lactic acid stereoisomers in calf feces,rumen fluid and urine[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,805(2):347-351.
[23]KOBAYASHI Y.gamma-Aminobutyric acid in plasma,urine and CSF[J].Nihon Rinsho,1999,57(Suppl):561-563.
[24]LEVESQUE B,DUCHESNE J F,GINGRAS S,et al.The determinants of prevalence of health complaints among young competitive swimmers[J].Int Arch Occup Environ Health,2006,80:32-39.
[25]NYSTAD W,NJA F,MAGNUS P,NAFSTAD P.Baby swimming increases the risk of recurrent respiratory tract infections and otitis media[J].Acta Paediatr,2003,92:905-909.
[26]TANG H R,WANG Y L.Metabonomics:a revolution in progress[J].Prog Biochem Biophys,2006,33(5):401-417.
[27]THOMAS D P,MARSHALL K I.Effects of repeated exhaustive exercise on myocardial subcellular membrane structures[J].Int J Sports Med,1988,9(4):257-260.
[28]THICKETT K M,MCCOACH J S,GERBER J M,et al.Occupational asthma caused by chloramines in indoor swimming pools[J].Eur Resp J,2002,19:827-832.
