葡萄根瘤蚜Taq Man-MGB实时荧光定量检测方法的研究
2012-02-28王忠跃孔繁芳武艳霞
郭 庆, 王忠跃, 孔繁芳, 武艳霞
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
葡萄根瘤蚜[Daktulosphaira vitif oliae (Fitch)],属于同翅目(Homoptera),根瘤蚜科(Phylloxeridae),是葡萄上的毁灭性害虫。葡萄根瘤蚜为专食性,只为害葡萄属(Vitis spp.)植物,是我国植物检疫性有害生物[1]。该种原产于北美洲落基山脉东部[2-3],目前在加拿大、阿根廷、智利、秘鲁、墨西哥、哥伦比亚、巴西、法国、奥地利、阿尔巴尼亚、比利时、保加利亚、匈牙利、阿尔及利亚、南非、突尼斯、摩洛哥、巴基斯坦、叙利亚、土耳其、黎巴嫩、塞浦路斯、以色列、日本及朝鲜等国均有分布[4-8]。2005年6月在上海市嘉定区马陆镇李家村发现了葡萄根瘤蚜,以后陆续在湖南怀化、陕西西安、辽宁葫芦岛等地发现该虫[9-11]。葡萄根瘤蚜的再次发现,引起了农业部的高度重视,并设专项资金进行普查和防控技术研究。由于此虫体形小,主要在根部寄生,对葡萄的为害往往需要较长时间才开始显现症状,因此不像其他害虫容易被发现[12]。目前检测葡萄根瘤蚜主要方法有DNA检测、根系调查和捕虫器调查[13],而DNA检测大幅度地提高了检测的灵敏度。
实时荧光定量PCR技术由美国Applied Biosystems公司于1996年推出,该技术不仅实现了对DNA模板的定量,而且具有灵敏度高、特异性和可靠性更强、能实现多重反应、自动化程度高,具实时性和准确性等特点。虽然实时荧光定量PCR在害虫检测中的应用刚刚起步,但已经显示出了极好的应用前景。Karen Her bert等报道利用葡萄根瘤蚜的ITS2建立了特异性引物,建立定性检测葡萄根瘤蚜的实时荧光定量PCR技术[14],但并未构建标准质粒、标准曲线和完整的实时荧光定量PCR的绝对定量检测体系,本研究采取Taq Man-MGB探针方法,通过构建标准阳性质粒及标准曲线,对实时荧光定量PCR反应条件进行优化,建立完整的实时荧光定量PCR定量检测体系,对葡萄根瘤蚜及土壤中的若虫进行定量检测,旨在为葡萄根瘤蚜的检测和种群动态监测提供方法。
1 材料与方法
1.1 试验材料
1.1.1 供试害虫
葡萄根瘤蚜采自湖南怀化、西安灞桥、上海马陆3个葡萄根瘤蚜疫区。
1.1.2 试剂及仪器
Premix Taq Man探针反应液,购自上海基康生物技术有限公司;E.coli感受态细胞,p MD18-T载体,购自Ta Ka Ra公司;Powersoil土壤DNA分离试剂盒(12888),购自 MOBIO公司;Eppendorf 5415 R离心机,水浴锅,漩涡震荡仪,ABI7500荧光定量仪,Ultrospec 2100 pro紫外分光光度仪,BIO-RAD C1000TMPCR仪等。
1.2 试验方法
1.2.1 引物的验证
利用Karen Her bert等根据葡萄根瘤蚜ITS2中的保守序列设计的探针和引物序列,并由上海基康生物技术有限公司合成。引物序列和探针序列见表1。
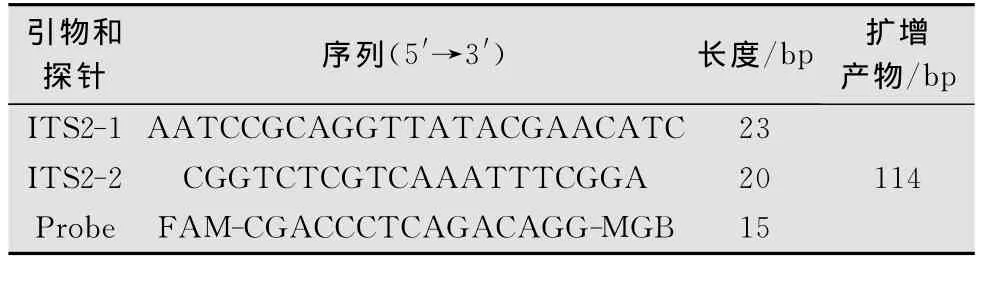
表1 引物和探针序列
参照安瑞生等的方法[15]提取上海马陆、西安灞桥和湖南怀化3个地点葡萄根瘤蚜的基因组DNA,以TE溶解,-20℃储存,用作PCR的模板。PCR反应体系为25μL:灭菌双蒸水8.75μL、DNA模板3μL,反应缓冲液1.5μL,d NTP混合物1μL、上游引物0.3μL,下游引物0.3μL、Ex-Taq DNA 聚合酶0.15μL,混匀后进行PCR扩增,扩增条件参照Bul man等[16]。同时设立无模板的阴性对照。反应结束后,用3%的琼脂糖凝胶电泳检测PCR特异性扩增产物。
1.2.2 标准阳性质粒的制备
1.2.2.1 ITS2目标基因PCR扩增
葡萄根瘤蚜提取方法及PCR体系同1.2.1,反应结束后,用3%的琼脂糖凝胶电泳检测PCR特异性扩增产物。
1.2.2.2 ITS2目标基因的克隆与鉴定
参照胶回收试剂盒的操作说明,回收PCR特异性扩增产物,将回收的PCR特异性扩增产物与p MD18-T载体连接,构建重组质粒,并转化E.coli感受态细胞,用质粒提取试剂盒提取重组质粒DNA,对重组质粒DNA进行PCR鉴定,将阳性重组质粒送北京三博远志生物技术公司测序。
1.2.3 标准阳性质粒浓度、拷贝数计算及稀释
利用紫外分光光度仪分别测定阳性质粒在260 nm和280 n m处的吸光度,只有A260/A280比值在1.7~1.9之间的质粒可以用于构建标准曲线。并计算出重组质粒的DNA纯度、浓度和拷贝数。
1.2.3.1 标准阳性质粒浓度计算
将A260/A280比值在1.7~1.9之间的质粒,进行质粒浓度测定及拷贝数换算,根据公式:
质粒浓度(ng/μL)=A260×50μg/mL×稀释终体积(mL)×1000/稀释时加入的原始溶液体积(μL)
1.2.3.2 标准阳性质粒拷贝数计算
计算出质粒的浓度,再根据公式:
质粒拷贝数(拷贝/μL)=质粒浓度(ng/μL)×6.02×1014/660×碱基数(载体+插入片段)
计算出质粒的拷贝数。
将重组质粒DNA进行10倍梯度稀释制备不同拷贝数的标准阳性质粒模板,用于荧光定量PCR反应条件的优化和标准曲线的建立。
1.2.4 荧光定量PCR反应条件的优化
1.2.4.1 反应体系及优化标准
反应体系为10μL:Pre Mix 5μL,正向引物0.45μL,反向引物0.45μL,Taq Man-MGB 0.25μL,模板2μL,实时荧光定量PCR反应条件:预变性95℃15 min,变性95℃15 s,延伸60℃1 min,40个循环,对荧光定量PCR反应条件的优化,以获得较低的阈值(C t)和较高的荧光强度增加值(R n)。
1.2.4.2 引物浓度的优化
对荧光定量PCR体系中的引物浓度进行优化,分别做50、300、600、900 n m、1、10、20、30μm 引物浓度的优化组合,优化浓度时,探针浓度为20μm。
1.2.4.3 探针浓度优化
上述确定最佳引物浓度后,固定引物浓度,探针浓度设置为600、900 n m、1、10、20、30μm。
1.2.4.4 退火温度
退火温度选择在55~60℃范围内以1℃作为梯度进行优化。
1.2.5 重复性和敏感性试验
1.2.5.1 重复性试验
以质粒DNA为模板进行系列梯度稀释,取3个浓度梯度进行荧光定量PCR检测,各浓度重复测定3次,分析梯度内的C t值标准差和变异系数,评价方法的精密度。
1.2.5.2 敏感性试验
将制备的阳性标准质粒DNA进行10倍倍比稀释,作为PCR模板,进行荧光定量PCR检测,检验建立方法的敏感性。
1.2.6 标准曲线的绘制
将上述制备标准阳性质粒10倍倍比稀释后的标准品,实时荧光定量PCR扩增后,绘制标准曲线。
1.2.7 含有葡萄根瘤蚜的土壤DNA检测
在0.25 g不含葡萄根瘤蚜的烘干土壤中加入10头葡萄根瘤蚜若虫,加入葡萄根瘤蚜若虫的0.25 g非疫区土壤为阳性对照,0.25 g不含葡萄根瘤蚜的烘干土壤为阴性对照,参照Powersoil土壤DNA分离试剂盒操作说明,提取土壤DNA,并梯度稀释,进行荧光定量PCR检测。
1.2.8 田间土壤样品检测
取西安受葡萄根瘤蚜为害的深10 c m处的葡萄根际土壤,非疫区土壤为阴性对照,参照Powersoil土壤DNA分离试剂盒操作说明,提取土壤总DNA。以提取的土壤总DNA为模板进行实时荧光定量PCR检测。
1.3 结果分析方法
实时荧光定量PCR利用ABI 7500型荧光定量PCR仪自带软件SDS进行结果分析,根据阴性对照结果设定阈值线,扩增曲线及样品C t值由软件自动生成。
2 结果与分析
2.1 引物的验证
以上海、湖南、西安3个地点采集的葡萄根瘤蚜提取的基因组DNA为模板,分别采用普通PCR和实时荧光定量PCR扩增目标片段ITS2基因,将PCR特异性扩增产物进行琼脂糖凝胶电泳检测,扩增片段约为114 bp(图1),实时定量PCR结果显示为阳性,证明引物和探针适合我国的葡萄根瘤蚜。
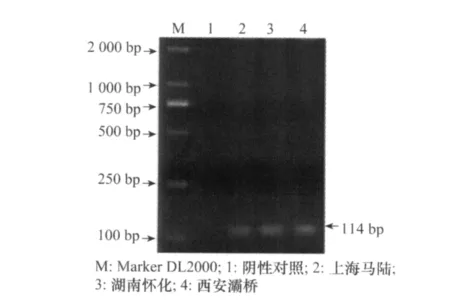
图1 PCR产物电泳图
2.2 ITS2目标基因PCR扩增、克隆及鉴定结果
以葡萄根瘤蚜提取的全基因组DNA为模板,扩增目标片段ITS2基因,将PCR特异性扩增产物进行琼脂糖凝胶电泳,扩增片段约为114 bp,与预期的大小相一致,见图2。
回收的PCR产物连接到p MD18-T质粒载体中,PCR鉴定为阳性的重组质粒进行序列测定,测序结果经在Gen Bank数据库上对比,与已发表的葡萄根瘤蚜的ITS2基因序列完全一致,结果表明重组质粒中含有葡萄根瘤蚜ITS2基因片段。
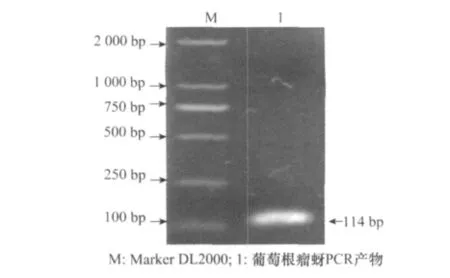
图2 PCR产物电泳图
2.3 荧光定量PCR反应条件的优化
2.3.1 标准阳性模板浓度、拷贝数计算及稀释
质粒经100倍稀释后,在260 n m和280 n m波长下A值的比值结果为A260/A280=1.86,表明提取质粒纯度较好,适合于荧光标准曲线的建立。
根据公式计算得到阳性质粒浓度为50 ng/μL,阳性质粒的拷贝数为1.625×1010拷贝/μL。
将重组质粒DNA进行10倍梯度稀释,分别制备1.625×1010、1.625×109、1.625×108、1.625×107、1.625×106、1.625×105、1.625×104、1.625×103、1.625×102、1.625×101拷贝/μL和1.625拷贝/μL的标准阳性质粒模板,用于荧光定量PCR反应条件的优化,敏感性试验和标准曲线的建立。
2.3.2 引物浓度的优化
试验结果表明,最优引物浓度为10μm,见图3。
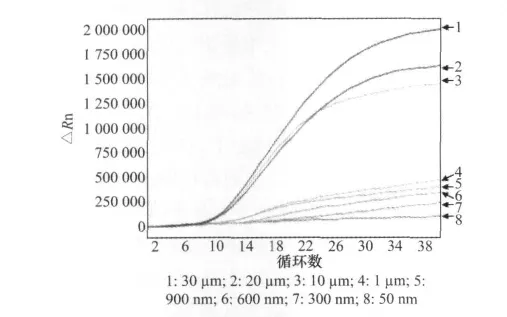
图3 实时荧光定量PCR引物浓度优化
2.3.3 探针浓度的优化
试验结果表明,最优探针浓度为10μm,见图4。
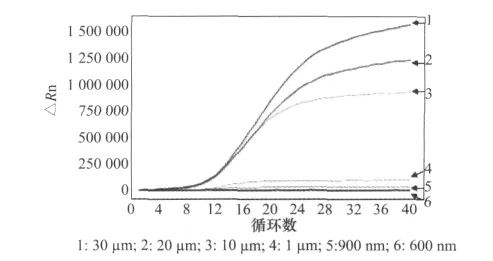
图4 实时荧光定量PCR探针浓度优化
2.3.4 退火温度的优化
退火温度选择在55~60℃范围内以1℃作为梯度进行优化的平均C t分别为15.2、14.72、14.89、14.82、14.98和13.97,所以本试验选择60℃为最佳退火温度。
2.4 重复性和敏感性试验
2.4.1 重复性试验
3次重复性测定1.625×105、1.625×103、1.625×101拷贝/μL高、中、低3个浓度的质粒DNA模板。得到各浓度梯度的C t值,并计算得各浓度的标准差及C t值变异系数见表3。可见C t值的变异系数都小于5%,在误差允许范围内。说明建立的荧光定量PCR检测方法对高、中、低不同浓度检测结果重复性较好。
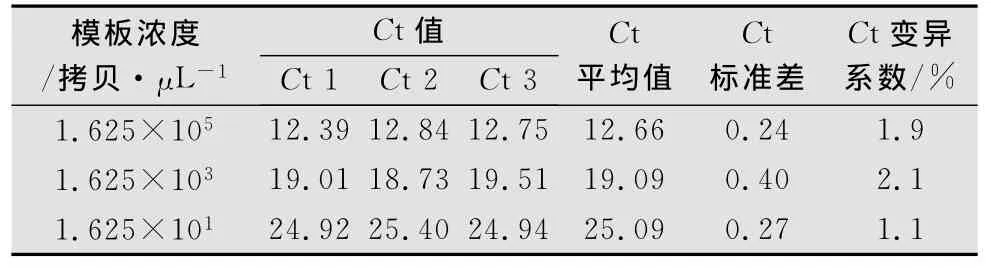
表2 实时荧光定量PCR重复性试验
2.4.2 敏感性试验
取1.625×103、1.625×102、1.625×101、1.625、1.625×10-1拷贝/μL和1.625×10-2拷贝/μL浓度梯度的标准模板进行实时荧光定量PCR扩增,扩增曲线当标准模板 DNA 浓度在1.625×103~1.625拷贝/μL范围内时,扩增曲线的线形较好,很快达到平台期,1.625×10-1拷贝/μL和1.625×10-2拷贝/μL扩增曲线与阴性对照相似所以判断为阴性,此时的模板浓度已超出了检测体系的检测线性范围,见图5。因此,该方法稳定的最低检测灵敏度为1.625拷贝/μL。
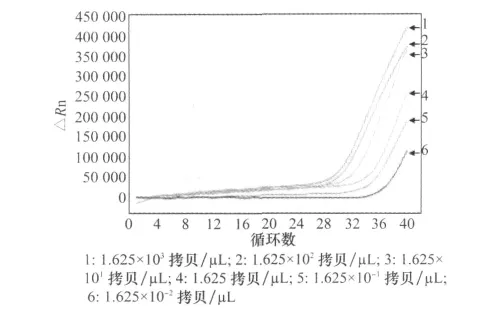
图5 实时荧光定量PCR灵敏度试验
2.5 标准曲线的绘制
按上述优化的反应条件,取1.625×104、1.625×105、1.625×106、1.625×107、1.625×108拷贝/μL的阳性质粒DNA作为模板,分别加入到PCR反应体系中进行扩增,系统自动分析软件显示C t值与标准阳性模板浓度的对数之间存在良好的线性关系,标准曲线的斜率为-3.436,相关系数(R2)为0.99,扩增效率为95.462%(图6)。试验结果说明,根据C t值和标准曲线即可对样品进行准确定量。
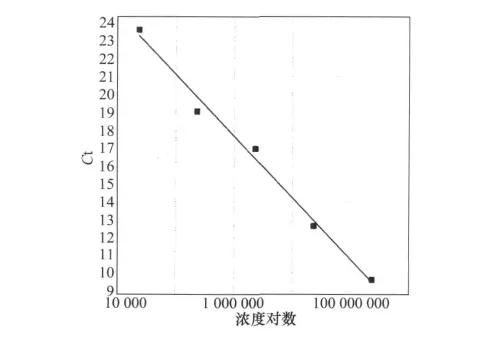
图6 实时荧光定量PCR标准曲线
2.6 含有葡萄根瘤蚜的土壤DNA检测
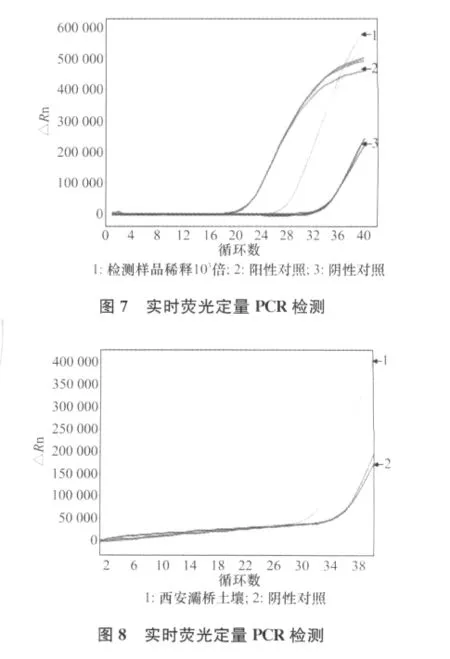
将提取的土壤DNA进行实时荧光定量PCR,所提取的DNA稀释103倍后,仍能检测出阳性结果。结果表明,采取荧光定量PCR的方法能够检测到土壤中葡萄根瘤蚜的存在,可以利用标准曲线对土壤中的葡萄根瘤蚜进行定性定量分析,见图7。
2.7 田间土壤样品检测
试验结果表明,利用上述引物可以在受葡萄根瘤蚜为害的葡萄根际土壤中检测到葡萄根瘤蚜的存在,证明了实时荧光定量PCR检测土壤中葡萄根瘤蚜的可行性,见图8。
3 结论与讨论
经过实时荧光定量PCR反应条件的优化,初步应用Taq Man-MGB探针实时荧光定量PCR技术对含有葡萄根瘤蚜DNA的模板进行检测,呈现良好的S型扩增曲线,能够进行定量检测,其灵敏度可达1.625拷贝/μL。本试验验证了实时荧光定量PCR用于检测土壤中葡萄根瘤蚜的可行性,还进一步检测了含有10头葡萄根瘤蚜若虫的土壤所提取的总DNA,并对所提DNA梯度稀释,进行实时荧光定量PCR检测,结果表明将所提取的DNA稀释103倍,仍能检测出阳性结果。在上述研究基础之上,利用实时荧光定量PCR对受葡萄根瘤蚜为害的葡萄根际土壤进行了初步定性检测,验证了实时荧光定量PCR检测土壤中葡萄根瘤蚜的可行性。利用该方法可以通过对土壤中葡萄根瘤蚜若虫量进行检测,从而达到对葡萄根瘤蚜种群动态监测的目的,该方法避免了挖根调查对葡萄的伤害,也大幅降低了调查所需投入的人力物力,提高了准确度,给葡萄根瘤蚜疫情的检测及监测提供了较好的方法。但是,若想使田间所采集的土壤样品能够检测到葡萄根瘤蚜并准确反映其种群动态变化,还需要对田间土壤采样方法、土壤总DNA提取方法以及荧光定量PCR检测结果与葡萄根瘤蚜种群量的对应关系进行深入研究。
[1] 中华人民共和国农业部第862号公告.中华人民共和国进境植物检疫性有害生物名录[EB].(2007-06-04).
[2] Davidson W M,Nougaret R L.The grape phylloxera in Califor nia[M].Washington:United States Depart mentof Agriculture,1921:1-128.
[3] Grannet J,Wal ker M A,Kocsis L,et al.Biology and managementof grape phylloxera[J].Annu Rev Ento mol,2001,46:387-412.
[4] 中国农业科学院植物保护研究所.中国农作物病虫害(第二版、下册)[M].北京:中国农业出版社,1996:933-935.
[5] CABI,EPPO.欧洲检疫性有害生物[M].中国-欧洲联盟农业技术中心译.北京:中国农业出版社,1997:250-255.
[6] 全国农业技术推广服务中心.植物检疫性有害生物图鉴[M].北京:中国农业出版社,2001:166-168.
[7] 杨长举,张宏宇.植物害虫检疫学[M].北京:科学出版社,2005:289-292.
[8] 田家怡,刘俊展,刘庆年,等.山东外来入侵有害生物与综合防治技术[M].北京:科学出版社,2004:240-242.
[9] 叶军,郑建中,唐国良.上海地区发现葡萄根瘤蚜危害[J].植物检疫,2006(2):98.
[10]张尚武,刘勇,朱璇.我省首次发现葡萄根瘤蚜[N].湖南日报,2006-06-01.
[11]Sun Qinghua,Chen Yingchun,Wang Haibo,et a1.Origin and genetic diversity of grape phylloxera in China[J].Acta Entomologica Sinica,2009,52(8):885-894.
[12]曹骥,林松,朱希孟.葡萄根瘤蚜发生规律初步研究[J].昆虫学报,1962,11(1):59-70.
[13]Fossen M,Granett J.An emergence trapping I met hod for detecting grape phylloxera(Daktulosphair a vitif oliae)populations in California vineyards[J].Southwestern Entomologist Scientific Note,2007,32(1):65-66.
[14]Herbert K,Powell K,Mckay A,et a1.Developing and testing a diagnostic probe for grape phylloxera applicable to soil samples[J].Economic Entomology,2008,101(6):1934-1943.
[15]安瑞生,谭声江,陈晓峰.小型昆虫DNA提取时匀浆方法的改进[J].昆虫知识,2002,39(4):311-312.
[16]Bul man S R,Stufkens M A W,Eastop V F,et al.Rhopalosiphum aphids in New Zealand.II.DNA sequences reveal t wo incompletely described species[J].N Z J Zool,2005,32:37-45.
