结直肠癌患者外周血Th1和Th2细胞的检测与临床意义*
2012-02-24黄家豪曹云飞高枫
黄家豪 曹云飞 高枫
(广西医科大学第一附属医院结直肠肛门外科 广西南宁 530021)
结直肠癌(Colorectal cancer,CRC)是临床上常 见的消化系统肿瘤,每年在全世界范围内的新增病例约为945,000例,死亡人数达492,000人/年,同时也是我国常见的恶性肿瘤之一,严重威胁着人们的身心健康[1]。结直肠癌强调以手术为主的综合治疗,但总体治疗效果不尽人意[1]。近年来,越来越多的研究围绕结直肠癌患者的免疫状态及其机制展开,而免疫学的研究成果将为肿瘤生物治疗提供新的思路与途径。
肿瘤的进展包括宿主的细胞免疫与肿瘤通过多种分子机制互相作用的过程。研究表明,包含多种免疫细胞类型的宿主细胞免疫体系以复杂的方式与肿瘤细胞进行作用,进而发挥最重要的肿瘤防御机制[3,4]。尽管结直肠肿瘤组织及癌旁组织内有大量免疫细胞浸润,但免疫低应答或无应答时常发生在结直肠癌患者身上[5~8]。
本研究通过流式细胞技术观察结直肠癌患者与健康人外周血CD4+T辅助细胞(helper T cell,Th细胞)亚群Th1细胞和Th2细胞比例的变化;采用实时荧光定量逆转录-聚合酶链反应(quantitative Real-time RT-PCR)的方法,从 mRNA 水平检测转录因子T-bet/GATA-3表达量的变化;并利用液相芯片技术检测结直肠癌患者和健康人群血浆中IFN-γ、TNF-α、IL-1β、IL-4、IL-6、IL-13和IL-15的表达水平,以期发现结直肠癌进展过程中免疫功能的变化,有利于完善结直肠癌发生发展的肿瘤免疫机制,并为肿瘤疫苗提供潜在的治疗靶点。
1 材料与方法
1.1 研究对象 选取广西医科大学第一附属医院结直肠外科2011年3月至2011年10月初次行手术治疗的43例结直肠癌患者(肠癌组)。所有样本均符合人体实验伦理学标准,征得外周血标本提供者知情同意并签署知情同意书,年龄40~86岁,中位年龄58.20岁。男24例,女19例,男女比例为1.26∶1。Dukes分期:A期13例,B期10例,C期14例,D期6例。根据肠癌患者有无淋巴结转移分为淋巴结转移阴性结直肠癌患者(Dukes A期+Dukes B期)与淋巴结转移阳性结直肠癌患者(Dukes C期+Dukes D期)。组织学分型:腺癌41例,黏液腺癌2例。所切除标本均经病理学诊断证实。患者外周血抽取前未服用非甾体类抗炎药(NSAID),并未经任何化学治疗或放射治疗。收集同时期体检健康者30例(对照组),年龄53.24±12.46岁,男女比例为1.5∶1。受检者均无免疫系统性疾病。
1.2 标本采集 肠癌组入院后次日清晨6时取肘静脉血6m L,肝素钠抗凝,对照组于体检时取血1次(6m L)。肠癌组和对照组抽取的6m L肘静脉血中,2m L用于流式细胞检测,4m L用于实时荧光定量逆转录PCR与血浆细胞因子浓度测定。
1.3 主要试剂 总RNA提取试剂盒为中国天根公司产品;逆转录试剂盒为美国Fermentas公司产品;实时荧光定量聚合酶链反应SYBR Green荧光Mix为瑞士Roche公司产品;分离单个核细胞所需密度梯度分离液为瑞典Pharmacia公司产品;血浆细胞因子检测使用美国Bio-Rad公司的Bio-Plex系统以及相应的细胞因子检测试剂盒;流式细胞检测样本准备所需溶血素、破膜剂、细胞表面抗体CD3/CD8、细胞内抗体IFN-γ/IL-4为美国 BD 公司产间;佛波酯(Phorbol myristate acetate,PMA)、离子霉素(Ionomycin)和蛋白质转运抑制剂(Golgistop,内含莫能霉素)为美国Sigma公司产品。
1.4 流式细胞技术检测外周血中Th1/Th2细胞的比例 取两支10m L试管,分别为实验测定管和阴性对照管。每管加入肝素抗凝全血400μL和RPMI-1640培养基363μL。加入刺激剂PMA 20μL(1μg/m L),离子霉素(Ionomycin)16μL(50μg/m L)和蛋白质转运抑制剂1μL。混匀后置于37℃5%CO2培养箱孵育5h。从培养箱内取出后做小幅度振荡混匀,加入2μL APC标记的抗人CD3单抗和2μL PerCP标记的抗人CD8,室温避光孵育15min。加2m L 1X溶血素裂解红细胞,室温下避光孵育10min,2100rpm离心5min弃上清,用磷酸盐缓冲液(Phosphate buffered saline,PBS)洗涤1次。加入1m L 1X破膜剂进行细胞打孔利于细胞因子单抗进入细胞,离心弃上清后用200μL RPMI-1640培养基重悬细胞,继而进行胞内细胞因子染色。测定管中加入2μL FITC标记的IFN-γ和PE标记的IL-4联合抗体,对照管加入相应的荧光标记同型对照抗体,室温避光孵育30min,PBS洗涤1次后使用300μL 1%多聚甲醛固定后上机检测。应用美国BD公司FACS-Calibur流式细胞仪进行数据获取和分析,根据前向散射光和侧向散射光为淋巴细胞群设门,对CD3+CD8-细胞分泌的Th1型细胞因子IFN-γ和Th2型细胞因子IL-4进行检测。
1.5 实时荧光定量逆转录-聚合酶链反应检测转录因子 T-bet/GATA-3表达量的变化
1.5.1 标本处理 取15m L离心管,将5m L Ficoll-Hypaque液置离心管低层,将4m L肝素抗凝的外周血缓慢加至上层,注意不要破坏两者形成的层面,以2500rpm X 20min作密度梯度离心。离心后上层为血浆,分装后置-80℃冰箱保存待用。在血浆与Ficoll-Hypaque液之间的界面上收获的细胞悬液,即为外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)。用PBS液洗1次(2100rpm离心5min),加入381μL RPMI-1640完全培养基重悬细胞,加入PMA 10μL(1μg/m L),离子霉素8μL(50μg/ml)和蛋白质转运抑制剂1μL,置于37℃5%CO2培养箱孵育5h,收集细胞,按照总RNA提取试剂盒说明书提取总RNA。
荧光定量PCR检测引物均由大连Ta KaRa公司合成,引物序列及目的基因扩增范围见表1。
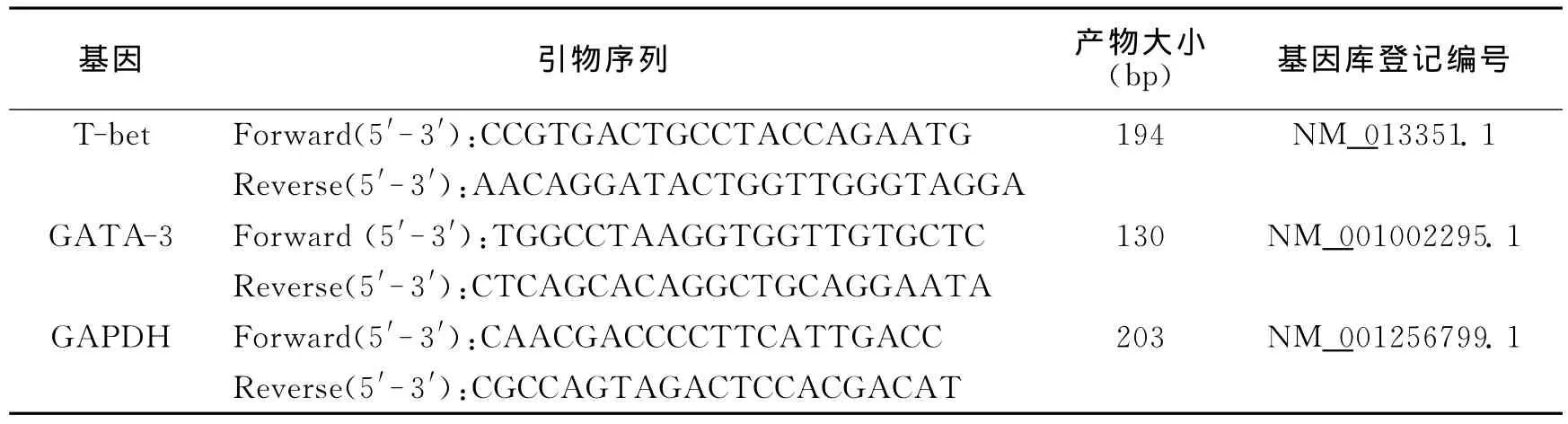
表1 Real-time RT-PCR 引物序列
1.5.2 逆转录反应 取12μL RNA模板做逆转录反应,反应体系及加样顺序如下(在冰上混合下列成分),RNA模板12μL,特异性下游引物0.5μL,5X逆转录Buffer 4μL,RNA酶抑制剂0.5μL,d NTP 1μL,逆转录酶1μL,总20μL体系。反应条件:42℃60min,然后70℃5min。
1.5.3 荧光定量PCR反应
(1)目的基因标准品及其浓度梯度的构建(标准曲线定量法):①目的基因标准品的制备。以所合成的cDNA为模板进行扩增。PCR扩增体系:cDNA模板1μL,上游引物0.5μL,下游引物0.5μL,去离子水(dd H20)8μL,Roche荧光 Mix 10μL。对PCR扩增的产物经过1.5%低熔点琼脂糖凝胶电泳(使用Gold ViewⅠ进行染色,用TAE缓冲液配制凝胶),在长波紫外光下,切下目的条带。用胶回收试剂盒(普通琼脂糖凝胶DNA回收试剂盒,中国天根)回收纯化。测定OD值>1.8,表明纯度合格。用Nano Drop 2000测定标准品浓度(ng/μL),即为阳性标准品。②阳性标准品梯度的制备:取阳性标准品1μL,按10倍稀释(加灭菌双蒸水9μL,并充分混匀),依次准确稀释,制备成阳性定量标准品梯度(不少于5个浓度梯度)。
(2)应用 Applied Biosystems Step OneTMPlus荧光定量PCR仪,采用相对定量法检测目的基因m RNA的表达水平,SYBR Green法检测荧光,以GAPDH作为管家基因。待测样本和阳性标准品按以下反应体系进行。模板1μL,上游引物0.5μL,下游引物0.5μL,去离子水(dd H20)8μL,Roche荧光Mix 10μL,总体积20μL。反应条件95℃预变性10min,然后95℃变性15s,60℃退火60s,共40个循环。溶解曲线部分:95℃15s,60℃60s,95℃15s。
(3)数据分析。若目的基因与内参基因满足扩增效率均接近100%,且相对偏差不超过5%,根据基因相对表达倍数=2-ΔΔCt,得到结果是通过经内参基因表达水平校准的实验组样本中目标基因相对于对照组样本的增加或减少的倍数。其中:ΔΔCT=ΔCt(肠癌组)-ΔCt(对照组),ΔCt=Ct(目的基因)-Ct(内参基因,GAPDH)。Ct值是PCR扩增产物产生可检测的荧光信号时所经历的循环数。
1.6 液相芯片技术定量检测人血浆细胞因子
1.6.1 标准品的制备 使用Bio-Plex标准品稀释液配制8个浓度的标准品以及空白对照。
1.6.2 血浆样品的制备 使用Bio-Plex样品稀释液对待测血浆进行1∶4稀释。
1.6.3 分析操作方法 使用分析缓冲液配制1X稀释微球混合物(避光)。滤板上各孔加入100μL分析缓冲液预湿,真空抽滤去除液体,每孔加入50μL稀释微球混合物,用洗板机洗板2次后加入50μL标准品、待测血浆标本,室温避光振荡孵育30min。真空抽滤,每孔用100μL洗涤液洗去微球上未结合的物质,随后每孔加入25μL生物素标记抗体,以形成抗体三明治复合体。室温避光振荡孵育30min。同前抽滤并洗涤3次,除去过量的检测抗体后,每孔加入25μL藻红蛋白标记的链酶亲和素(SA-PE)溶液,室温避光振荡孵育10min。再次抽滤并洗涤3次后,每孔加入125μL洗涤液重悬微球,在Bio-Plex系统上检测出SA-PE发出的荧光量以及待测样品浓度。
1.7 统计学方法 应用SPSS 13.0软件进行统计分析。计量资料以EM表示,组间比较采用t检验或秩和检验,变量之间的相关分析使用Spearman等级相关进行研究,检验水准α=0.05。
2 结 果
2.1 Th2细胞在结直肠癌患者外周血中比例增加
由于CD4在不同的细胞亚型之间可出现交叉表达(既表达在Th细胞上,也表达在单核细胞上),因此单独用CD4设门无法将Th1和Th2细胞区分开。采用CD3和CD8设门则可解决这一问题,因CD8不受PMA刺激的影响,且绝大多数的CD3+CD8-细胞都是CD3+CD4+的细胞。本研究中我们利用流式细胞技术,通过对CD3+CD8-细胞群中IFN-γ和IL-4的阳性表达率来分析Th1/Th2细胞的表达水平。肠癌组与对照组外周血Th1和Th2细胞比例如表2所示。肠癌组外周血中Th1细胞(CD3+CD8-IFN-γ+)占 CD4+T 细胞比例与对照组比较差异无统计学意义(P>0.05;图1);Th2细胞(CD3+CD8-IL-4+)占 CD4+T细胞比例显著高于对照组(P<0.05;图2)。Th1细胞比例与结直肠癌临床病理参数的关系:淋巴结转移阴性结直肠癌患者(Dukes A期+Dukes B期)外周血Th1比例与淋巴结转移阳性的结直肠癌患者(Dukes C期+Dukes D期)间无明显差异(P>0.05)。淋巴结转移阴性/阳性的结直肠癌患者外周血Th2细胞比例均显著高于健康对照组(P均<0.05),但淋巴结转移阴性/阳性的结直肠癌患者之间外周血Th2细胞的比例无显著差异(P>0.05)。
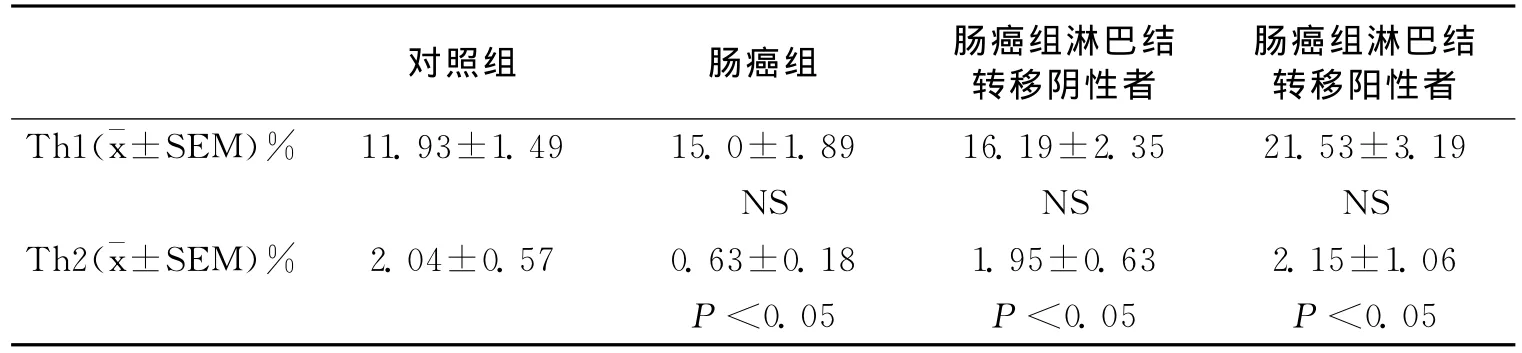
表2 肠癌组与对照组Th1细胞和Th2细胞占CD4+T细胞比例
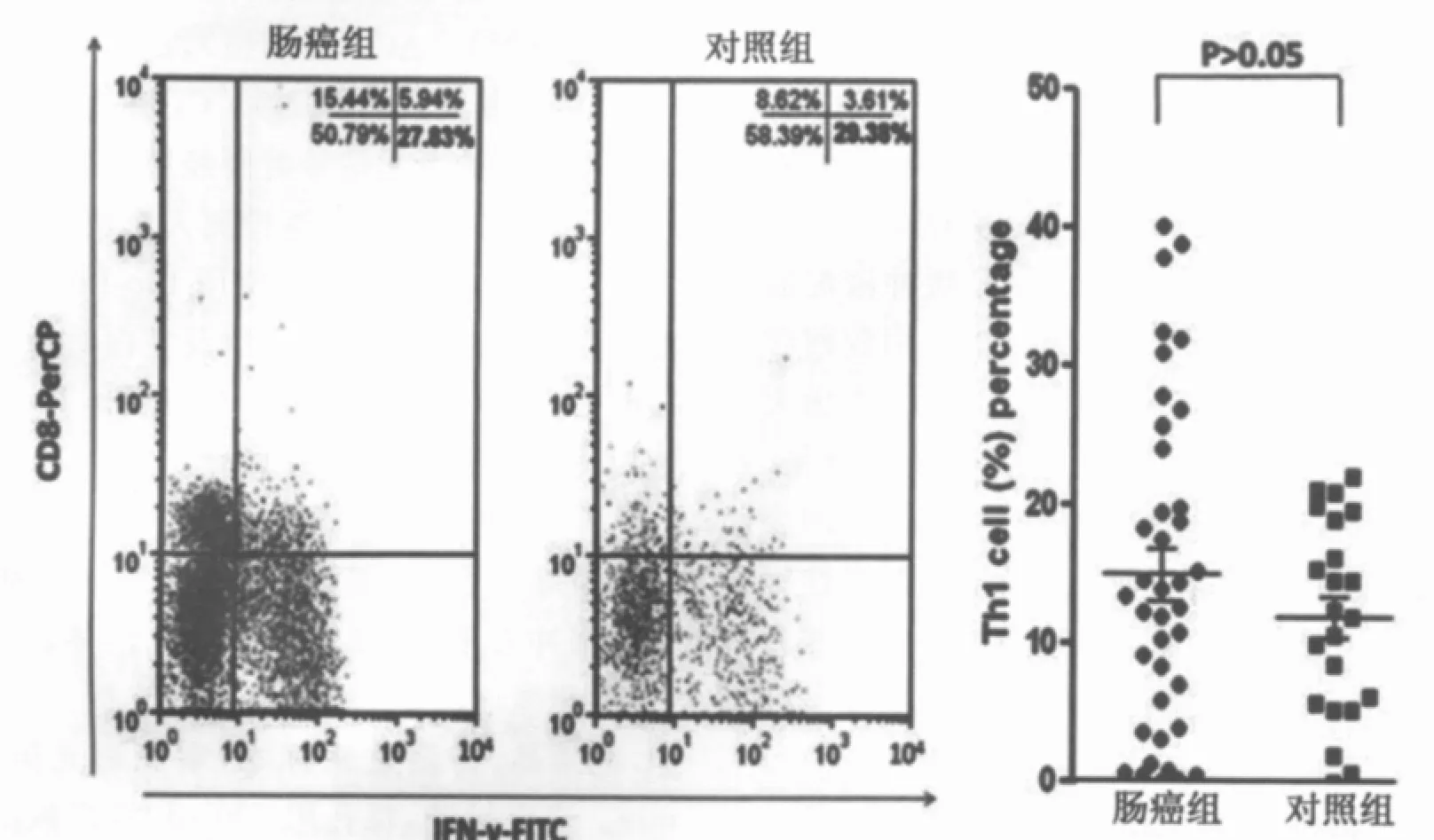
图1 肠癌组与对照组外周血Th1细胞(CD3+CD8+IFN-γ+)比例
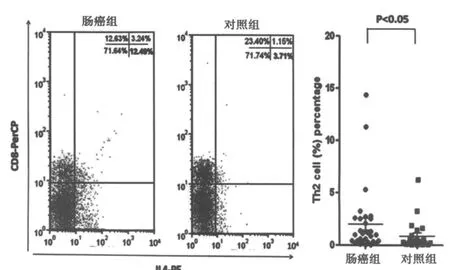
图2 肠癌组与对照组外周血Th2细胞(CD3+CD8+IL-4+)比例
Th1细胞和Th2细胞相关性如图3所示:在结直肠癌患者外周血中Th1细胞与Th2细胞具有明显正相关性(r=0.686,P<0.01,图3),而在正常人两者的相关性则不明显(r=0.311,P>0.05)。
2.2 结直肠癌患者外周血 T-bet/GATA-3mRNA的相对基因表达量 GAPDH、T-bet和 GATA-3的扩增曲线:实时荧光定量PCR扩增结果显示,GAPDH、T-bet和GATA-3的熔解曲线未见杂峰,表明扩增特异性较好(图4a、5a、6a);标准曲线的斜率、截距、相关系数、扩增效率均能满足使用公式“相对值=2-△△CT”计算实验组相对于对照组中目的基因的相对表达倍数(图4b、5b、6b)。
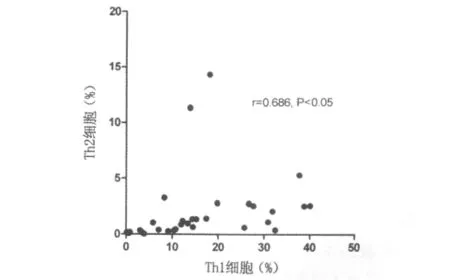
图3 Th1细胞与Th2细胞相关性分析
图4 GAPDH标准品荧光PCR扩增效果
肠癌组和对照组外周血T-bet和GATA-3的mRNA表达:相对于对照组,肠癌组外周血的T-bet mRNA表达水平显著降低(P <0.05,图7),而肠癌组外周血 GATA-3的mRNA表达则显著高于对照组(P<0.05,图7)。淋巴结转移阳性与阴性结直肠癌患者的T-bet的m RNA表达量均显著低于对照组(P<0.05,图8/图9),而Th2细胞特异性转录因子GATA-3的mRNA表达量在淋巴结转移阳性与阴性的结直肠癌患者的表达情况则相反:在淋巴结转移阴性结直肠癌患者中表达量较对照组显著降低(P<0.05,图8),而在淋巴结转移阳性患者中表达量较对照组显著升高(P<0.05,图9)。淋巴结转移阳性/阴性结直肠癌患者之间T-bet和GATA-3的表达量差异无统计学意义(P>0.05)。
2.3 结直肠癌患者血浆Th1/Th2相关细胞因子的变化肠癌组和对照组血浆细胞因子表达水平见表3。肠癌组与对照组血浆细胞因子 TNF-α、IL-1β、IL-13和IL-15表达水平差异无统计学意义(P>0.05)。结直肠癌患者血浆细胞因子的表达水平与肿瘤进展相关:淋巴结转移阴性结直肠癌患者血浆IFN-γ浓度显著高于淋巴结转移阳性的结直肠癌患者(P<0.05)。淋巴结转移阳性的结直肠癌患者较对照组IL-4降低,差异有统计学意义。结直肠癌患者随着Dukes分期的升高,IL-6有逐渐降低的趋势:淋巴结转移阴性的结直肠癌患者较淋巴结转移阳性患者的血浆IL-6表达水平显著升高(P<0.05)。肠癌组和对照组血浆细胞因子浓度见表2。
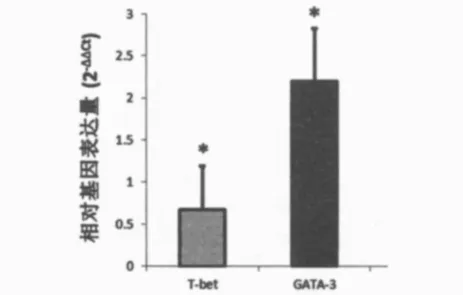
图7 肠癌组与对照组T-bet和GATA-3的相对基因表达量
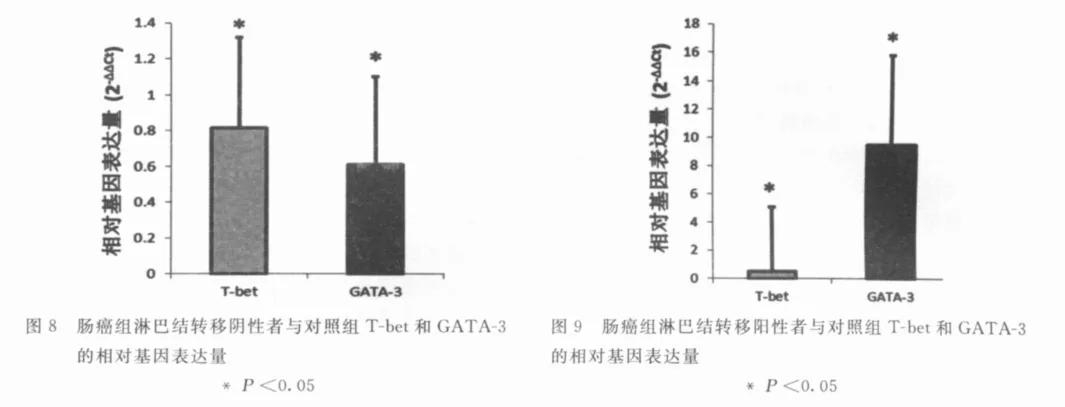
表3 血浆细胞因子浓度[(EM),pg/ml]细胞因子
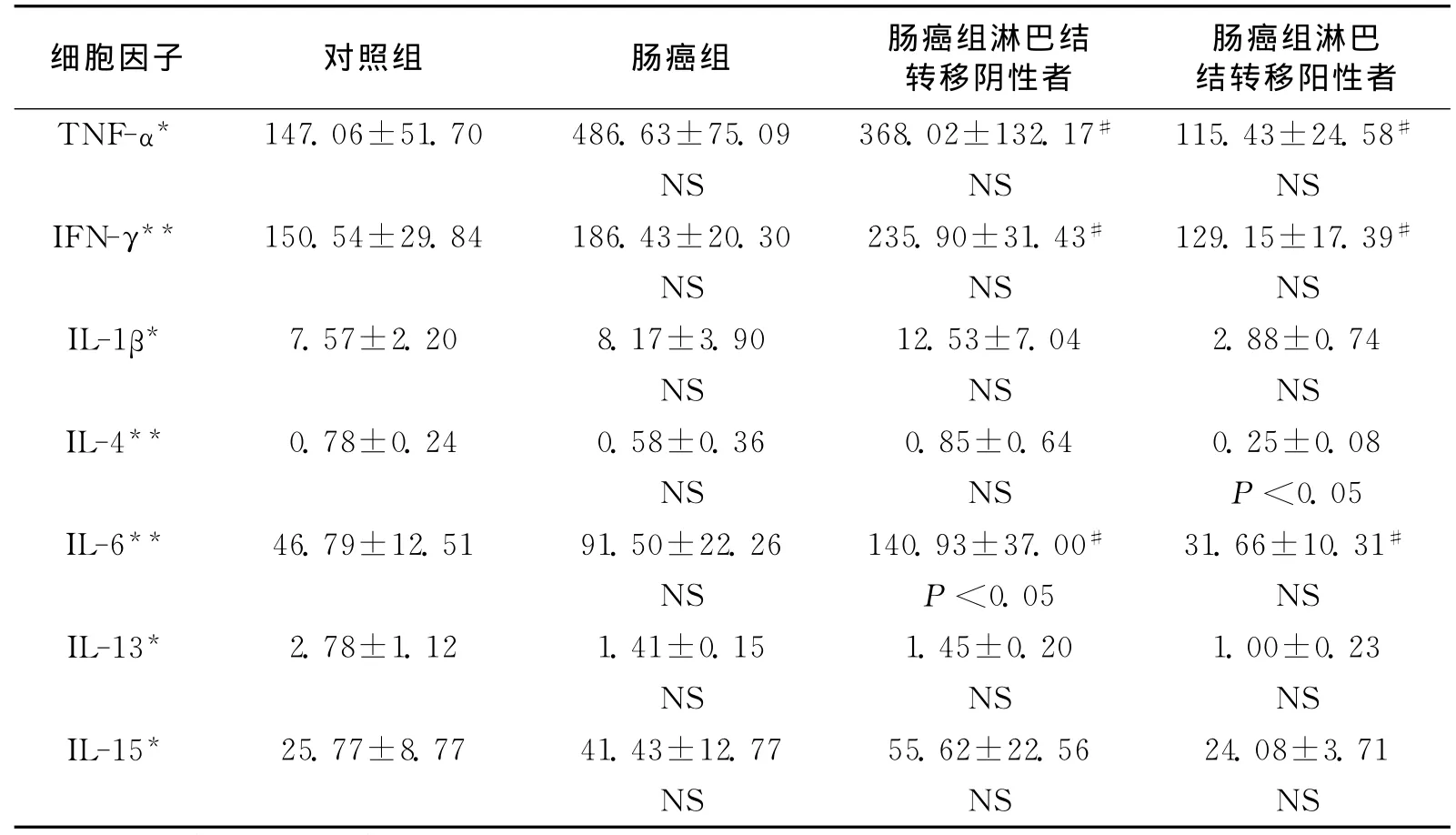
表3 血浆细胞因子浓度[(EM),pg/ml]细胞因子
注:肠癌组以及肠癌组淋巴结转移阴性者/阳性者分别与对照组进行统计学比较。根据数据的分布类型使用t检验或U检验。*t检验;**U检验;#肠癌组淋巴结转移阴性者/阳性者存在显著差异
细胞因子 对照组 肠癌组 肠癌组淋巴结转移阴性者肠癌组淋巴结转移阳性者TNF-α* 147.06±51.70 486.63±75.09368.02±132.17# 115.43±24.58#NS NS NS IFN-γ** 150.54±29.84 186.43±20.30 235.90±31.43# 129.15±17.39#NS NS NS IL-1β* 7.57±2.20 8.17±3.90 12.53±7.04 2.88±0.74NS NS NS IL-4** 0.78±0.24 0.58±0.36 0.85±0.64 0.25±0.08NS NS P<0.05IL-6** 46.79±12.51 91.50±22.26 140.93±37.00# 31.66±10.31#NS P <0.05 NS IL-13* 2.78±1.12 1.41±0.15 1.45±0.20 1.00±0.23NS NS NS IL-15* 25.77±8.77 41.43±12.77 55.62±22.56 24.08±3.71NS NS NS
3 讨 论
T细胞介导的细胞免疫在机体的抗肿瘤效应中起重要作用,其中CD4+T细胞、CD8+T细胞及γδT细胞是主要参与抗瘤效应的T细胞亚群。具有抗原特异的CD4+T辅助细胞对机体的特异性免疫/非特异性免疫,以及细胞免疫/体液免疫均有重要的调节作用,既能促进其他T细胞的分化成熟,也能协助B细胞产生抗体,是机体内一类重要的免疫调节细胞。另外,Th细胞也是评估机体免疫状态和免疫能力的重要指标,对评估肿瘤的预后、复发、治疗效果等方面有重要作用。
为进一步研究Th细胞亚群在结直肠癌发生发展中的变化及其相关机制,本实验使用流式细胞技术对43名结直肠癌患者和30名健康人外周血CD4+T细胞亚群Th1细胞和Th2细胞的分布进行检测,运用实时荧光定量PCR对Th1和Th2细胞特异性转录因子(T-bet和GATA-3)m RNA的相对表达量进行分析,利用液相芯片技术对Th1/Th2细胞亚群分泌的细胞因子进行定量检测,得到了重要发现。①结直肠癌患者外周血Th2细胞占CD4+T细胞的比例与健康人相比显著升高,而Th1细胞占CD4+T细胞的比例在结直肠癌患者与健康人中无显著性差异。②Th1和Th2细胞特异性转录因子的m RNA表达量在结直肠癌患者与健康人之间差异显著。结果显示,与健康人相比T-bet m RNA的表达量在结直肠癌患者外周血中显著降低,GATA-3的mRNA表达量则在肠癌组中显著升高。③尽管肠癌组与对照组血浆各细胞因子的浓度差异不总存在统计学差异,但各细胞因子的浓度与对应的特异性细胞因子mRNA的表达趋势相类似。液相芯片的检测结果证实Th1细胞相关的细胞因子表达水平在两组间的表达水平相当。结直肠癌患者外周血Th2细胞相关的细胞因子表达水平与疾病的进展程度密切相关。
Th1和Th2细胞都是由初始T细胞诱导分化而来,而Th1与Th2的比例与生理情况和临床状态有关[9~11]。Tabata及其研究团队报道肿瘤患者体内出现Th1/Th2细胞漂移,从而导致Th2细胞占主导的免疫状态[12]。本研究的结果显示,Th2细胞占CD4+T细胞的比例在肠癌组外周血中与对照组相比显著升高,而Th1细胞占CD4+T细胞的比例在两组之间无明显差异。因此Th1和Th2细胞的比例可作为体内免疫状态转换的一个指标,也在一定程度上与Tabata的报道情况相一致。Th1相关T-bet mRNA的表达水平在肠癌组外周血显著低于对照组,但是没有流式细胞计数和血清学的结果支持:Th1细胞比例和其相关的细胞因子IFN-γ与TNF-α在外周血的表达水平差异无统计学意义。我们运用流式细胞技术对Th2细胞进行细胞表面抗体与胞内抗体的标记,结果发现Th2细胞占CD4+T细胞比例在外周血的增高。实时荧光定量PCR检测到与Th2转录相关的GATA-3mRNA表达量升高也证实了流式细胞的结果。Th1细胞特异性转录因子T-bet m RNA在结直肠癌组表达量较对照组显著降低,而同时Th2细胞转录因子GATA-3的m RNA表达量较对照组显著升高,则提示Th1/Th2细胞平衡在转录因子水平上被打破,朝Th2细胞偏移。GATA-3m RNA的高表达一方面通过上调Th2类细胞因子而促进Th0细胞向Th2细胞方向分化,另一方面则可能通过抑制IL-12和IFN-γ的信号转导来抑制Thl细胞发育,使Th1/Th2比例极化,向Th2细胞偏移,抗肿瘤免疫应答受到限制,机体无法彻底清除肿瘤细胞,最终发生肿瘤进展。因此我们认为结直肠癌患者处于激活状态的Th2相关细胞通路可能与免疫逃逸的发生相关。
细胞因子是由免疫细胞与非免疫细胞共同分泌的调节性蛋白。促炎性的细胞因子环境可以影响包括结直肠癌在内的多种恶性肿瘤的发生发展[13,14]。本研究中,我们运用液相芯片技术定量检测结直肠癌患者与健康对照组血浆中Th1/Th2细胞因子的表达水平。结果 显示,肠癌组与对照组血浆Th1相关细胞因子IFN-γ和TNF-α的差异无统计学意义,与Pellegrini等人报道的结直肠癌患者与对照组外周血IFN-γ和TNF-α表达水平无显著差异的结果相一致[13]。IFN-γ通过促进细胞毒性T淋巴细胞的活性,而在启动细胞免疫和抑制肿瘤等方面起着至关重要的作用。实验结果发现,淋巴结转移阳性结直肠癌患者血浆IFN-γ浓度与淋巴结转移阴性结直肠癌患者相比显著降低,这从侧面反映了机体抗肿瘤免疫功能的缺陷程度随着肿瘤进展逐渐加重。血浆Th2相关细胞因子IL-4和IL-6与肿瘤分期密切相关:IL-4在淋巴结转移阳性结直肠癌患者与正常对照组相比显著降低,这与Shibata检测结直肠癌患者外周血IL-4所得出的结果未达到一致[15]。病情进展与IL-6的表达水平密切相关:淋巴结转移阴性肠癌患者血浆IL-6浓度显著高于淋巴结转移阳性肠癌患者。因此,根据血浆细胞因子在疾病不同阶段浓度存在差异性,可将细胞因子的浓度作为提示疾病状态的生物学指标。本实验结果显示,血浆IL-1β、IL-13和IL-15浓度在肠癌组与对照组的差异无显著性差异。
结直肠癌患者外周血中Th1细胞比例变化不明显而Th2细胞比例升高。结直肠癌患者血浆细胞因子的不平衡表达可作为机体免疫状态转换与病情判断的指标。
[1] Weitz J,Koch M,Debus J et al.Colorectal cancer[J].Lancet,2005,365(9454):153-165.
[2] Tsavaris N,Kosmas C,Skopelitis H,et al.Sequential administration of 5-fluorouracil (5FU )/leucovorin(LV)followed by irinotecan(CPT-11)at relapse versus CPT-11followed by 5-FU/LV in advanced colorectal carcinoma.A phase III randomized study[J].Chemotherapy,2007,53(4):282-291.
[3] Whiteside TL.The role of immune cells in the tumor microenvironment[J].Cancer Treat Res,2006,130:103-124.
[4] Schottelius AJ,Dinter H.Cytokines,NF-kappaB,microenvironment,intestinal inflammation and cancer[J].Cancer Treat Res,2006,130:67-87.
[5] O'Hara RJ,Greenman J,MacDonald AW,et al.Advanced colorectal cancer is associated with impaired interleukin 12and enhanced interleukin 10production[J].Clin Cancer Res,1998,4(8):1943-1948.
[6] O'Hara RJ,Greenman J,Drew PJ,et al.Impaired interleukin-12production is associated with a defective antitumor response in colorectal cancer[J].Dis Colon Rectum,1998,41(4):460-463.
[7] Evans C,Dalgleish AG,Kumar D.Review article:immune suppression and colorectal cancer[J].Aliment Pharmacol Ther,2006,24(8):1163-1177.
[8] Dunn GP,Old LJ,Schreiber RD.The immunobiology of cancer immunosurveillance and immunoediting[J].Immunity,2004,21(2):137-148.
[9] Abehsira-Amar O,Gibert M,Joliy M,et al.IL-4plays a dominant role in the differential development of Tho into Th1and Th2cells[J].J Immunol,1992,148(12):3820-3829.
[10]Reiner SL,Wang ZE,Hatam F,et al.TH1and TH2cell antigen receptors in experimental leishmaniasis[J].Science,1993,259(5100):1457-1460.
[11]Rocken M,Saurat JH,Hauser C.A common precursor for CD4+T cells producing IL-2or IL-4[J].J Immu-nol,1992,148(4):1031-1036.
[12]Tabata T,Hazama S,Yoshino S,Oka M.Th2subset dominance among peripheral blood T lymphocytes in patients with digestive cancers[J].Am J Surg,1999,177(3):203-208.
[13]Pellegrini P,Berghella AM,Del Beato T,et al.Disregulation in TH1and TH2subsets of CD4+T cells in peripheral blood of colorectal cancer patients and involvement in cancer establishment and progression[J].Cancer Immunol Immunother,1996,42(1):1-8.
[14]Contasta I,Berghella AM,Pellegrini P,et al.Passage from normal mucosa to adenoma and colon cancer:alteration of normal sCD30mechanisms regulating TH1/TH2cell functions[J].Cancer Biother Radiopharm,2003,18(4):549-557.
[15]Shibata M,Nezu T,Kanou H,et al.Decreased production of interleukin-12and type 2immune responses are marked in cachectic patients with colorectal and gastric cancer[J].J Clin Gastroenterol,2002,34(4):416-420.
