不同宿主来源犬瘟热病毒的分离及致病相关基因序列分析
2012-02-24李天松王胜乐许微微李元果高玉伟王铁成夏咸柱
李天松,王 磊,王胜乐,姜 雪,许微微,李元果,高玉伟,3,王铁成,3,黄 耕,3,夏咸柱,3
(1.吉林农业大学动物科学技术学院,吉林 长春 130118;2.中国人民解放军军事医学科学院军事兽医研究所,吉林 长春 130122;3.吉林省人畜共患病预防与控制重点实验室,吉林 长春 130122)
犬瘟热(CD)是由犬瘟热病毒(CDV)引起的一种急性、热性、高度接触性传染病[1],是目前国内外犬、貂、狐狸等经济动物的主要传染病之一,常造成巨大经济损失。CDV致病性相关的蛋白主要是V蛋白、F蛋白。V蛋白能干扰干扰素(Interferon,IFN)通路,促进病毒对宿主的逃逸[2]。F蛋白诱导膜融合,其先以无活性的前体F0形式存在,被宿主蛋白水解酶裂解[3-5]成信号肽、F1、F2亚单位[6]。F1亚单位包括几个在促进膜融合中有重要作用的区域:跨膜区(TM)、胞质尾区(CT,20~40残基)、融合肽(FP)-在所有的CDV毒株中高度保守。此外,F1还包括两个七价重复区:HRA、HRB[7]。本试验从我国CDV发病死亡犬、狐狸体内分离到4株病毒,基因进行克隆及测序后对其V基因、F基因进行分析,报告如下。
1 材料与方法
1.1 病料样品 样品来自于自然发病死亡藏獒(TM)、四川犬、潍坊狐狸、松源狐狸,临床表现为发热,血便,食欲减退,鼻内有水样液体流出,眼角有分泌物,皮肤有少量皮疹。剖检留肺脏、脾脏、肠等器官,-70℃保存备用。
1.2 载体、感受态细胞及相关试剂 载体p EASYT Simple Vector及DH5α感受态细胞、pfu高保真DNA聚合酶及d NTP,购自北京全式金生物技术有限公司;质粒小量提取试剂盒、凝胶回收试剂盒,购自AXYGEN公司;AMV反转录酶,购自Sigma公司;RNA提取试剂盒,购自Bio Flux;FITC标记的羊抗鼠二抗,购自北京中杉金桥生物技术有限公司;抗CDV单克隆抗体由本实验室制备;其他试剂,购自Ta KaRa公司。
1.3 细胞 Vero-DST(Vero-DogSLAMTag)细胞,由本实验室构建及保存。DMEM,购自Gibco公司,细胞培养瓶,购自于Costar公司。
1.4 病料的处理 -70℃取出肺及脾,称重后冰上研磨至匀浆,按重量体积比1∶10加入无血清的含有1 000 IU/m L双抗的DMEM继续研磨约3 min。倾出匀浆液4℃3 000 r/min离心10 min,5 000 r/min离心10 min,无菌吸出上清备用。
1.5 细胞培养 Vero-DST 75 cm2瓶内长成单层,加入病料上清液2 m L,33℃感作1 h后加入20 m L含有2%犊牛血清的DMEM,37℃培养,每天观察细胞病变,如无病变第5天冻融收毒再接Vero-DST细胞。如此传代至第5代用于鉴定及序列测定。
1.6 病毒鉴定
1.6.1 电镜检查 取第5代Vero-DST细胞毒200 μL 1 000 r/min离心10 min后取上清进行电镜检查。1.6.2 间接免疫荧光鉴定及TCID50测定 Vero-DST消化计数,调整为2×105个/m L按100μL/孔铺96孔板。培养12 h弃上清接种10倍连续稀释的猴、犬Vero-DST第5代毒,每个稀释度接4个孔,100μL/孔,37℃培养5 d。以抗CDV单克隆抗体为一抗、FITC标记的羊抗鼠抗体为二抗(含0.3%伊文斯蓝)进行间接免疫荧光鉴定,以阳性孔算为病变孔按Reed-Muench方法TCID50。
1.6.3 PCR鉴定、引物设计及合成 PCR鉴定引物根据CDV N基因保守区设计并由Ta KaRa公司合成,目的片段大小为477 bp,引物序列:CDV-F:5′-GTGACTGCTCCTGATACTGC-3′、CDV-R:5′-ACCAACTCCCATAGCATAAC-3′。病 毒 液 提 取CDV基因组并反转录并鉴定,设阳性及阴性对照。1.6.4 5株CDV分离毒的V基因、F基因序列克隆及测定 根据GenBank上发表的强毒株A75/17(AF164967.1)序列设计引物,全基因共分为17段进行PCR,电泳回收阳性片段并连接p EASY-T Simple载体,转化TOP10感受态细胞后涂于Amp+LB平板,挑取10个菌落于5 m L 2倍Amp+的LB液体培养基37℃摇均,12 h用AXYGEN公司质粒小提试剂盒提取质粒,阳性质粒送TaKaRa公司测序,每个片段送5个样。测序结果拼接后将V、F蛋白 氨 基 酸 序 列 与 5804(AY386315.1)、A75/17(AF164967.1)、Onderstpoort(AF014953.1)、CDV3(EU726268.1)、Snyder Hill(GU138403.1)等共20多株强毒株、疫苗株进行比较,分析5株CDV与参考毒株之间的V、F蛋白氨基酸衍化特征。
2 结果
2.1 病毒分离及鉴定结果 所有病毒接种Vero-DST培养至第5代并无明显细胞病变产生(见图1 B),细胞形态与对照细胞(见图1 A),略有差异。5d后收毒,细胞冻融物电镜检测可见有典型的副黏病毒样颗粒,形态呈圆形和多形性(见图2),由此可初步确定分离到犬源和狐狸源CDV,并命名为CDVTM-CC、CDV-Dog-SCh、CDV-Fox-SY、CDV-Fox-WF。
以CDV-TM-CC与 CDV-Fox-WF为代表进行间接免疫荧光鉴定,Vero-DST细胞对照在荧光显微镜下全部细胞均为红色(见图3A)。而低稀释倍数接毒细胞可见有散在发绿色的细胞,个别细胞内可见有多个核,形成多核巨细胞(见图3B、图3C)。荧光分布显示没有大面积的荧光团,故在光镜下没有形成肉眼可见的细胞病变。计算CDV-TM-CC TCID50为 103.5/m L,CDV-Monkey-BJ TCID50为102.5/m L。
4株分离毒与本实验室保存的猴源CDV-Monkey-BJ提取 RNA,经反转录,特异引物鉴定按CDV-Monkey-BJ、CDV-TM-CC、CDV-Dog-SCh、CDV-Fox-SY、CDV-Fox-WF顺序进行电泳,结果可见5株病毒、阳性对照在500 bp左右有明显的条带,大小一致,而三馏水阴性对照无条带(见图4),因此PCR结果为阳性。
由上述数据可证实,用Vero-DST细胞系分离到4株猴源CDV病毒,病毒在Vero-DST细胞上传5代没有形成细胞病变。

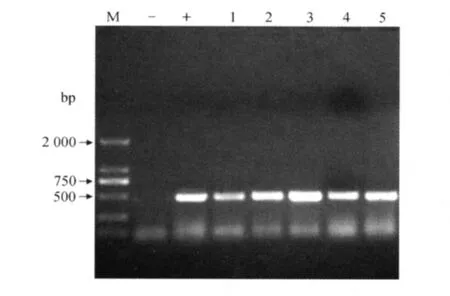
图4 5株细胞毒PCR鉴定结果
2.2 F蛋白序列分析 CDV-TM-CC、CDV-Monkey-BJ、CDV-Dog-SCh、CDV-Fox-WF和CDV-Fox-SY F蛋白分析,可见5株与强毒株氨基酸同源性在93.8%~99.1%,而与弱毒株同源性在90.4%~93%之间,因此5株分离毒与强毒株的亲缘关系较近。分析F蛋白内部可见信号肽与F1、F2相比变异较大,13~37位、72~112位之间氨基酸变化最大,有多处存在连续3个氨基酸不同。疫苗株有27个特有氨基酸,在这27个位点5株与其完全不同。108~110位的NAT潜在N-糖基化位点为强毒株和5株分离株所共有,疫苗株没有(见图5)。
F2区域内208K、216L和 F1区域:390F、431I、616S(位于TM区)、646A(位于CT区)是疫苗株共有4个特有的氨基酸位点。CDV-TM-CC、CDVMonkey-BJ、CDV-Dog-SCh、CDV-Fox-WF and CDV-Fox-SY在这6个位点与强毒株一致。此外,CDV-Monkey-BJ还有7个特有位点:317R、347I、465I、466T、471P、472W、586N,全部集中于F1片段上,这可能是其引起猴发病的分子基础。F1、F2区域共有4个潜在N-糖基化位点:141~143 NLS、173~175 NVS、179~181 NCT、517~519 NQS,前三者位于F2亚基内,NQS位于F1亚基内。HQS位于F1亚基内。
在二硫键形成和蛋白的空间构型中半胱氨酸(C)起着主要的作用。本试验所分离到的5株CDV F蛋白与强毒株、疫苗株均有17个半胱氨酸残基,且为强毒株与疫苗株共有。因此空间构型上强毒株与弱毒株可能一致。
2.3 V蛋白分析 V蛋白与CDV的毒力有关,强毒株的V基因可干扰宿主干扰素(IFN)通路,从而有利于CDV的宿主逃逸。5株Vero-DST V基因与参考毒株氨基酸序列分析表明,其与强毒株同源性在92%~99.7%之间,与疫苗株的同源性在89.3%~93.3%之间,V蛋白疫苗株与强毒株共有9个位点是完全不一致的CDV-Monkey-BJ在这9个位点上完全与强强株一致,说明本株毒与强毒株亲缘关系较近。
对比麻疹病毒(Measles virus)与CDV的V蛋白,272位存在C/R的差异,用swiss-model网站进行C272R突变同源蛋白空间构象模拟,结果显示,结合Zn分子的能力下降(见图6)。这对下一步CDV V基因的研究提供理论依据。

图6 V蛋白C272R突变空间构象模拟
3 结论与讨论
利用本实验室构建的Vero-DST细胞系分离到4株CDV 并命名为 CDV-TM-CC、CDV-Dog-SCh、CDV-Fox-WF 和 CDV-Fox-SY。 在 Vero-DST 细胞上传到5代病毒并不形成细胞病变,10代以后产生细胞病变,通过后续的研究中发现,CDV-TM-CC株10代与5代在F基因内存在三个氨基酸位点差异,这三个位点可能与细胞病变形成有关。
V蛋白、F蛋白是与CDV致病性相关的两个主要蛋白,F蛋白在病毒的入侵及细胞之间的传播是至关重要,5株病毒分析结果显示,CDV-Monkey-BJ F1区域内有7个特有位点:317R、347I、465I、466T、471P、472W、586N,这些位点可能与其能引起灵长类动物发病有关。值得关注的是586N位于HRB内,而HRB在膜融合过程中参与6螺旋体的形成[8]。F2、F1亚基内潜在 N-末端糖基化位点5株病毒与参考序列一致,这比Sultan等[9]2009报道的部分AisaⅡ型毒株少一个糖基化位点,因此其抗原性可能与其有差异。
V蛋白可干扰IFN通路中部分因子的磷酸化及其向核内转移,因此在CDV抗宿主干扰素作用中起关键性作用。V蛋白序列分析表明,5株CDV与强毒株亲缘关系较近,同源性为94%~99.7%。国外学者报道V蛋白110Y、272C两个位点在抗宿主IFN作用中起到关键作用[10-11]。本试验对CDVMonkey 5代毒V蛋白序列进行空间构象同源模拟也证实C272R突变使其失去Zn结合能力下降,从而改变锌指结构的空间稳定性。
综上所述,本试验分离到4株CDV,并将其命名 为 CDV-TM-CC、CDV-Dog-SCh、CDV-Fox-SY、CDV-Fox-WF株,其在V蛋白、F蛋白与强毒株亲缘关系较近。后续通过雪貂试验证实其确为强毒株,但其对犬、猴的致病性如何还需进一步试验。
[1]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:756-762.
[2]Fontana J M,Bankamp B,Rota P A.Inhibition of interferon induction and signaling by paramyxoviruses[J].Immunological reviews,2008,225(1):46-67.
[3]Iwatsuki K,Miyashita N,Yoshida E,etal.The nucleotide and predicted amino acid sequence of the fusion protein of recent isolates of canine distemper virus in Japan[J].The Journal of veterinary medical science/the Japanese Society of Veterinary Science,1998,60(3):381-385.
[4]Kovamees J,Blixenkrone-Moller M,Sharma B,etal.The nucleotide sequence and deduced amino acid composition of the haemagglutinin and fusion proteins of the morbillivirus phocid distemper virus[J].J Gen Virol,1991,72 (Pt 12):2959-2966.
[5]Visser I K,van der Heijden R W,van de Bildt MW,etal.Fusion protein gene nucleotide sequence similarities,shared antigenic sites and phylogenetic analysis suggest that phocid distemper virus type 2 and canine distemper virus belong to the same virus entity[J].J Gen Virol,1993,74(Pt 9):1989-1994.
[6]von Messling V,Cattaneo R.Amino-terminal precursor sequence modulates canine distemper virus fusion protein function[J].J Virol,2002.76(9):4172-4180.
[7]Plattet P,Cherpillod P,Wiener D,etal.Signal peptide and helical bundle domains of virulent canine distemper virus fusion protein restrict fusogenicity[J].J Virol,2007,81(20):11413-11425.
[8]von Messling V,Milosevic D,Devaux P,etal.Canine distemper virus and measles virus fusion glycoprotein trimers:partial membrane-proximal ectodomain cleavage enhances function[J].J Virol,2004,78(15):7894-7903.
[9]Sultan S,Charoenvisal N,Lan N T,etal.The Asia 2 specific signal peptide region and other domains in fusion protein genes characterized Asia 1 and Asia 2 canine distemper viruses[J].Virol J,2009,6:157.
[10]Rothlisberger A,Wiener D,Schweizer M,etal.Two domains of the V protein of virulent canine distemper virus selectively inhibit STAT1 and STAT2 nuclear import[J].J Virol,2010,84(13):6328-6343.
[11]Takaki H,Watanabe Y,Shingai M,etal.Strain-to-strain difference of V protein of measles virus affects MDA5-mediated IFN-beta-inducing potential[J].Mol Immunol,2011,48(4):497-504.
