二倍体马铃薯花药培养再生体系的优化
2012-02-23李文霞宁海龙张永根白雅梅魏峭嵘张丽莉吕文河
李文霞 宁海龙 张永根 白雅梅 石 瑛 魏峭嵘 张丽莉吕文河*
(1 东北农业大学农学院,黑龙江哈尔滨 150030;2 东北农业大学动物科技学院,黑龙江哈尔滨150030;3 东北农业大学资环学院,黑龙江哈尔滨 150030)
马铃薯(Solanum tuberosumL.)是粮菜兼用型作物,也是仅次于小麦、水稻、玉米的世界第四大粮食作物,具有生育期短、适应性强、营养丰富、高产稳产、产业链长、开发利用前景广阔等特点。二倍体马铃薯中有许多非常宝贵的性状,如高干物质含量、低还原糖含量、高蛋白含量,抗霜冻、抗盐碱、抗寒、抗旱、耐热等能力较强。因此,以花药培养为桥梁进行二倍体马铃薯孤雄生殖有望获得马铃薯新资源。
印度德里大学的学者Guha 和Maheshwari(1964)以理解减数分裂的机制为目的,培养曼陀罗花药时,发现花药花粉形成胚,进而被诱导形成单倍体植株。我国学者在花药培养方面进行了广泛的研究,取得了许多重要的理论与实践成果。如在花椰菜(张晓芬 等,2005)、甘蓝(方淑桂 等,2006)、观赏茄(宋明 等,2005)、羽衣甘蓝(邹金美 等,2005)、刚果12 号桉(李守岭和庄南生,2006)、中国水仙(张清国 等,2010)等植物上通过花药培养获得单倍体植株,但在实际应用中均存在产胚率低等诸多问题。朱明凯等(1985)从马铃薯愈伤组织分化出的苗有混倍体(2n=28、32)、双单倍体(2n=24)和四倍体(2n=48),而从胚状体诱导成苗的均为双单倍体(2n=24)。戴朝曦等(1993)首次报道了用花药培养法由马铃薯一个典型的雄性不育双单倍体甘花双7 号诱导产生一单倍体,植株之间表现出明显的性状分离,经鉴定具有典型的一单倍体特征。冉毅东等(1996)用3 种不同温度的前处理对马铃薯双单倍体进行花药培养,倍性鉴定结果表明,从双单倍体诱导的胚状体分化的植株绝大多数为纯合二倍体,可能是胚状体在发育过程中体细胞染色体自发加倍。梁彦涛等(2006)研究马铃薯花药培养影响因素时发现马铃薯花药培养对基因型依赖性很大。
马铃薯的花药培养多以四倍体为研究对象,获得的双单倍体仍为杂合体,限制了很多隐性基因的表达,为此前人的研究是由马铃薯四倍体普通栽培种诱导双单倍体,再由双单倍体诱导一单倍体(戴朝曦 等,1993)。本试验以具有优良性状的二倍体马铃薯为试验材料,通过一步诱导就可以获得一单倍体,以达到即简化花药培养程序又能利用二倍体资源优良性状的目标。
1 材料与方法
1.1 材料
试验材料为原始二倍体马铃薯栽培种S.phureja-S.stenotomum(PHU-STN),经选择适应长日照的无性系杂种61 份:BD1-2、BD1-5、BD2-2、BD4-6、BD5-7、BD6-8、BD8-2、BD8-4、BD10-4、BD10-7、BD10-8、BD11-8、BD12-5、BD12-7、BD14-2、BD15-1、BD16-4、BD17-3、BD18-8、BD21-1、BD22-3、BD24-6、BD26-6、BD29-1、BD29-3、BD31-3、BD32-9、BD34-4、BD35-4、BD35-7、BD36-4、BD38-7、BD39-3、BD40-2、BD40-7、BD41-2、BD41-7、BD42-5、BD44-5、BD45-3、BD46-1、BD46-7、BD48-2、BD51-4、BD53-9、BD54-8、BD55-3、BD57-3、BD58-7、BD60-3、BD60-6、BD62-1、BD62-2、BD62-7、BD63-2、BD64-8、BD64-9、BD65-8、BD68-6、BD69-4、BD72-9,均由东北农业大学马铃薯研究所保存。
1.2 方法
试验试剂均购自哈尔滨伊事达生物公司,试验仪器为博讯SW-CJ-2F(D)垂直吹风有挡板超净工作台、博讯YXQ-LS-50S11 高压灭菌器。在东北农业大学马铃薯研究所组培室培养材料,温度为25 ℃,光暗周期为16 h/8 h。
1.2.1 试验材料种植 61 份材料于2008年4月20日播种于东北农业大学马铃薯网棚、东北农业大学香坊试验实习基地、黑龙江省农业科学院克山马铃薯研究所试验基地、大兴安岭地区农业科学研究所试验基地,单行区,行长2 m,行距0.65 m,株距0.30 m,每行7 株,6月23日开始采集花药。
2008年筛选出的适合基因型BD10-7、BD40-2、BD54-8、BD46-7、BD29-1、BD12-7,于2009年4月23日播种于东北农业大学马铃薯网棚、东北农业大学香坊试验实习基地,6月26日开始采集花药。
1.2.2 适宜基因型的筛选 将花药接种在基础愈伤组织诱导培养基 MS+0.5 mg·L-1NAA+0.5 mg·L-1KT+0.5 mg·L-12,4-D+60 g·L-1蔗糖+7 g·L-1琼脂(pH 5.8)上(王梓全 等,2007),每处理接种600 个花药,30 d 后调查诱导出愈伤组织的花药外植体数目以统计愈伤组织诱导率。60 d 后调查花药愈伤组织上分化的绿苗数目以统计再生植株分化率。
愈伤组织诱导率(%)=(产生愈伤组织的花药数/接种花药数)×100%
再生植株分化率(%)=(再生植株数/接种花药数)×100%
1.2.3 花药预处理的筛选 以基因型BD10-7为试验材料,根据前人研究成果(张晓芬 等,2005;邹金美 等,2005;王梓全 等,2007;张清国 等,2010),本试验设计进行4 ℃低温、35 ℃热激、离心和0.5 mol·L-1甘露醇预处理的L16(45)正交试验设计(表1)。其中前2项处理设4 个水平,分别为0、2、4、6 d;离心处理30 min,转速4 个水平分别为2 000、4 000、6 000、8 000 r·min-1;甘露醇预处理为在无菌条件下剥出花药,浸泡于已灭菌的甘露醇中,分4 个水平0、1、2、3 d,正交设计表见表1。3 次重复,每处理120 个花药,15 d 后调查出现褐化现象的花药数目以统计花药褐化率。30 d 后统计愈伤组织诱导率。
褐化率(%)=(褐化花药数/接种花药数)×100%
1.2.4 激素配比的优化 选用基因型BD40-2为试验材料,在诱导培养基中添加不同的激素组合,激素配比见表2。15 d 后统计花药褐化率,30 d 后统计愈伤组织诱导率。
1.2.5 碳源的筛选 选用基因型BD54-8 为试验材料,参照前人研究成果(王梓全 等,2007;周旭红 等,2011),本试验进行碳源处理为:处理1(CK),添加6%蔗糖;处理2,添加3%麦芽糖;处理3,添加6%麦芽糖;处理4,添加9%麦芽糖。15 d 后统计花药褐化率,30 d后统计愈伤组织诱导率。
1.2.6 乙烯拮抗剂的筛选 以基因型BD10-7 为试验材料,参考袁华玲等(2008)研究结果,乙烯拮抗剂设3 个处理:处理1(CK),不添加乙烯拮抗剂;处理2,添加50 mg·L-1AgNO3;处理3,添加1 mmol·L-1硫代硫酸银(STS)。每瓶接种花药40 个,每处理接种6 瓶,3 次重复。15 d 后统计花药褐化率,30 d 后统计愈伤组织诱导率。
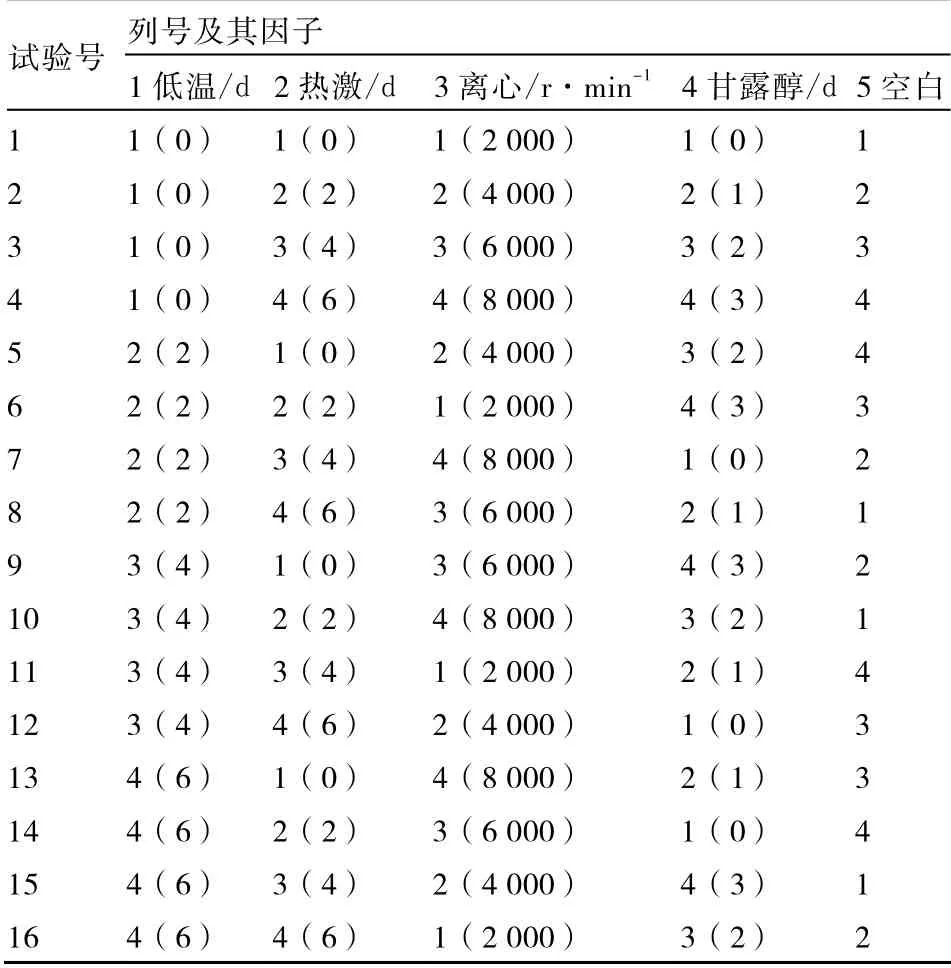
表1 低温、热激、离心转速、甘露醇预处理的L16(45)正交设计
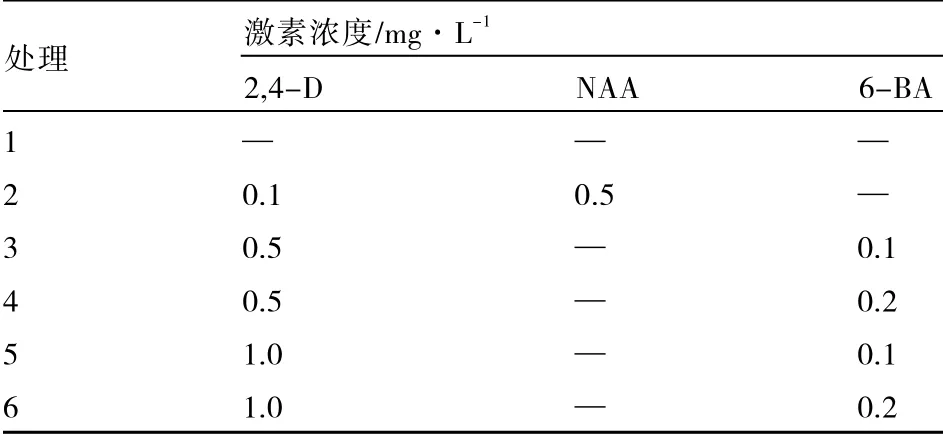
表2 激素配比的优化
1.3 数据分析
对1.2.2、1.2.4、1.2.5、1.2.6 统计3 次重复的平均数,对1.2.3 进行数据的反正弦转换,之后进行方差分析(宁海龙,2012)。全部试验数据应用SAS 9.0 统计软件进行分析。
2 结果与分析
2.1 基因型对马铃薯花药培养愈伤诱导和植株再生的影响
61 份材料中共有13 个基因型能够诱导出愈伤组织(图1-A),愈伤组织诱导率见表3。从表3 可以看出,这13 个基因型中BD60-3、BD46-1、BD54-8 愈伤诱导率最高,达到3.33%,其次为BD40-2、BD10-7 和BD64-8,分别为2.17%、1.67%和1.33%。在这13 个基因型中,有6个能够分化出再生植株(图1-B),其中再生植株分化率最高的是BD40-2,达到10.00%,其次为BD54-8 和BD12-7,分别为3.33%和1.67%。综合上述分析,基因型BD40-2、BD54-8 和BD10-7 为二倍体花药培养最适基因型。

图1 马铃薯花药诱导的组织愈伤和再生植株
2.2 预处理对马铃薯花药培养愈伤褐化和愈伤诱导的影响
预处理各因素对马铃薯花药培养褐化和诱导的影响见表4。各因素对花药培养褐化率和诱导率的F值均达到极显著水平,说明各因素对降低二倍体马铃薯花药培养的褐化率和提高诱导率有极显著效应。各因素对褐化率的影响为热激>离心>甘露醇>低温,而各因素对诱导率的影响为低温>热激>甘露醇>离心。
预处理各因素各水平对马铃薯花药培养褐化率的影响见表5。低温预处理6 d 的褐化率显著低于低温预处理0、2、4 d,但低温预处理0、2、4 d 3 个处理之间差异不显著;热激预处理4 d 的褐化率极显著低于其他处理,热激预处理0、2 d 之间差异不显著,但显著低于热激预处理6 d;离心预处理4 000 r·min-1的褐化率极显著低于离心预处理2 000、6 000、8 000 r·min-1,但离心预处理2 000、6 000、8 000 r·min 3 个处理之间差异不显著;甘露醇预处理2 d 的褐化率极显著低于甘露醇预处理3 d,但与甘露醇预处理0、1 d 之间差异不显著。
预处理各因素各水平对马铃薯花药培养诱导率的影响见表6。低温预处理6 d 的诱导率极显著高于低温预处理0、2、4 d,但低温预处理0、2、4 d 3 个处理之间差异不显著;热激预处理4d 的诱导率极显著高于其他热激预处理,热激预处理2 d 的诱导率显著高于热激预处理6 d,但热激预处理0、2 d 之间差异不显著;离心预处理4 000 r·min-1的诱导率极显著高于其他离心预处理;甘露醇预处理2 d 的诱导率极显著高于甘露醇预处理0、1、3 d,甘露醇预处理1 d 的诱导率显著高于甘露醇预处理3 d。
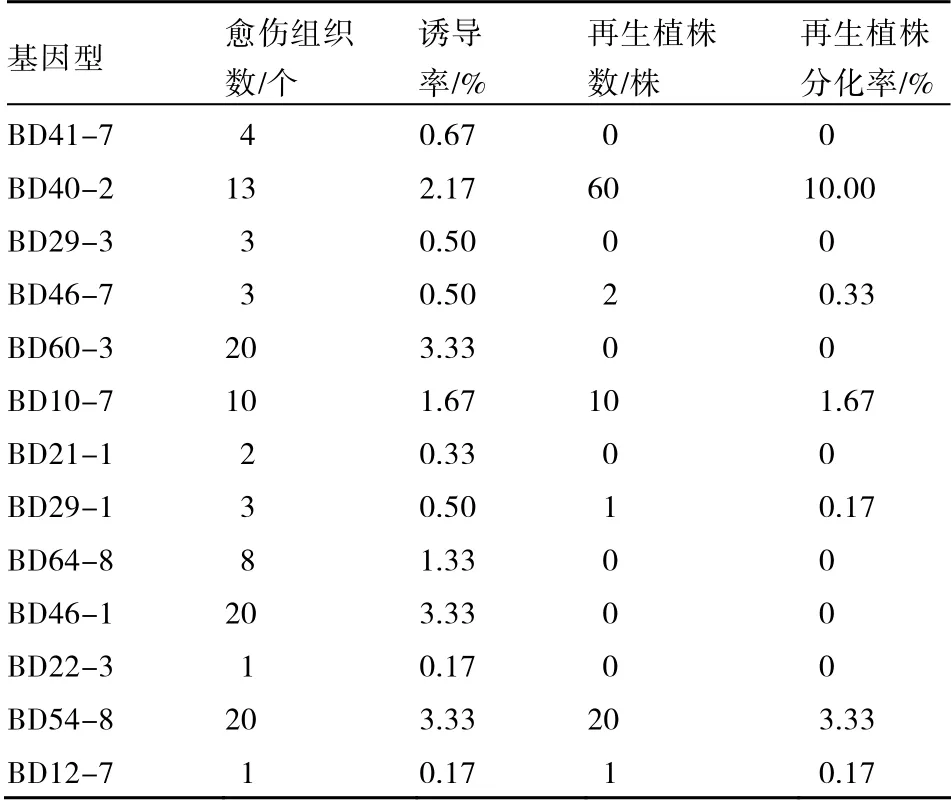
表3 不同基因型对马铃薯花药培养愈伤诱导和植株再生的影响
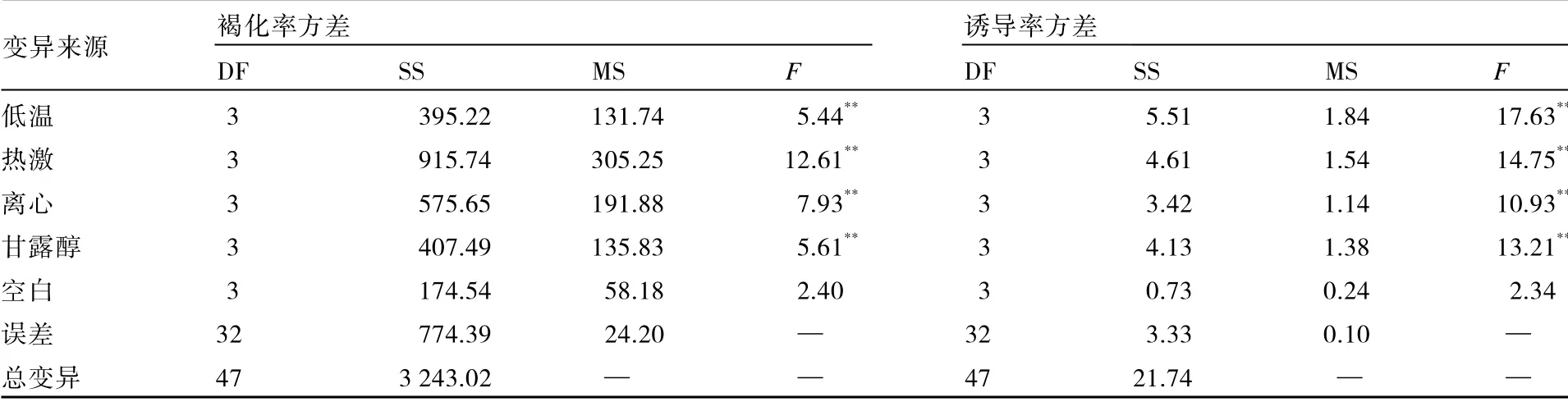
表4 不同预处理对马铃薯花药培养褐化率、诱导率影响的方差分析
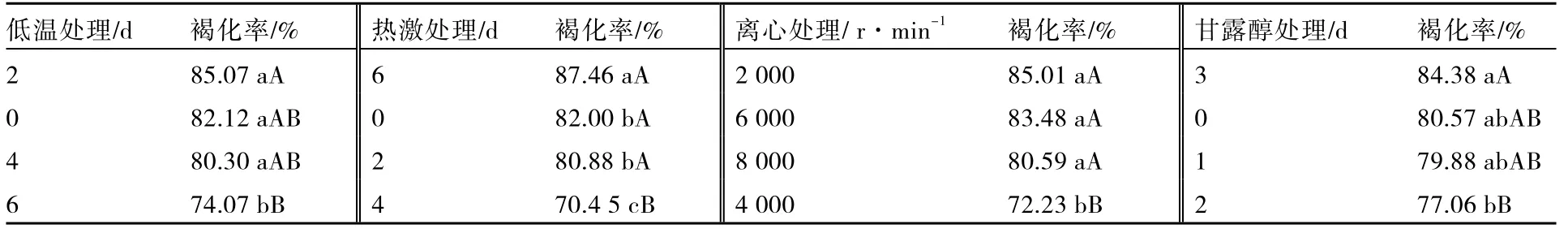
表5 预处理各因素对马铃薯花药培养褐化率的影响
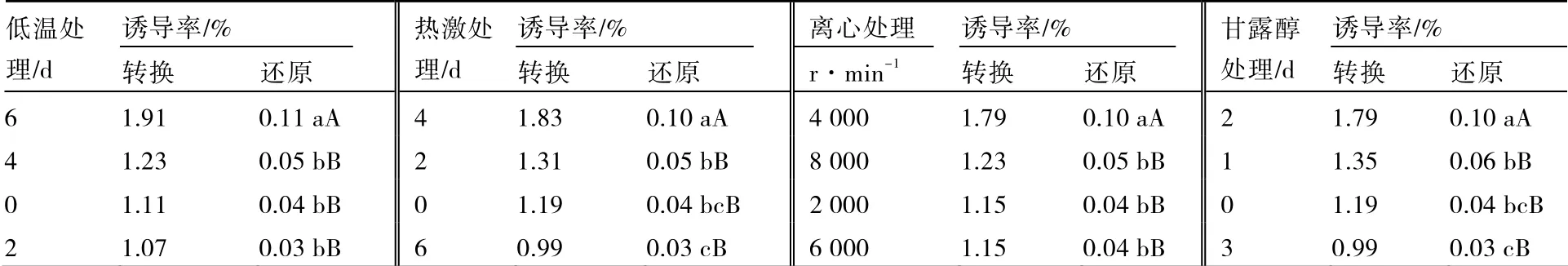
表6 预处理各因素对马铃薯花药培养诱导率的影响
试验中发现褐化程度没有达到死亡状态的花药仍能诱导出愈伤(图2),因此通过上述分析,确定最佳的预处理组合为低温6 d、热激4 d、离心4 000 r·min-1、甘露醇2 d。
2.3 激素配比对马铃薯花药培养愈伤褐化和愈伤诱导的影响
由表7 可以看出,2,4-D 为1.0 mg·L-1、6-BA 为0.2 mg·L-1的激素配比(处理6)的马铃薯花药褐化率最低,为85.13%,但该配比的诱导率为1.90%,仅高于处理2 和处理3。2,4-D 为1.0 mg·L-1、6-BA 为0.1 mg·L-1的激素配比(处理5)的马铃薯花药褐化率在各处理中较低,仅高于处理6,但该配比的诱导率为10.56%,在所有处理中最高。

图2 马铃薯褐化花药诱导的愈伤
2.4 碳源对马铃薯花药培养愈伤褐化和愈伤诱导的影响
碳源及浓度水平的筛选结果见表 8。麦芽糖浓度为 3%时,马铃薯花药褐化率最低,为93.23%,而诱导率较高,达到2.60%,高于对照;麦芽糖浓度为9%时,马铃薯花药褐化率低于对照,为97.91%,而诱导率最高,达到2.69%。由于麦芽糖浓度为3%和9%两个水平对花药培养的影响差异不大,为节约成本,本试验选用麦芽糖浓度为3%的水平。
2.5 乙烯拮抗剂对马铃薯花药培养愈伤褐化和愈伤诱导的影响
不同处理对二倍体马铃薯花药培养褐化和诱导的影响方差分析表明(表9),培养基中不添加乙烯拮抗剂、添加50 mg·L-1AgNO3和添加1 mmol·L-1STS 对褐化和诱导影响的F值分别为12.01 和44.07,均达到显著水平,说明培养基中添加乙烯拮抗剂对降低二倍体马铃薯花药培养的愈伤褐化率和提高愈伤诱导率均有显著效应。
乙烯拮抗剂处理对马铃薯花药培养褐化的影响见表 10。培养基中添加 50 mg·L-1AgNO3处理和添加1 mmol·L-1STS 处理的褐化花药数均与对照差异达到显著水平,但这2 个处理之间差异不显著。3 个处理诱导愈伤组织数之间差异显著。培养基中添加1 mmol·L-1STS 诱导的愈伤组织数显著高于培养基中添加50 mg·L-1AgNO3。
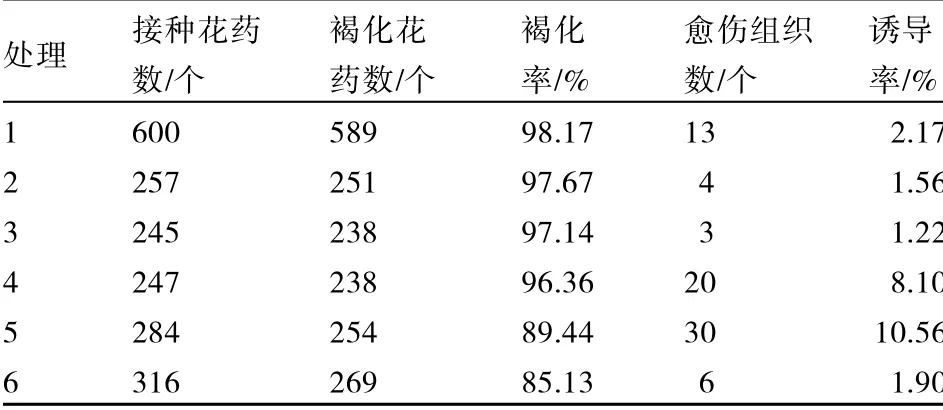
表7 不同激素配比对马铃薯花药培养愈伤褐化和愈伤诱导的影响
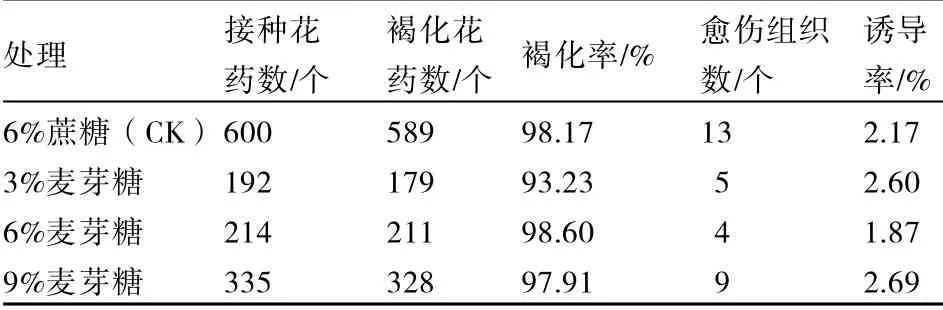
表8 不同碳源对马铃薯花药培养愈伤褐化和愈伤诱导的影响
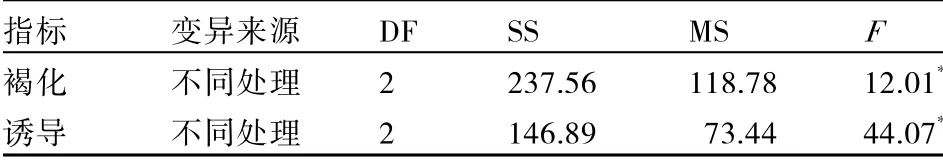
表9 乙烯拮抗剂对马铃薯花药褐化和愈伤诱导影响的方差分析
3 结论与讨论
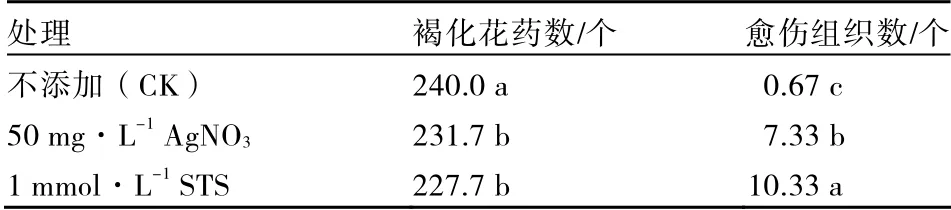
表10 不同乙烯拮抗剂对马铃薯花药培养愈伤褐化和愈伤诱导的影响
本试验以筛选的适宜基因型进行后续不同处理的各项研究,因材料资源的限制,不同的试验处理选用的基因型材料不一致。但每项处理所用的材料均为适宜花药培养的基因型,因此得出的试验结论能够代表该项处理的试验结果。基因型是影响马铃薯花药培养效率的一个主要因子,研究表明(卢翠华 等,2005;梁彦涛 等,2006),花粉植株的诱导率与供试材料的基因型有很大关系。本试验结果与前人的研究结果一致,从61 份基因型中筛选出6 份适合花药培养的基因型。
培养前对花药进行预处理,实质上是对其进行某种形式的胁迫,通过外界逆境因素的刺激,促使花药内离体小孢子完成从活体内配子体发育转为离体下的孢子体发育,即脱分化启动(Pechan & Keller,1988)。本试验发现各因素对褐化率的影响为热激>离心>甘露醇>低温,而各因素对诱导率的影响为低温>热激>甘露醇>离心,这导致如果单纯以褐化率或诱导率为指标的矛盾现象,因此根据试验中的具体情况,褐化程度没有达到死亡状态的花药仍能诱导出愈伤,综合考虑褐化率和诱导率两项指标确定最佳的预处理为低温6 d、热激4 d、离心4 000 r·min-1、甘露醇处理2 d。
培养基中激素的种类、用量和配比对诱发小孢子启动、分裂、生长和分化具有作用(周旭红 等,2011)。2,4-D 对许多作物花粉的启动、分裂、形成愈伤组织和胚状体起着决定性的作用(陈晓 等,2003)。单一激素成分培养的效果较差,合理的激素配比是保证组培效果的基础(周旭红 等,2011)。本试验中发现1.0 mg·L-12,4-D、0.1 mg·L-16-BA 的激素配比的花药愈伤诱导率最高。戴朝曦(1991)认为6%的蔗糖浓度有利于多数马铃薯材料的胚状体发生,这可能与花粉细胞或体细胞的渗透压有关,但浓度过高也不利于愈伤组织的诱导。本试验发现麦芽糖浓度为3%较适合愈伤的诱导。
褐化是花药死亡的主要因素(冉毅东和戴朝曦,1993),本试验首次将STS 引入到马铃薯的花药培养中。研究发现尽管培养基中添加AgNO3和STS 对降低花药的褐化率差异不显著,但对提高花药培养的愈伤诱导率差异显著。笔者认为同预处理的效应一样,轻度褐化的花药也能诱导愈伤。应振土和陈昆松(1990)认为,低浓度的STS 对植物组织没有毒害作用,但它却有效地抑制了乙烯的生物学作用。而AgNO3在抑制乙烯生物学作用的同时,对原生质的本身有毒害作用。因此本试验认为STS 对花药的毒害作用要小于AgNO3,这与前人的研究结果一致。
陈晓,詹玉丝,徐小利,齐卫强,常高正,郅玉宝,易明林,吕淑玉.2003.花药培养建立辣椒DH 纯系的初步研究.河南农业科学,(9):52-55.
戴朝曦.1991.生物工程技术在马铃薯遗传育种研究中的应用.马铃薯杂志,5(3):161-166.
戴朝曦,于品华,冉毅东,曲秀兰.1993.用花药培养法由马铃薯雄性不育双单倍体诱导一单倍体植株的研究.遗传学报,20(2):141-146.
方淑桂,陈文辉,曾小玲,朱朝辉,廖晓珍,郑学立.2006.结球甘蓝游离小孢子培养及植株再生.园艺学报,33(1):158-160.
李守岭,庄南生.2006.刚果12 号桉花药愈伤组织诱导初报.热带农业科技,29(1):13-16.
梁彦涛,邸宏,卢翠华,陈伊里,石瑛,王梓全.2006.马铃薯花药培养影响因素的研究.东北农业大学学报,37(5):604-609.
卢翠华,梁彦涛,石瑛.2005.四倍体马铃薯的花药培养//陈伊里,屈冬玉.马铃薯产业与东北振兴.哈尔滨:哈尔滨工程大学出版社.
宁海龙.2012.田间试验与统计方法.北京:科学出版社:154-157.
冉毅东,戴朝曦.1993.马铃薯花药培养硝酸银对诱导双单倍体及一单倍体的效果.西北农业学报,2(4):43-47.
冉毅东,王蒂,戴朝曦.1996.提高马铃薯双单倍体花药培养产生胚状体及再生植株频率的研究.马铃薯杂志,10(2):74-78.
宋明,汤青林,邹建,李渝,刘荣.2005.不同因素对观赏茄花药愈伤组织诱导的影响.西南农业大学学报,27(4):534-536.
王梓全.2007.马铃薯花药培养再生植株的诱导与鉴定〔硕士论文〕.哈尔滨:东北农业大学.
应振土,陈昆松.1990.乙烯拮抗剂 —— 硫代硫酸银的生理作用.植物生理学通讯,(1):63-64.
袁华玲,金黎平,黄三文,谢开云,李颖,屈冬玉.2008.硫代硫酸银对二倍体马铃薯试管苗生长和生理特性的影响.作物学报,34(5):846−850.
张清国,黄敏玲,叶秀仙.2010.中国水仙花药培养及植株再生体系建立.分子植物育种,8(2):399-404.
张晓芬,王晓武,张延国,刘运霞,王永清.2005.花椰菜游离小孢子培养再生植株研究.中国蔬菜,(1):16-17.
周旭红,莫锡君,蒋亚莲,吴旻,龙江,李荣,桂敏.2011.激素、蔗糖浓度和取材时间对洋桔梗花药培养的影响.江苏农业科学,39(2):98-100.
邹金美,张国广,潘一山.2005.羽衣甘蓝花药培养技术体系的研究.漳州师范学院学报,(2):94-97.
朱明凯,程天庆,高湘玲,高秀云,宋伯符,吴绍岩,田翠萍.1985.早熟马铃薯四倍体栽培种花药诱导成株.园艺学报,12(3):172-180.
Guha S,Maheshwari S C.1964.In vitroproduction of embryos from anthers ofDatura.Nature,204:497.
Pechan P M,Keller W A.1988.Identification of potentially embryogenic microspores inBrassica napus.Physiol Plant,74(2):377-384.
