催化湿式氧化吡虫啉农药废水Cu/Mn催化剂稳定性
2012-02-19韩玉英
韩玉英
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
0 引言
吡虫啉是一种新型硝基亚甲基类内吸杀虫剂, 作为新一代农药产品,具有良好的市场前景.然而农药生产废水的处理问题一直是困扰企业的一大难题,由于废水水质复杂、有机物浓度高、难降解有机物多,采用传统方法处理,废水根本无法达到排放标准,对环境造成恶劣的影响.湿式氧化法是处理高浓度、有毒有害、难降解有机废水的一种有效手段,但由于其要在高温高压下进行,使它在实际应用中受到限制.而适当使用催化剂可大大降低反应温度和压力,使其工业应用成为可能.
催化湿式氧化所用的催化剂可以分为两类:一类是贵金属催化剂,贵金属催化剂由于价格昂贵使得其使用受到限制;一类是非贵金属催化剂.
非贵金属催化剂中的铜基催化剂,由于其高活性、廉价易得而成为主要研究对象[1-3],但Cu在苛刻反应条件下容易溶出流失, 有研究报道,铜基催化剂在反应中流失的铜离子浓度可达20 mg/L以上[4].从而导致铜基催化剂无法在工业上成功应用.
本研究以Cu为基础,制备了Cu/Mn复合金属氧化物催化剂,在处理吡虫啉农药废水中,发现催化剂不仅有很高的催化活性,如果较好的控制反应条件,两种金属离子溶出之和不超过0.3 mg/L.通过对催化剂的结构和反应条件的分析,发现以共沉淀法制得的催化剂中金属离子的流失很少,催化剂离子的流失和催化剂的结构以及反应条件有密切的关系.因此研究开发新型、高效、稳定及廉价的湿式氧化催化剂无疑是推广此技术的关键问题.
1 材料和方法
1.1 废水水质
废水取自某吡虫啉生产厂的二次萃取废水,主要成分为丙烯腈、甲苯、N,N-二甲基甲酰胺(DMF)和少量的2-氯甲基吡啶,5-氯甲基吡啶等 , COD为 38 855~45 660 mg/L, pH为 4.32~6.93,颜色呈浅黄色.
1.2 催化剂的制备
采用共沉淀法, 按不同质量配比、不同焙烧温度制备Cu/Mn催化剂.以 NaOH 溶液为沉淀剂,将相应的金属硝酸盐按一定比例混合均匀,再将金属硝酸盐混合溶液和NaOH溶液以恒定速度同时加入强烈搅拌的中和槽中生成沉淀物,于 80 ℃老化 2~4 h,真空抽滤使沉淀物和母液分离,用去离子水洗去沉淀物中的钠离子,于110 ℃干燥 12 h,在指定的温度下焙烧一定时间, 即制得催化剂.
1.3 实验方法
催化湿式氧化实验在2 L GCF系列永磁旋转搅拌反应釜中进行.氧化剂为氧气.实验时加入500 mL经适当稀释的吡虫啉农药废水和一定量的催化剂,密封反应釜, 密闭后通入N2保护并升温,达到预设温度190 ℃时开启搅拌并维持500 r/min转速, 通入反应所需的氧气达到总压 8.0 MPa,此时计为零时刻,以后每隔一定反应时间通过液体取样管取水样分析.
1.4 催化剂的表征
BET比表面积采用ZXF206型自动吸附仪测定,N2作吸附质.用重铬酸钾法测定废水的COD,用原子发射光谱法测金属离子溶出量,XRD测催化剂结构.
2 结果与讨论
2.1 催化剂的组成及制备条件
本研究根据配比(质量比), 焙烧温度,焙烧时间制备一系列催化剂.
对按不同工艺条件配制的催化剂,选A1(Cu∶Mn=1∶2,焙烧温度600 ℃,焙烧时间16h),A2(Cu∶Mn=1∶1,焙烧温度600 ℃,焙烧时间16 h),A3(Cu∶Mn=2∶1,焙烧温度600 ℃,焙烧时间16 h), A4(Cu∶Mn=2∶1,焙烧温度700 ℃,焙烧时间16 h)和A5(Cu∶Mn=2∶1,焙烧温度800 ℃,焙烧时间16 h)催化剂,对其性能进行测试.在反应温度190 ℃,总压8.0 MPa,氧分压1.6 Mpa,pH值8.28的条件下, 加入不同催化剂时废水COD去除率随氧化时间的变化如图1所示.
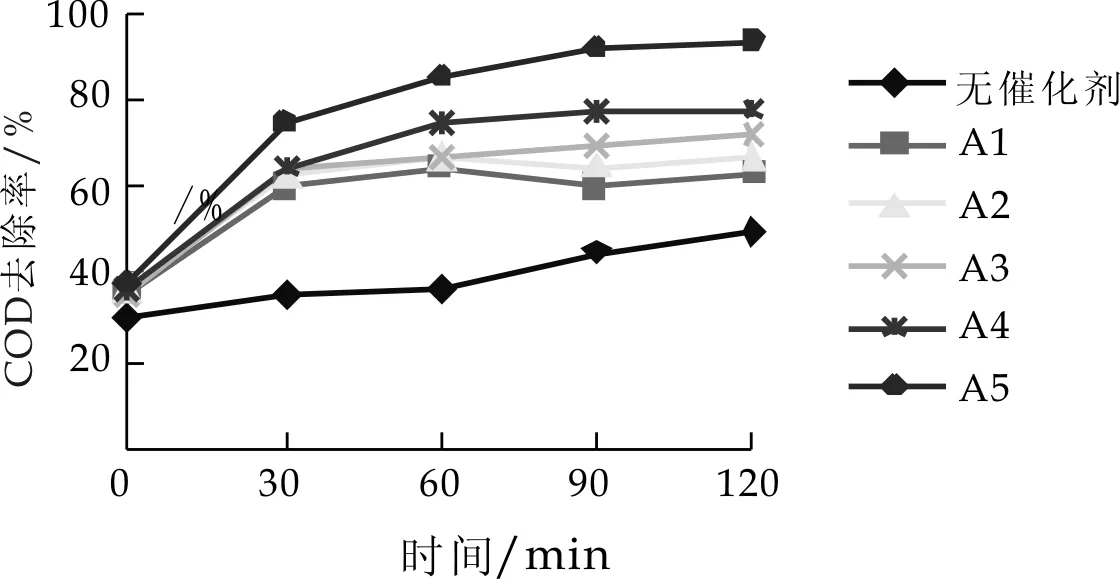
图1 A系列催化剂对COD去除率的影响
由图1可知,无催化剂时废水COD去除率很低.A1、A2、A3、A4和A5催化剂加入后,反应经过30 min, 这5种催化剂对COD的去除率和无催化剂相比有显著提高,从30 min到90 min,A1、A2、A3对COD的去除率变化不明显, A4和A1、A2、A3比较,COD去除率有所增加,A5对COD的去除率增加幅度最大,是无催化剂时的2倍多,COD的去除率达到93.12%.以后COD的去除率几乎保持不变,由此可知,A5催化剂对废水效果较理想.同时从图中得知Cu∶Mn比值对废水催化影响不大,考虑到铜价格比较廉价,因此选Cu∶Mn=2∶1;而焙烧温度是主要影响因素,从图中可知焙烧温度越高,越有利于提高催化剂的活性.这点可由催化剂的结构和金属离子的溶出量进行说明.
2.2 Cu/Mn(2∶1)催化剂的比表面积
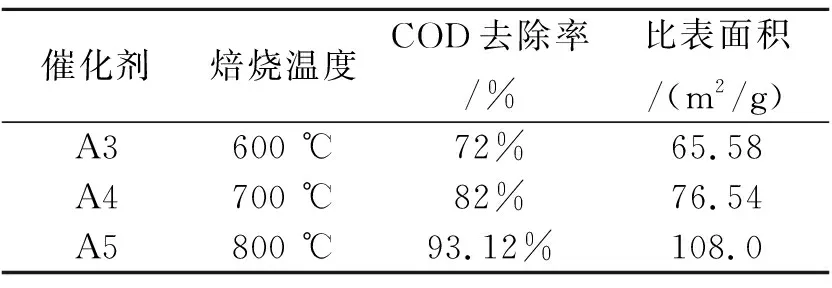
表1 Cu/Mn催化剂的比表面积
如表1所示,当焙烧温度由600 ℃升到800 ℃时,催化剂的比表面积由65.58 m2/g升到108.0 m2/g,这是由于采用高温焙烧,使离子间借助固态反应、互溶部分形成复合金属氧化物,使形态规则的晶体发生变形,就会使晶体的表面积增加;其次,焙烧过程中有气体产生,气体逸出后在催化剂中留下空隙,就会使内表面积增加;第三,随着焙烧温度升高,许多细小晶体紧密聚集而成为聚集态的单晶体,而这个过程为放热过程,随着过程进行,聚集的热量增多,当热量聚集到一定程度时,聚集态的单晶就会膨胀破裂,使得晶体更加细小,因此催化剂表面积增加,催化活性提高.
2.3 催化剂稳定原因分析
2.3.1 催化剂结构对组分流失的影响
图2为不同焙烧温度制得的Cu/Mn复合氧化物催化剂XRD衍射图,几个焙烧温度下催化剂中Cu主要以CuO物相存在.对照标准图谱可知,Mn以铜锰复合氧化物Cu1.4Mn1.6O4存在,而且随着焙烧温度升高,这种复合氧化物含量从59%(600 ℃焙烧)增加到69%(800 ℃焙烧),可见,通过高温焙烧,Mn进入CuO的晶格形成混晶结构,即形成固溶体,这种固溶体结构占总量的69%.一方面,由于这种结构的形成,提高了金属氧化物的晶格能,使金属氧化物的结构更加稳定;另一方面,复合氧化物容易与有机物和分子氧的电子结合形成络合物,并通过电子或配位体转移使有机物和分子氧的反应活性提高.因此结构更加稳定.
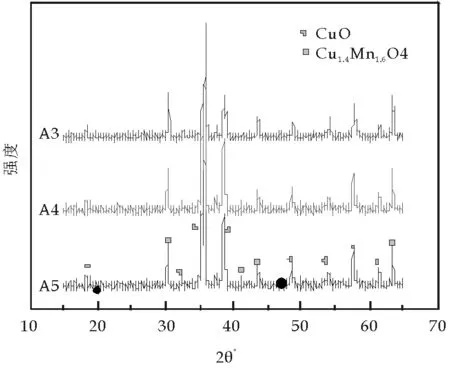
图2 Cu/Mn催化剂XRD衍射图
此外,从图2还可看出,随着焙烧温度的提高, XRD衍射峰强度减弱,而峰宽度增加.说明此时CuO、Cu1.4Mn1.6O4晶粒细小,可能是由于随着焙烧温度的提高,离子间借助固态反应、互溶形成晶格缺陷增多,使形态规则的晶体发生变形,颗粒粒度减小,就会使晶体的表面积增加,与比表面积测试结果一致.
2.3.2 催化剂晶格能对组分流失的影响
经过共沉淀制得Cu/Mn复合金属氧化物催化剂,经过高温焙烧,晶体各方面的性质都将发生改变.类似的研究工作[5]发现,当Cu-Al催化剂中随Al含量的增加时,将会影响M-O键的键长,使键长变短.由晶格能公式可知,键长是影响晶格能的重要参数,键长变短[6,7],晶格能增大.而晶格能是衡量晶体是否稳定的重要参数,晶格能越大的晶体,其稳定性越好.所以可推断,本研究合成的催化剂也是由于这个原因而变得更加稳定.根据晶格能计算公式,我们对此化合物进行了简单的定性计算,具体热力学计算如下:
晶格能Kanycthhckhh半经验公式[8](卡氏公式)
U=1.202×105[∑Z1Z2/(R++R-)]
×[1-34.5/(R++R-)]kJ·mol-1
Z1、Z2为二元离子化合物的正负离子电荷的绝对值;
R+和R-分别为二元离子化合物的正负离子的离子半径.
∑为连加符号,求和.
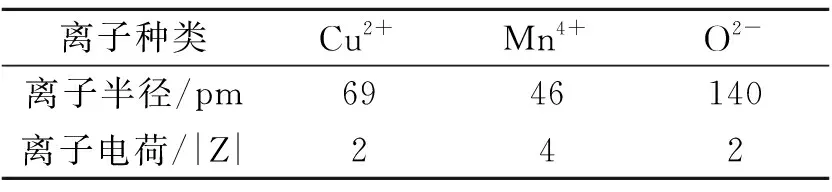
表2 各种离子半径和离子电荷的绝对值
由卡氏公式计算得CuO 、MnO2的晶格能如下:
CuOUCuO=3.842×103kJ·mol-1
MnO2UMnO2=8.43×103kJ·mol-1
在本研究工作中,合成的催化剂经过焙烧后,经分析表观分子式可以表示为:
Cu1.4Mn1.6O4(忽略少量的杂质)
如果把其看作复合的简单的晶体,则平均的晶格能
U=(x1UCuO+x2UMnO2)/(x1+x2)
=103×(1.4×3.842+1.6×8.43)/3
=6.29×103kJ·mol-1
由以上简单的定性计算可知:此复合氧化物的晶格能比单纯CuO的有很大的提高,使其晶体结构比单纯的CuO更加稳定.因为铜离子被限制在较稳定的晶格中,所以催化剂铜离子的流失得到了控制.
2.3.3 pH值对铜组分流失的影响
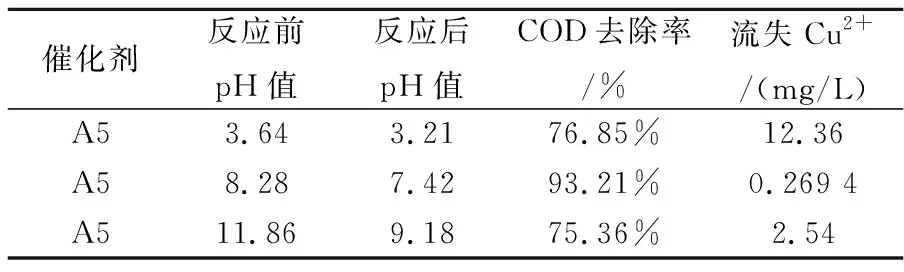
表3 pH对金属离子溶出量的影响
由表3可知,同一种反应物在pH值3.64时,即酸性较强的条件下,催化剂流失严重,达到12.36 mg/L.在pH值8.28时,Cu2+溶出很低,仅有0.269 4 mg/L,因此本研究在弱碱(pH值8.28)条件下进行以避免催化剂流失.
3 结束语
(1)催化剂制备条件为:Cu∶Mn=2∶1,焙烧温度800 ℃,焙烧时间16 h.
(2)制备的Cu/Mn复合氧化物催化剂能有效处理吡虫啉农药废水,在反应温度190 ℃,氧分压1.60 MPa, pH值8.28的条件下, COD去除率为93.12%,该催化剂具有优良的湿式氧化活性.
(3)固溶体Cu1.4Mn1.6O4的形成,大幅度提高了催化剂的活性和稳定性.Cu2+溶出量小于0.3 mg/L,达到国家排放标准.
[1] Shibaeva L.Oxidation of phenol with molecular oxygen in aqueous solution[J].Kinetics and Catalysis,2009,10(5):832.
[2] Imamura S.Wet oxidation of acetic acid catalyzed by Co-Bi complex oxides[J].Ind.Eng.Chem.Prod.Res.Dev.,2008, 21(2):570-575.
[3] Pintar A, Levec J.Catalytic wet oxidation of organics in aqueous solutions[J].Journal of Catalysis,2009,135(1):345-357.
[4] Deepak B. Akolekar, Suresh K. Bhargava, Irfan Shirgoankar. Pollutant removal from paper and pulp industrial waste liquor[J].Applied Catalysis A: General ,2002,14(5):255-262.
[5] Imamura S.Wet oxidation of acetic acid catalyzed by Cu-Al complex oxides[J].Ind.Eng. Chem.Prod.Res.Dev.,2006, 21(2):570-575.
[6] Adrian M.T.Silva,Isabel M.Castelo-Branco.Catalytic studies in wet oxidation of effluents from formaldehyde industry[J].Chemical Engineering Science,2003,58(1):963-970.
[7] Cavani F, Trifiro F, Vaccari A. Wet oxidation of phenol on Ce1-xCuxO2-8catalyst[J].Catalysis Today,2001,11(2):173.
[8] 天津大学无机化学教研室.无机化学上册[M].天津:高等教育出版社,2007:269.
