水溶性甲壳素-丝素复合膜的制备及生物相容性
2012-02-16许小玲孟晓荣
张 敏, 许小玲, 孟晓荣
(1.陕西科技大学 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021; 2.西安建筑科技大学 理学院, 陕西 西安 710055)
0 引言
甲壳素、壳聚糖及其衍生物具有独特的无毒、无害和抗菌性能,其生物相容性好,具有消炎,不过敏、能促进伤口愈合等优异的生物特性[1,2].目前,国内外也已开发了甲壳质类医用敷料、医用缝合纤维、妇婴用纺织品等[3,4],但在实际应用中,壳聚糖纤维也会出现临床好转反应等生物相容性问题,甲壳素、壳聚糖无法完全替代生物机体的组织.丝素(Silk Febrion)是蚕丝脱胶后的部分,是含有18种氨基酸的复合蛋白质,是具有优良生物相容性的天然高分子[5],近年来由于SF出色的生物相容性,引起了人们对蚕丝基础及应用研究的密切关注[6],但是SF在作为医用创伤材料临床使用时柔润性好但强度不足.为了改善SF膜的性能,本文制备了水溶性甲壳素(6-O-GC,DS=1.0)与SF均匀混合制膜,用亲水性的甲壳素衍生物来改善SF的结构特性和力学性能,以求抑制高结晶度的SF固体微观结构的形成和结晶构造的转变,达到稳定结构的SF,使得复合膜有更好地相容性和柔软性.这将为仿生化材料和纤维在医用材料的研究和应用提供了基础实验的优化方法和可靠依据.
1 材料、仪器和实验方法
1.1 材料
甲壳素(Chitin) (DDA=85.7%,MW=27×104,Nihonkayaku公司,日本东京);丝素蛋白(Silk Fibroin);日本农林水产省蚕丝昆虫研究所提供;初代皮肤纤维芽细胞(取自新生儿和二十岁年轻女性);皮肤纤维芽细胞基础培养基(Medium 106SM-106-500S);低血清增值添加剂(LSGS S-003-10);抗菌剂(PSA溶液R-004-10);其他试剂均为分析纯(天津试剂厂),使用前未精制.
1.2 仪器
电子显微镜(SEM),JSM-630IF(Olympus Co., Ltd., Tokyo);原子间力扫描探针显微镜(AFM),NVB100 (Olympus Co., Ltd., Tokyo);傅里叶红外光谱仪(FT-IR),FT-IR 8900 (Jasco Co., Ltd., Tokyo).
1.3 实验方法
1.3.1 丝素蛋白SF水溶液的制备
将蚕茧按文献[7]的方法处理,首先除去丝胶,得到丝素蛋白,并制成2%(w/w)的丝素蛋白水溶液作为制膜溶液.
1.3.2 6-O-羟乙基甲壳素(6-O-GC)水溶液的制备
将壳聚糖按文献[8]的方法,先进行2位乙酰化(取代度DS=1.0),得到再生甲壳素,再在6位进行羟乙基取代,得到可溶于水,收率为82%的6-O-羟乙基化甲壳素(取代度DS=1.0),然后制成2% (w/w)透明的水溶液用于制膜.
1.3.3 6-O-GC/SF复合膜的制备
将浓度均为2%(w/w)的6-O-GC水溶液与SF水溶液分别以80∶20、70∶30、60∶40、50∶50、40∶60、30∶70(v/v)的比例均匀混合,在PFA容器中流延,室温,湿度60%条件下缓慢干燥,得到厚度约为10μm的薄膜.
1.3.4 在6-O-GC/SF复合膜上培养人皮肤纤维芽细胞
选用孔径为100~120μm的6-O-GC/ SF复合膜.在6-O-GC/SF复合膜上培养37 ℃解冻后的成活率为85%(数量100 万)的新生儿初代皮肤纤维芽细胞和年轻妇女初代皮肤纤维芽细胞,以 5×105个/孔接种至复合膜上.培养基用人皮肤纤维芽细胞基础培养基,使用前进行消毒处理,并向其中加入LSGS和PSA溶液.取10 mL带细胞的培养液放入培养皿中,放入37 ℃的培养箱中培养约10天,当细胞形成80%时,脱出并用倒置显微镜观察培养后细胞的生长过程并进行细胞计数.
2 结果与讨论
2.1 6-O-GC/SF复合膜的化学结构表征
使用FT-IR对6-O-GC/SF复合膜的化学结构进行了表征.如图1所示,6-O-GC (7′)在1 658(酰胺I) cm-1、1 560(酰胺II) cm-1有吸收;纯SF在1 658(酰胺I)、1 544(酰胺II)有吸收;然而6-O-GC/SF复合膜(4′-6′)在酰胺I有1 656 cm-1和1 625 cm-1两个吸收峰;酰胺II的吸收由1 544变成1 551 cm-1.
这说明:复合膜中除了6-O-GC的酰胺I 1 656 cm-1的吸收外,SF无规则卷曲α-螺旋构象的在酰胺Ⅰ处特征峰消失,与6-O-GC复合后SF转变成β-折叠构象,得到了1 625 (酰胺Ⅰ) cm-1的吸收峰.另外,复合物中6-O-GC的酰胺II在3 295 cm-1、SF的酰胺II在3 279 cm-1有相应吸收;并且随着6-O-GC添加量的增大,酰胺II的吸收向高场移动,说明了6-O-GC与SF两者之间存在着分子间氢键作用.纯的6-O-GC膜在1 030 cm-1和1 060 cm-1处出现C-O的伸缩振动峰,说明甲壳素6位上成功引入了羟乙基,并且与SF复合后振动峰稍有偏移,峰强度有所减弱,表明6-O-GC与SF之间形成分子之间氢键,使得分子间距减小形成紧密结合,呈现良好的相容性.
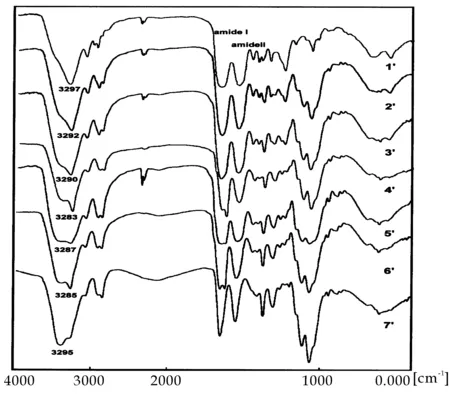
(1′)纯SF (2′)6-O-GC /SF 30/70 (3′)6-O-GC /SF 40/60 (4′)6-O-GC /SF 50/50 (5′)6-O-GC /SF 60/40 (6′)6-O-GC SF 70/30 (7′) 6-O-GC图1 6-O-GC /SF共混膜的红外图
2.2 6-O-GC/SF膜的表面形貌观察
图2所示为6-O-GC与SF复合膜AFM表面形貌观察,表明:图2(a)为纯SF膜的蛋白质呈螺旋立体结构,表面凹凸不平,说明纯SF蛋白质内螺旋结构清晰可见;
图2(b)为纯6-O-GC膜,多糖单分子呈现六元环正反相连的结构,两个分子链形成螺旋结构,图中可以明显看出表面翘曲.由于6-O-GC甲壳素的6位中引入取代度1.0的羟乙基,破坏了甲壳素的分子内氢键,分子之间氢键作用较弱,分散于水中分子之间连接作用减弱,小分子水进入大分子空隙之间,干燥后水份挥发使膜表面不平整;
图2(c)为6-O-GC/ SF 50/50复合膜表面明显比单纯SF膜的蛋白质螺旋立体构造和纯6-O-GC膜要分布均匀、平坦光滑.说明在与SF混合后,SF的结构由无规则卷曲向β-折叠构象转变,两种水溶性高分子链在水中均能够很好地舒展,打开了各自的分子间氢键,打破了分子间的螺旋结构,并通过氢键作用使得两高分子之间形成了有序排列、连接紧密的均一体系.而且,混合前后SF结构构象的转变,浓度较大的SF具有较高的粘度,均有利于与水溶性甲壳素6-O-GC外围成囊,使得共混膜的均匀性、规整性提高.共混膜的拉伸强度和初始拉伸模量均有所改善,并随着6-O-GC含量的增加而有所提高.

(a)纯 SF (b)pure 6-O-GC (c)6-O-GC /SF 50/50(10 μm×10 μm×500 nm)图2 6-O-GC/SF共混膜表面的AFM图像
2.3 人皮肤纤维芽细胞的显微镜观察
如图3可以看出复合膜体外作为新生儿初代纤维芽细胞和20岁年轻妇女初代纤维芽细胞生长的载体,接种后,细胞基本完成了黏附过程,处于增殖过程中,并逐渐完成了在膜表面的黏附行为.图 (a)、(d)(×200倍)中为纤维芽细胞增殖过程,随着时间的延长,细胞在复合膜表面上的黏附数量增多如图(b)、(e)(×200倍),细胞大小较均一,胞浆丰富,胞体透明,表明两种纤维芽细胞生长状态均良好;放大的图(c)、(f)(×400倍)中可以看出细胞在复合膜表面贴附形态良好,单层基本上融合、铺满整个膜面,呈梭形紧密排列,比较接近人皮肤纤维芽细胞的形态.这说明表面结构有序、分布均匀的膜材料利于细胞的黏附、生长、增殖及分化,具有良好的生物相容性.
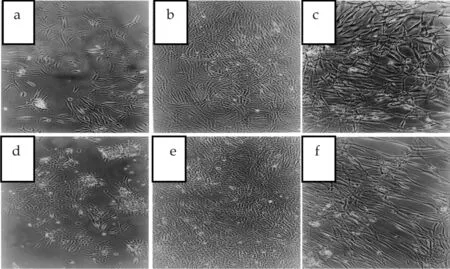
(a)、(b)、(c) 新生儿纤维芽细胞 (d)、(e)、(f) 年轻妇女纤维芽细胞图3 6-O-GC /SF共混膜的细胞培养照片
3 结论
在甲壳素6位引入羟乙基制备了取代度为1的6-O-GC的水溶液,与SF水溶液均匀混合,得到了厚度10μm左右的弹性、柔软度良好的薄膜.亲水性的6-O-GC使SF变得更加柔软、具有一定的延展性.
混合后SF的结构由无规则卷曲向β-折叠构象转变,表明6-O-GC与SF两者之间存在着分子间的氢键作用,高黏度SF利于与6-O-GC形成更好的结合,使膜的均匀性、规整性提高,膜的强度增加.
体外细胞培养实验,可以看出细胞能够较好地生长和增殖,细胞在6-O-GC/SF复合膜上能很好地存活,说明了6-O-GC/SF复合膜具有良好的生物相容性,以及良好的医学应用潜能.
[1] Xiaoxia Li,Xueyong Li,Beilei Ke,et al.Cooperative performance of chitin whisker and rectorite fillers on chitosan films[J].Carbohydrate Polymers,2011,85(4):747-752.
[2] Shigehiro Hirano,Min Zhang,Masuo Nakagawa,et al.Wet spun chitosan-collagen fibers,their chemical N-modifications,and blood compatibility[J].Biomaterials,2000,21(10):997-1 003.
[3] Riccardo A.A,Muzzarelli.Chitosan composites with inorganics,morpho-genetic proteins and stem cells,for bone regeneration[J].Carbohydrate Polymers,2011,83(4):1 433-1 445.
[4] Chengdong Ji, Ali Khademhosseini,Fariba Dehghani.Enhancing cell penetration and proliferation in chitosan hydrogels for tissue engineering applications[J].Biomaterials,2011,32(36):9 719-9 729.
[5] Shigehiro H,Tamayo N, Min Z,et al.Wet spun blend biofibers of cellulose-silk fibroin and cellulose- chitin-silk fibroin[J].Carbohydr Polym,2002,47(2):121-124.
[6] Aya N,Yumi T,Nobuko S,et al.Regeneration of the femoral epicondyle on calcium-binding silk scaffolds developed using transgenic silk fibroin produced by transgenic silkworm[J].Acta Biomaterialia,2011,7(3):1 192-1 201.
[7] Min Zhang,Hiroshi Inui,Atsunobu Haga,et al.Structure of chitin and its derivatives and hydrolysis susceptibility by chitinase[J].Seric.Sci.Jpn,2000,69(2):97-103.
[8] Shigehiro Hirano,Min Zhang,Hideki Yamane,et al.Chemical modification and some aligned composites of chitosan in a filament state[J].Macromol.Biosci,2003,3(10):620-628.
