不对称还原α-氨基苯乙酮菌种的筛选及转化条件优化*
2012-02-13吴洽庆朱敦明
生 措 任 杰 王 敏 吴洽庆** 朱敦明**
(1天津科技大学生物工程学院 天津 300457)
(2中国科学院天津工业生物技术研究所 天津 300308)
Absttrraacctt Optically active amino alcohols are important building blocks for the synthesis of many chiral pharmaceuticals.A straightforward approach to the synthesis of these chiral amino alcohols is the biocatalytic asymmetric reduction of the corresponding prochiral ketones.Two strains were isolated from soil samples by screening using α-aminoacetophenone as the substrate, and named as 1403 and 4802.Strains 1403 and 4802 reduced α-aminoacetophenone to (R)- and (S)-αaminophenethanol with enantiomeric excess (e.e.)of 99% and 70%, and were identif ed asFusariumsp.andGalactomycessp., respectively.The conditions for cultivation and biotransformation were optimized.The optimal cultivation time of both strains were 24 h;the optimized concentrations of substrate and resting cell were 5 g/L and 20 g/L for strain 1403 (Fusariumsp.), 3 g/L and 80 g/L for strain 4802 (Galactomycessp.), respectively.Two strains could also convert α-chloroacetophenone, α-bromoacetophenone, and acetophenone to the corresponding alcohols of (R)- and (S)-configuration.Moreover, when α-hydroxyacetophenone was served as substrate (S)-hydroxyphenylethanol was obtained with e.e.of 99% for both strains.Fig 6, Tab 2, Ref 15
Keywwoorrddss asymmetric reduction;α-aminoacetophenone;α-aminophenylethanol;Fusarium sp.;Galactomycessp.
CLC Q936
手性氨基醇是一类重要的小分子,作为不对称合成的合成砌块广泛用于活性化学分子特别是一些手性药物的合成[1],其中手性的α-氨基苯乙醇及其衍生化合物是合成许多重要药物的关键中间体,常用于心血管药物(β-受体阻滞剂)、神经系统药物(多巴、儿茶酚胺类)及其他药物(米拉贝隆)的合成[2].近年来由于生物催化技术高效专一和绿色节能的特点,酶法不对称合成这类化合物的应用越来越受到重视[3],潜手性芳香酮的生物催化还原是生产手性芳香醇的重要途径之一.但是合成α-氨基苯乙醇大多数方法都是以其他基团取代的苯乙酮为底物,经生物催化还原羰基后,再经过化学法合成得到α-氨基苯乙醇类化合物.例如:1)还原迭氮苯乙酮后经还原取代水解[4];2)还原羰基羧酸酯,后经两步反应合成[5];3)还原卤代酮后经亲核取代[6];4)首先得到腈醇,再经腈基还原得到[7,8].而直接还原α-氨基苯乙酮得到手性α-氨基苯乙醇的报道比较少见,国内在2001年曾有过相关研究报道[9],但其底物浓度仅有1g/L.
鉴于手性α-氨基醇在不对称药物合成中的重要作用,我们在构建羰基还原酶制剂库的过程中,开展了以α-氨基苯乙酮为底物进行微生物羰基还原酶筛选的工作,获得了2株能将α-氨基苯乙酮还原成相应手性醇的微生物,进而进行转化条件优化,以期为后续的分子生物学研究和酶分子的结构改造奠定基础.
1 材料与方法
1.1 材 料
1.1.1 样品采集 土壤样品取自天津杨柳青果园和江苏前成生物有限公司厂区.采集土样装入无菌袋中置于4 ℃保存,用于目标菌的分离纯化.
1.1.2 仪器与试剂 隔水式恒温培养箱(上海一恒,GHP-9270);恒温培养振荡器(上海智城,ZHWY-200D);超净工作台(苏净安泰,SW-CJ-1FD);1260型高效液相色谱仪(HPLC)为Agilent Technologies,手性分离柱Crownpak CR[+]和OD-H均为DAICEL公司产品.蛋白胨、酵母粉为美国BD公司产品,消旋α-氨基苯乙醇为TCI公司产品,α-氨基苯乙酮、苯乙酮、α-氯代苯乙酮、α-溴代苯乙酮、α-羟基苯乙酮、S型氨基苯乙醇和S型羟基苯乙醇为Alfa公司产品,其它试剂为国产分析纯,HPLC所用流动相为色谱纯.
1.2 方 法
1.2.1 目标菌的富集和分离 将5 g土壤放入含有50 mL无菌水的250 mL摇瓶中,加入玻璃珠,250 r/min条件下摇床振荡2 h,静置至土壤颗粒沉淀后取2 mL上清接种于含100 mL营养盐培养基1的500 mL摇瓶中.于30 ℃培养至菌液浑浊后(约2 d),加入甘油至终浓度15%保存,用于以后的实验.将富集的菌液取200 μL加入含20 mL营养盐培养基2的100 mL三角瓶中,同时加入α-氨基苯乙酮盐酸盐至终浓度为3 g/L,在30℃、200 r/min条件下摇床振荡培养至菌液浑浊(约3 d),再取200 μL加入含20 mL营养盐培养基3的100 mL三角瓶中,同时加入α-氨基苯乙酮盐酸盐至终浓度为5 g/L,继续培养3 d,取菌液100 μL采用稀释涂平板法进行菌种分离(10-1~10-7倍稀释涂平板),培养箱中30 ℃培养3~6 d,挑取不同形态菌落在实验培养基平板划线培养至得到单菌落.纯化的菌落接种于实验培养基斜面保存.
1.2.2 转化产物的提取及分析 分离得到的菌株从斜面挑取少量接种至20 mL实验培养基中,30 ℃、200r/min条件下培养至菌液浑浊,再加入终浓度为3 g/L的α-氨基苯乙酮盐酸盐作为底物,隔12 h取样分析转化情况,取样量为800 μL.用饱和碳酸钠溶液将样品调至碱性(pH = 10),再加入等体积乙酸乙酯,涡旋仪混匀后于12000 r/min离心1min.取上层有机相用薄层色谱层析(TLC)进行初步检测.展开剂为乙酸乙酯 :异丙醇 :氨水= 1:1:0.1,在254 nm的紫外灯下观察.吹干展开剂,将层析板置于1%茚三酮乙醇溶液中数秒后,使其受热至有样品显色(底物显黄色,Rf= 0.7;产物显粉紫色,Rf= 0.4).有产物点出现的样品取500 μL有机相,充分挥发,等体积HPLC流动相(pH = 2.0的HClO4水溶液)溶解,选用Crownpak CR[+]手性柱检测e.e.值[10],pH = 2.0的HClO4水溶液为流动相,流速为0.5 mL/min,柱温为30 ℃,检测波长为220 nm.根据e.e.值、转化率和底物谱收集相应菌种.
1.2.3 对不同α位取代苯乙酮底物的生物转化 在1.2.2的研究结果基础上,将10株转化产物e.e.值高的菌株接种于5 mL发酵培养基的20 mL摇瓶中,30 ℃、200 r/min培养24 h后,分别加入α位取代苯乙酮:α-氯代苯乙酮、α-溴代苯乙酮、α-羟基苯乙酮以及苯乙酮.底物浓度为1g/L,在30℃、200 r/min条件下振荡反应.转化48 h后等体积乙酸乙酯全部萃取,分出有机相,充分挥发后加入1mL HPLC流动相(异丙醇 :正己烷= 10 :90)溶解,选用OD-H手性柱检测e.e.值,流速为0.8 mL/min,柱温为30 ℃,检测波长为220 nm.
1.2.4 形态初步观察及分子生物学鉴定 根据1.2.2和1.2.3的研究结果,对筛选出的菌株在实验培养基固体平板上30 ℃恒温培养箱中培养2~8 d,并进行形态学初步观察.分子生物学鉴定采用ITS-5.8S rDNA[11]序列分析方法.目标菌与石英砂混合后液氮研磨,根据Biospin真菌基因组DNA提取试剂盒操作步骤提取.以ITS1和ITS4为引物[12],对菌株的ITS-5.8S rDNA进行PCR扩增.PCR扩增产物用TIANGEN试剂盒回收,与pGEM-T载体进行连接,转化.验证载体已成功连接到目的片段后由北京天一辉远生物科技有限公司完成测序.获得序列信息应用Blast程序与GenBank核算数据库中序列比对.
1.2.5 筛选菌株的生长曲线测定 将菌种接种于20 mL实验培养基中30 ℃、200 r/min条件下摇床振荡培养24 h后,作为种子液接种于20 mL实验培养基中培养(接种比例为1%)继续培养,前18 h每隔2 h取样,18 h后每隔3 h取样,每个取样点为3个平行样.收集培养菌体并烘干至恒重记录菌体干重,以培养时间和菌重作图[13~14],获得生长曲线.
1.2.6 菌体转化底物条件优化 实验菌种按1%接种比例,接种于适量体积的实验培养基中,30 ℃、200 r/min条件下摇床振荡培养24 h后(稳定期),离心收集菌体,并用50 mmol/L磷酸钾缓冲液(pH = 7.0)洗涤两次.分别设定5 mL 50 mmol/L磷酸盐缓冲液(pH=7)反应体系:15 g/L 葡萄糖,3 g/L底物浓度,菌体浓度(干重,dry weight,DW)分别取20 g/L、40 g/L、60 g/L、80 g/L和100 g/L,在反应6 h、12 h、18 h、24 h、30 h、36 h、42 h和48 h时分别取样.不同底物浓度和反应时间设3个平行试验,30 ℃、200 r/min条件下摇床振荡反应,在设定时间点停止试验,并按1.2.2所述样品处理进行TLC检测底物转化.为优化[15]最佳的底物转化浓度,分别取1g/L、2 g/L 、3 g/L、4 g/L 、5 g/L 、8 g/L 和10 g/L的底物浓度进行试验.反应条件为30℃、200 r/min摇床振荡反应,采用同1.2.2的TLC方法检测底物转化.
2 结果与讨论
2.1 目标菌株的筛选和分离
通过富集分离,从土样中获得52株纯化菌株,TLC检测48株有活性.剔除形态相似菌株,对剩余19株菌的转化产物进行HPLC分析,结果如表1,菌株4802、2305和1201的转化产物为S型,其中菌株4802的e.e.值最高,为70%,因此选定菌株4802用于进一步研究.测试的其他菌株的产物构型主要为R型,选取转化产物e.e.值较高(不低于99%)的9株菌(菌株编号分别为0401、0706、0101、1002、1004、1403、1503、1708、和2904)用于进一步研究.用所选定的10株菌对不同α-取代苯乙酮底物进行生物催化研究,只有菌种编号为4802和1403的两株菌能转化所测试的全部底物(表2).因此选定菌株编号为4802和1403的2株菌种作为研究菌株.

表1 19株菌转化α-氨基苯乙酮的产物e.e.值及转化时间Table 1 Products’e.e.value and conversion time of all 19 strains
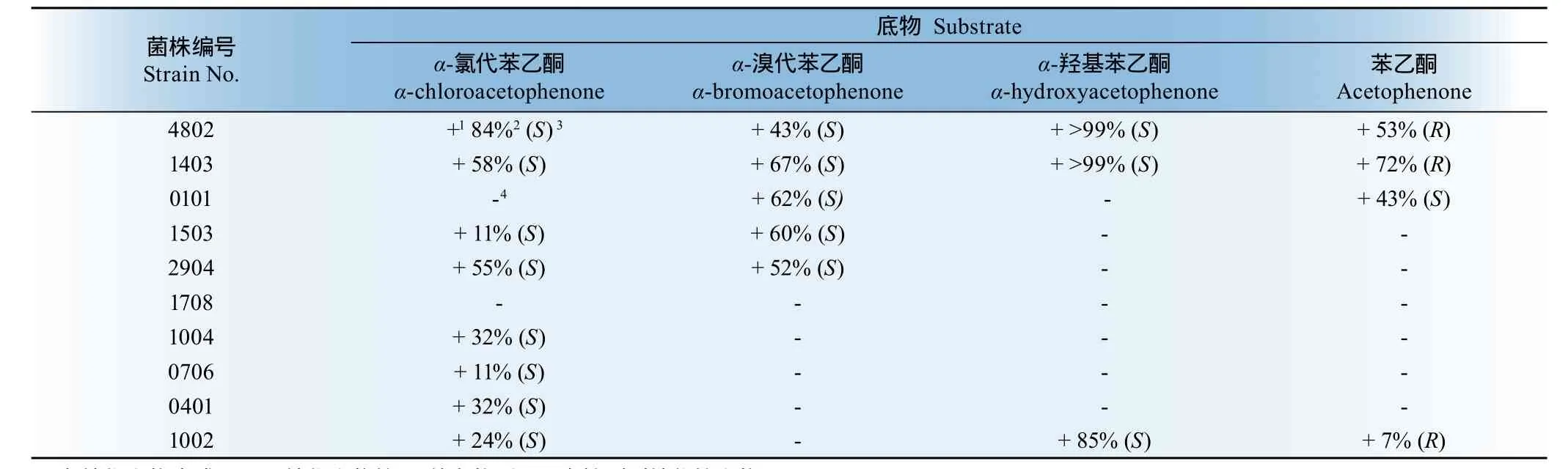
表2 e.e.值较高的10株菌对不同α-取代苯乙酮转化的结果Table 2 Conversion of different α-substituted acetophenone by the selected strains with higher e.e.
菌株4802和1403均可以催化以α-氯代苯乙酮、α-溴代苯乙酮、α-羟基苯乙酮和苯乙酮为底物的还原反应,且对α-羟基苯乙酮的立体选择性很高.在实验中所用的相应手性分离柱及分离条件下,消旋体都能得到很好的分离,R型先出峰,S型后出峰.菌株4802催化还原α-氨基苯乙酮和α-羟基苯乙酮的产物均为S构型;然而有趣的是,菌株1403催化还原α-氨基苯乙酮产物为S构型,而催化α-羟基苯乙酮的的产物为R构型,在底物与酶蛋白质作用的关系中,往往氨基和羟基的空间大小及电子效应会比较类似,均可和氨基酸残基发生氢键作用,一般得到的产物构型应该一致,而菌株1403却表现出了不同构型的催化活性,这一现象值得通过分子操作及蛋白晶体分析进行更加深入的研究.HPLC分析图谱分别见图1和图2.1、2为4802菌落的正反面,3、4为1403菌落正反面 1, 2 for face and back of strain 4802;3, 4 for face and back of strain
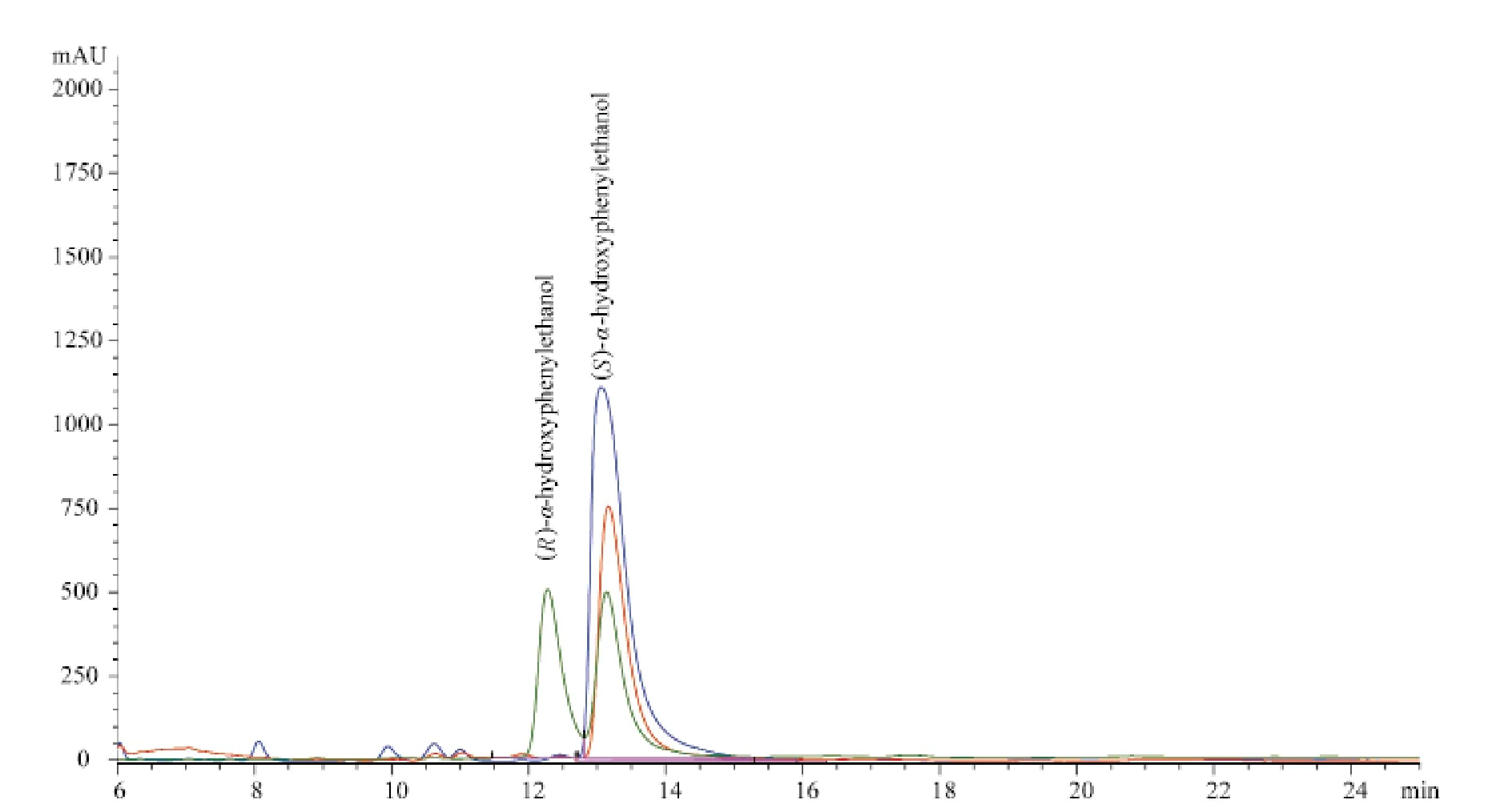
图1 菌株4802和1403转化α-羟基苯乙酮的产物HPLC谱图Fig.1 HPLC spectrum of products of α-hydroxyacetophenone converted by strains 4802 and 1403

图2 菌株4802和1403转化α-氨基苯乙酮的产物HPLC谱图Fig.2 HPLC spectrum of products of α-aminoacetophenone converted by strains 4802 and 1403

图3 菌种4802和1403的菌落形态Fig.3 The morphology of strains 4802 and 1403
2.2 菌株鉴定
初步形态观察(图3)判断两株菌为真菌.菌株4802的菌落为圆形,正面为白色,反面为黄色,有同心环状,边缘整齐向四周呈放射状扩散,菌丝质地厚密且平铺于表面.培养48 h后,菌落直径约为1.5 cm,72 h后菌落直径约为2 cm,144 h后直径约为4 cm.菌株1403的菌落为圆形,正面圆心处发浅黄色,离中心位置半径2 mm有紫色的圆,与菌丝边缘呈同心环状,边缘整齐向四周扩散.菌丝在半径7 mm以内,紧密厚实,7 mm以外菌丝疏松.培养48 h,菌落直径约为2 cm.
将测得的ITS-5.8S rDNA序列在GenBank数据库中进行BLAST.结果显示,菌株4802与Galactomyces geotrium多株菌序列相似性为99%,菌株1403与Fusarium oxysporum多株菌相似性达100%,从而确定这两株菌分别属于地霉属和镰刀菌属.
2.3 筛选菌的生长特性
4802和1403菌株在实验培养基生长为典型的丝状真菌生长曲线(图4).分为停滞期、迅速生长期及衰退期.在24 h,两株菌都到了稳定期.
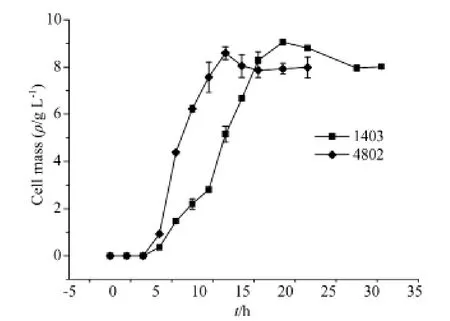
图4 菌株1403和4802生长曲线Fig.4 The growth curve of strains 1403 and 4802
2.4 转化条件优化
2.4.1 菌体浓度 反应以α-氨基苯乙酮作为底物(终浓度为3 g/L)、反应体系中含有15 g/L葡萄糖,5 mL磷酸钠缓冲液(pH 7.0,50 mmol/L),以及不同量的菌体,用TLC定性检测底物的消耗和产物的生成.菌株4802在不同菌体浓度下,转化6 h后,都能检测到有产物;转化24 h后检测结果显示,菌体浓度为80 g/L(DW)时,产物含量较高(图5-1).菌株1403在不同菌体浓度下,转化24 h后检测结果显示,菌体浓度为20 g/L(DW)时,产物含量较高,当菌体浓度高于20 g/L反而产物含量明显偏低(图5-2).具体原因有待进一步的研究.
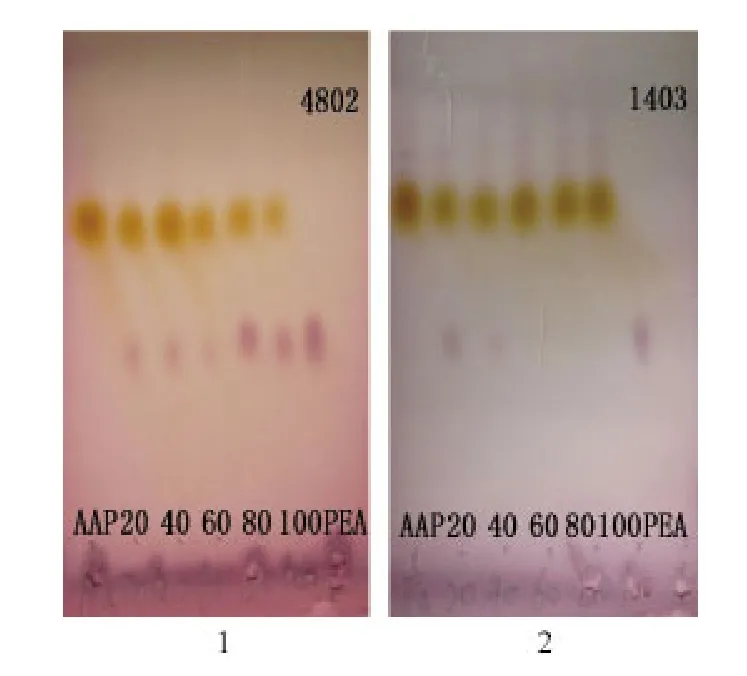
图5 菌株4802和1403在不同菌体浓度(g/L,DW)下转化反应的TLC图Fig.5 TLC of all products converted by different biomass concentration (g/L, DW)of strains 4802 and 1403
2.4.2 底物浓度 当菌株4802和1403的菌体浓度分别为80 g/L和20 g/L时,在其他条件不变的情况下,加入不同底物浓度进行反应,结果如图6所示.菌株4802和1403的最高可以承受的底物浓度分别为3 g/L(图6-1和图6-2)和5 g/L(图6-3和图6-4),表现出了较好的底物耐受性.在实验过程中观察到随着底物浓度的增加,产物量降低.可能原因为:1)一定浓度的菌体内催化底物还原的酶量是一定的,当底物浓度较低时,产物的合成量随底物浓度的提高而增加,当底物浓度达到一定值时,菌体的催化能力达到饱和,此外也可能存在酶的底物抑制作用;2)随着底物浓度升高,转化实验中的静息
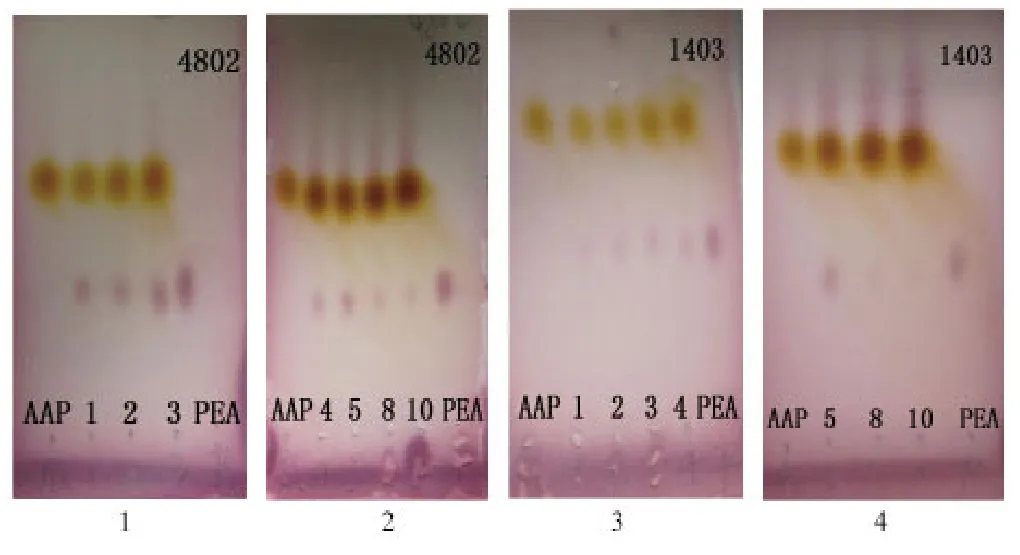
图6 菌株4802和1403在不同底物浓度(g/L)下转化反应的TLC图Fig.6 TLC of all products converted by strains 4802 and 1403 using different substrate concentration (g/L)
3 结 论
考虑到α-氨基苯乙酮对菌体有一定毒性,本文采用逐步降低培养基中葡萄糖浓度、增加底物浓度的方法,使菌体逐步适应底物,最终以α-氨基苯乙酮为唯一碳源获得纯化菌株,并结合转化产物的立体构型选定了目标菌株.
筛选得到了两株可催化α-氨基苯乙酮不对称还原分别生成R型和S型醇的微生物菌株.菌株4802为地霉属,催化还原α-氨基苯乙酮得到S构型的α-氨基苯乙醇,e.e.值为70%;最适生长时间为24 h,在80 g/L的菌体浓度下,可以耐受达3 g/L底物浓度.菌株1403为镰刀菌属,催化还原α-氨基苯乙酮得到R构型的α-氨基苯乙醇,e.e.值大于99%;最适生长时间为24 h,在20 g/L的菌体浓度下,可以耐受达5 g/L底物浓度,并且当以α-羟基苯乙酮底物时,菌株1403可以催化得到S构型的α-羟基苯乙醇,e.e.值可达99%.
本研究获得的菌种可为进一步克隆获得α-氨基苯乙酮羰基还原酶基因及对其进行分子操作提高该酶的产物立体选择性并研究其构效关系打下基础,相关基因克隆工作正在进行中.
Refereenncceess
1 Thomas XM, Domingo GP, Janine C.Highly enantioselective synthesis of β-Amino alcohols:A catalytic version.J Org Chem,2007, 72 (17):6556~6561
2 Ariens EJ.A basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology.Eur J Clin Pharmacol, 1984, 26:663~668
3 Santaniello E, Ferraboschi P, Grisenti P, Manzocchi A.The biocatalytic approach to the preparation of enantiomerically pure chiral building blocks.Chem Rev, 1992, 92 (5):1071~1140
4 Procopiou PA, Morton GE, Todd M, Webb G.Enantioselective synthesis of (S)-salmeterol via asymmetric reduction of azidoketoneby Pichia angusta.Tetrahedron:Asymmetry,2001, 12:2005~2008
5 Gu JX, Li ZY, Lin GQ.Reductive biotransformation of carbonyl compounds-application of fungus,Geotrichumsp.G38 in organicsynthesis.Tetrahedron,1993, 49 (26):5805~5816
6 Kamal A, Sandbhor M, Shaik AA.Chemoenzymatic synthesis of (S)and (R)-propranolol and sotalol employing one-pot lipase resolution protocol.Bioorg & Med Chem Lett,2004, 14:4581~4583
7 Effenberger F, Jager J.Synthesis of the adrenergic bronchodilators (R)-terbutaline and (R)-salbutamol from (R)-cyanohydrins.J Org Chem,1997, 62:3867~3873
8 Caira MR, Hunter R, Nassimbeni LR, Stevens AT.Resolution of albuterol acetonide.Tetrahedron:Asymmetry,1999, 10:2175~2189
9 Wang JL (王佳亮), Wang JJ (王建军), Yang L (杨柳), Wu J (吴襟), Sun WR (孙万懦).Isolation and fermentation conditions of strains producing 1-phenyl-2-amino-ethanol alcohol dehydrogenase.Acta Microbiol Sin(微生物学报), 2001, 41(5):635~641
10 Keiko YO, Yuhki T, Yoshiki T.Purification and characterization of 2-aminoacetophenone reductase of newly isolatedBurkholderia sp.YT.J Biosci Bioeng,2007, 104:416~419
11Yao MY (姚梦吟), Liu XF (刘晓风), YuanYX (袁月祥), Yan ZY (闫志英), Liao YZ (廖银章), He RN (贺蓉娜).Isolation of a fungus with selective delignification and its degradation of corn stalk.Chin J Appl Eviron Biol(应用与环境生物学报), 2009, 15 (3):427~431
12 White TJ, Bruns T, Lee S, Taylor J.Amplif cation and direct sequencing of fungal ribosomal RNA genes for phylogenetics.In:Innis MA, Gelfand DH, Sninsky JJ, White TJ, Diego S eds.PCR Protocols - A Guide to Methods and Applications.New York, USA:Academic, 1990.315~322
13 Kaliaperumal T, Kumar S, Gummadi SN, Chadha A.Asymmetric synthesis of (S)-ethyl-4-chloro-3-hydroxybutanoate usingCandidia parapsilosis ATCC 7330.J Ind Microbiol Biotechnol, 2010, 37:159~165
14 Soni P, Banerjee UC.Biotransformations for the production of the chiral drug (S)-Duloxetine catalyzed by a novel isolate of Candida tropicalis.Appl Microbiol Biotechnol,2005, 67:771~777
15 Sun FH (孙丰慧), Li AM (李安明).Screening of an alkali-tolerant xylanase producing strain and its optimization of enzyme production.Chin J Appl Eviron Biol(应用与环境生物学报), 2008, 14 (3):436~439
