miR-96在人乳腺癌中表达及其对乳腺癌细胞侵袭和迁移活性的影响
2012-02-10吴正升
吴正升,吴 强
(安徽医科大学病理学教研室,安徽合肥 230032)
近年来,虽然乳腺癌的诊疗技术和手段有了一定的发展,但是乳腺癌的侵袭性生长和转移仍是导致患者死亡的重要原因之一。研究发现微小RNA (miRNA)可通过调控靶基因的表达,在乳腺上皮细胞增殖、凋亡、迁移、侵袭和转移等过程中发挥重要作用[1-3]。本课题组前期通过miRNA芯片筛查了不同侵袭活性的人乳腺上皮细胞;通过比较其miRNA表达谱,发现多种差异性表达的miRNA,提示这些miRNA可能参与了细胞侵袭活性的调控[4-5]。miR-96是其中具有显著差异性表达的miRNA之一。为此,本研究通过实时定量PCR验证miRNA芯片中miR-96的表达结果;并以乳腺癌细胞株MCF-7为模型,通过miRNA抑制物转染技术,分析下调miR-96表达对乳腺癌细胞增殖、侵袭和迁移活性的影响。
1 材料与方法
1.1 材料 人乳腺上皮细胞系HBL-100、人乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-468均购自美国典藏细胞库(ATCC);收集安徽医科大学第一附属医院2009年7月至2010年6月间乳腺病例28例,其中乳腺癌17例,乳腺良性病变[纤维腺瘤和(或)腺病]11例,患者均为女性,所有患者术前未做化疗、免疫或放射等抗肿瘤治疗。所有新鲜组织切除后快速置于液氮速冻后储存于-70℃。
1.2 试剂 RPMI 1640培养基、L15培养基和DMEM高糖培养基购自美国Corning公司;胎牛血清购自美国Hyclone公司;脂质体转染试剂购自美国Invitrogen公司;miRNA提取试剂盒和miR-96荧光定量PCR检测试剂盒均购自美国Ambion公司; miR-96抑制物和阴性对照购自上海吉玛制药技术有限公司;MTS细胞增殖检测试剂盒购自美国Promega;侵袭小室购自美国Corning公司;基质胶购自美国BD公司。
1.3 方法
1.3.1 细胞培养、细胞株和新鲜组织中miR-96表达的检测 HBL-100细胞培养于DMEM培养基中,MCF-7细胞培养于RPMI 1640培养基中、MDA-MB-231和MDA-MB-468培养于L15培养基中,均添加体积分数为10%胎牛血清。10 cm细胞培养皿隔日传代扩增HBL-100、MCF-7、MDA-MB-231和MDAMB-468细胞,待细胞状态良好,近90%融合时,以预冷PBS冲洗3次终止培养,冰上用刮棒刮取细胞、移入离心管,4℃、8 000 r·min-1离心10 min,去上清,收集细胞,备用;取乳腺新鲜组织100 mg,置于液氮预冷处理的研钵中,固化、研碎,备用。按照miRNA提取试剂盒说明,分别抽提4株细胞系和乳腺新鲜组织中总miRNA。按照Ambion公司的mir-VanaTMqRT-PCR miRNA检测试剂盒说明,首先对各个细胞系和新鲜组织总miRNA进行逆转录,然后在实时定量PCR仪上进行PCR扩增,使用U6作为内参。
1.3.2 miR-96抑制物(ASO)的转染 将乳腺癌细胞MCF-7细胞接种后24 h,待贴壁细胞达到30%~50%时进行转染,参照脂质体转染试剂说明书分别转染miR-96 ASO和阴性对照(NC)。
1.3.3 细胞增殖活性的检测 取转染36 h后分别miR-96 ASO组和NC组MCF-7细胞,按照MTS细胞增殖检测试剂盒说明,分别于接种96孔板后24、48、72和96 h各检测1次。每组设6个复孔。实验重复3次。
1.3.4 细胞侵袭和迁移活性的检测 取转染48 h后miR-96 ASO组和NC组MCF-7细胞,在Transwell小室接种细胞前1 d,在小室底部膜的上室面铺基质胶(迁移实验不加基质胶),按照Transwell小室说明,将侵袭小室下室加入含10%FBS RPMI 1640培养基,将侵袭小室上室加入各组细胞悬液。将侵袭小室置于37℃5%CO2培养箱培养24~48 h,倒置显微镜下观察侵袭小室下室,待少量细胞穿出后中止实验。用棉签擦去基质胶和上室内细胞,4%多聚甲醛固定,0.25%考马斯亮蓝染色。正置显微镜下进行观察拍照,采用5个视野进行细胞计数,取平均值进行统计学分析。
2 结果
2.1 乳腺上皮细胞系和临床乳腺病变组织中miR-96表达 本课题组前期使用miRNA芯片检测了4种人乳腺细胞系HBL-100、MCF-7、MDA-MB-231和MDA-MB-468的miRNA表达谱,结果显示高侵袭细胞系MDA-MB-231和MDA-MB-468中miR-96表达较低侵袭HBL-100和MCF-7细胞明显下调(Fig 1)。为了验证芯片的结果,本研究中首先使用实时荧光定量PCR方法检测了这4株细胞miR-96表达。如Fig 1所示,实时荧光定量PCR结果与芯片结果一致,即MDA-MB-231和MDA-MB-468中miR-96表达均较HBL-100和MCF-7细胞明显下调(P<0.01)。进一步,如Fig 2所示:在临床乳腺病变样本中,17例新鲜乳腺癌组织miR-96表达也较11例乳腺良性病变组织明显下调(P<0.01)。

Fig 1 Relative expression of miR-96 in breast cell lines
2.2 miR-96对乳腺癌细胞MCF-7增殖活性的影响 将MCF-7细胞分别转染miR-96 ASO和NC,使用MTS法检测这两组细胞在不同时间点的增殖活性,结果发现miR-96 ASO组与NC组相比,各个时间点细胞的增殖活性差异均无统计学意义(均P>0.05)。
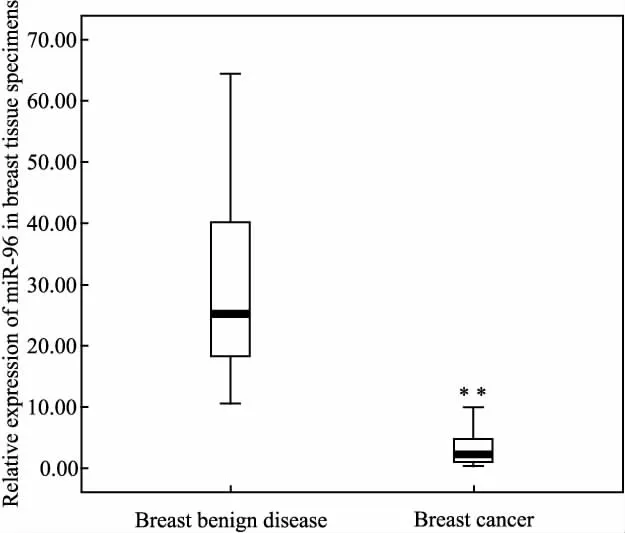
Fig 2 Relative expression of miR-96 in breast tissue specimens of breast benign disease and breast cancer
2.3 miR-96对乳腺癌细胞MCF-7侵袭和迁移活性的影响 使用 Transwell小室检测分别转染了miR-96 ASO和NC的MCF-7细胞的侵袭和迁移活性。如Fig 3所示,通过转染miR-96ASO下调MCF-7细胞内源性miR-96表达后,乳腺癌MCF-7细胞穿过基质胶的侵袭能力,以及迁移至小室膜的能力(未加入基质胶的迁移实验)均较对照组明显提高(P<0.01)。
3 讨论
miRNA一类长约18~22 nt的单链非编码RNA,它具有多种调控基因表达的功能。研究表明,miRNA广泛存在于真核生物中,在细胞发育、分化、增殖、凋亡、代谢以及肿瘤发生发展和转移等过程中起重要作用。研究发现[2-3,6],miRNA在多种常见恶性肿瘤中呈异常表达,并且其表达与肿瘤侵袭转移等特性相关[7-9]。乳腺癌miR-335表达与患者无转移生存期呈正相关,提示其在乳腺癌中可能起到抑癌基因的作用[10];而miR-10b在转移性乳腺癌细胞中高表达,并且与肿瘤的侵袭和转移呈正相关,提示其可能起到癌基因的作用[11]。
为了探讨miRNA参与乳腺癌发生发展的分子机制,本研究前期通过miRNA芯片技术检测不同侵袭特性的人乳腺细胞株,筛选出大量差异性表达的miRNA,提示这些miRNA可能参与了乳腺癌侵袭过程[4-5]。前期miRNA芯片的研究结果表明,高侵袭性MDA-MB-231和MDA-MB-468细胞的miR-96表达量较低侵袭HBL-100和MCF-7细胞明显下调。为了验证芯片中miR-96表达的结果,本研究通过实时荧光定量PCR技术再次检测了这4种乳腺细胞株的miR-96表达状况,结果与miRNA芯片一致。进一步,本研究在临床乳腺新鲜病变组织中检测了miR-96的表达水平,结果显示乳腺癌组织中miR-96也明显下调,表明miR-96的表达下调可能与乳腺癌有关。但miR-96在乳腺癌发病过程中的具体作用及其对乳腺癌细胞生物学行为的影响,目前尚未清楚。为此,本研究使用化学合成的miR-96抑制物转染乳腺癌细胞,下调细胞的 miR-196表达,观察miR-96抑制物对细胞增殖、侵袭和迁移活性的影响。结果发现miR-96的下调对细胞增殖无明显影响,却可显著提高乳腺癌细胞的侵袭和迁移活性。

Fig 3 Effect of miR-96 on MCF-7 cell behaviors of migration and invasion
目前关于miR-96在肿瘤中的作用尚存在一定的争议。Yu等[12]发现miR-96能够明显抑制胰腺癌细胞的迁移和侵袭,并且miR-96通过调控其靶基因KRAS表达可能发挥抑癌基因的作用,本研究结果也与其大致相符。Chen等[13]的研究结果表明,miR-96在高转移性肝癌HCCLM6中呈高表达,而下调miR-96的表达能够明显抑制HCCLM6细胞的侵袭和迁移;Lin等[14]研究发现MCF-7等9株乳腺癌细胞miR-96表达较1株乳腺正常上皮细胞NBEC明显增高,同时15例临床乳腺癌肿瘤组织miR-96较对应癌旁组织增高,并且miR-96具有促进乳腺癌细胞增殖的作用,提示miR-96可能具有癌基因的作用。因此,miR-96的作用比较复杂,可能通过多种的靶基因在不同肿瘤、不同病变阶段中发挥不同的功能。
综上所述,miR-96在人乳腺癌细胞株和乳腺病变组织中存在表达失调,并对人乳腺癌细胞的侵袭及迁移能力可能存在一定负性调控作用。
[1] Baranwal S,Alahari S K.miRNA control of tumor cell invasion and metastasis[J].Int J Cancer,2010,126(6):1283-90.
[2] Bartel D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-33.
[3] Bartels C L,Tsongalis G J.MicroRNAs:novel biomarkers for human cancer[J].Clin Chem,2009,55(4):623-31.
[4] Wu Z S,Wu Q,Wang C Q,et al.MiR-339-5p inhibits breast cancer cell migration and invasion in vitro and may be a potential biomarker for breast cancer prognosis[J].BMC Cancer,2010,10:542.
[5] Wu Z S,Wu Q,Wang C Q,et al.miR-340 inhibition of breast cancer cell migration and invasion through targeting of oncoprotein c-Met[J].Cancer,2011,117(13):2842-52.
[6] Esquela-Kerscher A,Slack F J.Oncomirs-microRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(4):259-69.
[7] Garzon R,Calin G A,Croce C M.MicroRNAs in cancer[J].Annu Rev Med,2009,60:167-79.
[8] Iorio M V,Croce C M.MicroRNAs in cancer:small molecules with a huge impact[J].J Clin Oncol,2009,27(34):5848-56.
[9] Zhang H,Li Y,Lai M.The microRNA network and tumor metastasis[J].Oncogene,2010,29(7):937-48.
[10]Tavazoie S F,Alarcon C,Oskarsson T,et al.Endogenous human microRNAs that suppress breast cancer metastasis[J].Nature,2008,451(7175):147-52.
[11]Ma L,Teruya-Feldstein J,Weinberg R A.Tumour invasion and metastasis initiated by microRNA-10b in breast cancer[J].Nature,2007,449(7163):682-8.
[12]Yu S,Lu Z,Liu C,et al.miRNA-96 suppresses KRAS and functions as a tumor suppressor gene in pancreatic cancer[J].Cancer Res,2010,70(14):6015-25.
[13]Chen R X,Xia Y H,Xue T C,et al.Suppression of microRNA-96 expression inhibits the invasion of hepatocellular carcinoma cells[J].Mol Med Report,2012,5(3):800-4.
[14]Lin H,Dai T,Xiong H,et al.Unregulated miR-96 induces cell proliferation in human breast cancer by downregulating transcriptional factor FOXO3a[J].PLoS One,2010,5(12):e15797.
