山羊SREBP-1基因的超表达对脂肪酸代谢相关基因表达的影响
2012-02-09许会芬罗军李芳余康石恒波李君林先滋朱江江
许会芬,罗军,李芳,余康,石恒波,李君,林先滋,朱江江
西北农林科技大学动物科技学院 陕西省农业分子生物学重点实验室,陕西 杨凌 712100
固醇调节元件结合蛋白 (Sterol regulatory element binding protein,SREBPs) 是体内重要的核转录因子,属于 bHLH-Zip (Basic helixloop-helix leucine zipper) 核转录因子超家族的一员,与体内胆固醇及脂肪生成基因的调节密切相关[1-2]。研究发现,SREBPs可以直接激活胆固醇、脂肪酸、甘油三酯及磷脂生物合成及摄取过程中 30多个基因及还原型辅酶Ⅱ (NADPH) 的表达[2-4]。乳腺作为哺乳动物的特有器官,是机体脂质合成的3个主要部位 (脂肪、肝脏及乳腺)之一[5]。与肝脏、脂肪不同的是,乳腺具有较强的泌乳功能,可以使外源基因在乳腺中表达后随乳汁排出体外[6],是研究基因功能的良好材料。研究表明,SREBP-1基因对哺乳动物乳腺脂肪酸代谢过程发挥重要调控作用。在小鼠泌乳期内,SREBP-1基因的表达量是干奶期的3~4倍,其靶基因的表达量也有不同程度的上调,在泌乳高峰期达到最高[7]。并且随着泌乳高峰期的到来,乳中短中链脂肪酸 (C6∶0−C14∶0) 的比例也随之增大。山羊奶中短中链脂肪酸含量高,具有较高的营养价值,而关于羊奶脂肪酸代谢相关基因功能的研究较少,因此SREBP-1基因的超表达研究有助于揭示该基因的功能。
本研究通过构建 SREBP-1基因的重组腺病毒超表达载体,转染HEK 293细胞包装扩增出高滴度的腺病毒,并感染乳腺上皮细胞,研究该基因超表达后对脂肪酸代谢相关基因的影响,为SREBP-1基因的功能研究及奶山羊脂肪酸代谢调控基因网络构建等提供实验依据。
1 材料与方法
1.1 材料
腺病毒穿梭载体 pAdTrack-CMV及骨架载体 pAdEasy-1均由清华大学常智杰教授惠赠;Primescript®RT Reagent Kit、SYBR®Premix Ex TaqTMⅡ试剂盒、LA Taq DNA聚合酶、dNTPs (10 mmol/L)、pMD19-T载体、SalⅠ内切酶均购自于TaKaRa (大连宝生物工程有限公司);限制性内切酶PemⅠ、PacⅠ及NotⅠ均购自NEB公司;T4 DNA连接酶购自Promega公司;B型小量质粒快速提取试剂盒购自北京博大泰克公司;Escherichia coli Top10、MarkerⅢ、高纯度质粒小提中量试剂盒购自北京天根公司;PCR引物由西安沃尔森生物技术有限公司合成;琼脂糖凝胶DNA回收试剂盒购自北京百泰克生物技术有限公司;FuGENE HD Transfection Reagent购自罗氏 (Roche) 公司;细胞培养板和培养瓶购自NUNC公司 (丹麦);DMEM/F-12培养基购自Gibco公司;1640培养基及标准胎牛血清购自Hyclone公司。CFX96型实时定量PCR仪购自美国伯乐公司。
1.2 方法
1.2.1 SREBP-1基因的克隆
根据西农萨能羊 SREBP-1基因的序列(GenBank Accession No. JN790254) 设计特异性引物,并在上游和下游分别添加SalⅠ及NotⅠ酶切位点 (斜体部分),并添加保护碱基 (粗体部分),上、下游引物序列分别为:SREBP1-S (5¢−3¢):GCGTCGACATGGACGAGCCACCCTTCAACG A; SREBP1-A (5¢−3¢):TTGCGGCCGCCTAGCT GGAGGTCACAGTGGTC。
以泌乳期乳腺组织 cDNA为模板进行SREBP-1基因的克隆。CDS区的PCR扩增体系为:10 μL 2×GC BufferⅠ,0.5 μL dNTPs (10 mmol/L),上下游引物SREBP1-S (10 μmol/L)、SREBP1-A (10 μmol/L) 各1 μL,1 μL (50 ng) cDNA模板,0.2 μL LA Taq DNA聚合酶 (5 U/μL),加入ddH2O至总体积20 μL;反应条件为:95 ℃预变性5 min;94 ℃变性30 s;64 ℃退火30 s;72 ℃延伸3.5 min,35个循环;72 ℃延伸10 min。取反应产物进行琼脂糖凝胶电泳检测,回收纯化后连接pMD19-T载体,并转化E. coli Top10,提取质粒进行酶切鉴定,阳性克隆的质粒送往Invitrogen公司测序。
1.2.2 pAdTrack-CMV-SREBP-1穿梭载体的构建与鉴定
对测序正确的pMD19-T-SREBP-1重组质粒及 pAdTrack-CMV穿梭载体质粒进行 NotⅠ及SalⅠ双酶切,电泳检测并回收,4 ℃连接过夜,转化E. coli Top10,挑取单克隆培养扩繁,取4 mL菌液提取质粒后进行NotⅠ及SalⅠ双酶切鉴定。阳性质粒送往Invitrogen公司测序。
1.2.3 pAd-SREBP-1重组腺病毒载体的构建与鉴定
对酶切鉴定正确的pAdTrack-CMV-SREBP-1质粒进行PemⅠ线性化,回收产物转化含有腺病毒骨架载体pAdEasy-1的E. coli BJ5183感受态细胞。挑取较小菌落培养扩繁,取4 mL菌液提取质粒并进行PacⅠ酶切鉴定,然后用鉴定正确的重组质粒转化E. coli Top10感受态细胞进行扩繁,提取质粒送往Invitrogen公司测序。
1.2.4 pAd-SREBP-1重组腺病毒的包装与扩增
重组质粒用PacⅠ酶切线性化,乙醇沉淀法回收大片段,回收产物转染生长在六孔细胞培养板中汇合度约为80%的HEK 293细胞以进行重组腺病毒的包装。病毒包装过程及收毒方法参照王伟等[8]的具体说明。病毒原液全部接种到HEK 293细胞 (生长汇合度为80%~90%左右),接种后4 h更换新鲜的培养基,待细胞完全病变时 (约2~3 d) 收集病毒,按前述方法收集的病毒液即为第二代病毒悬液。用第二代病毒悬液多次感染HEK 293细胞,大量扩增重组腺病毒。
1.2.5 腺病毒滴度的测定
具体测定方法参考江千里等[9]关于批量快速测定法测定标志基因为 GFP的重组病毒滴度的研究。
1.2.6 腺病毒感染乳腺上皮细胞最佳 MOI (Multiplicity of infection) 值的确定
将乳腺上皮细胞接种于六孔细胞培养板中,待汇合度达到50%左右时,更换新鲜的培养基每孔2 mL,分别加入100、150、200、250 μL的腺病毒液 (每个处理重复3次)。每天更换新鲜培养基,72 h后观察荧光表达情况,绿色荧光表达良好且没有对细胞造成明显病变的量确定为最佳接种量,并计算MOI值。
1.2.7 pAd-SREBP-1腺病毒超表达效果的检测
取生长状态良好的F11代乳腺上皮细胞接种于六孔板中,培养24 h细胞达到40%汇合度后接种腺病毒。试验共设4个处理组:pAd-Control (重组过表达空载体)感染 48 h组、pAd-Control感染 72 h组、pAd-SREBP-1感染 48 h组及pAd-SREBP-1感染72 h组。每个处理设3个重复,在规定时间内收集细胞提取总 RNA,检测浓度及纯度后反转录成 cDNA,将 3个重复的cDNA样品等份混匀后用作 qRT-PCR的模板。SREBP-1及GAPDH基因实时定量引物见表1,PCR反应体系为:SYBR Premix Ex Taq (2×) Mix 10.0 μL,cDNA模板1.0 μL,上、下游引物混合物(10 μmol/L) 1.6 μL,加RNase free H2O补足20 μL体系 (每个处理重复 3次)。反应条件为:95 ℃30 s,95 ℃ 5 s,60 ℃ 30 s,39个循环;添加溶解曲线。2-△△Ct法分析数据,其中△Ct=CtSREBP1−CtGAPDH;△△Ct=△Ct处理−△CtpAd-Control。
1.2.8 SREBP-1基因过表达后对脂肪酸代谢相关基因的影响
利用Primer 5软件设计FASN、SCD、ACC、ATGL、LXRα及PPARγ基因的实时定量PCR引物 (表1)。反应体系、反应条件及数据分析方法同上。
2 结果与分析
2.1 西农萨能羊SREBP-1基因的克隆与鉴定
以泌乳期乳腺组织 cDNA为模板扩增得到山羊CDS区序列3 441 bp (图1),双酶切鉴定后测序结果与GenBank中收录的序列一致。表明成功克隆了西农萨能羊SREBP-1基因CDS区。
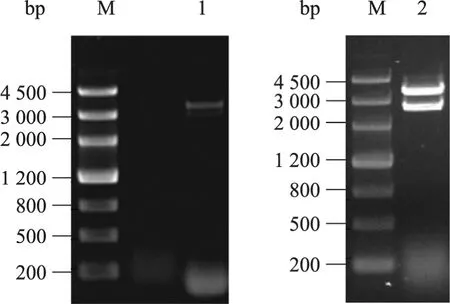
图1 山羊SREBP-1基因的克隆Fig. 1 Cloning of goat SREBP-1 gene. M: marker Ⅲ; 1: amplification product of SREBP-1 CDS region; 2: endonuclease analysis of pMD19-T-SREBP-1 vector.
2.2 pAdTrack-CMV-SREBP-1穿梭载体的构建与鉴定
NotⅠ及SalⅠ双酶切pMD19-T-SREBP-1质粒及pAdTrack-CMV质粒,回收产物连接并转化E. coli Top10感受态细胞,抽提质粒后进行NotⅠ及SalⅠ双酶切 (图2),电泳检测得到约9 000 bp载体条带及3 450 bp目的基因条带,与预期结果一致,表明穿梭载体构建成功。
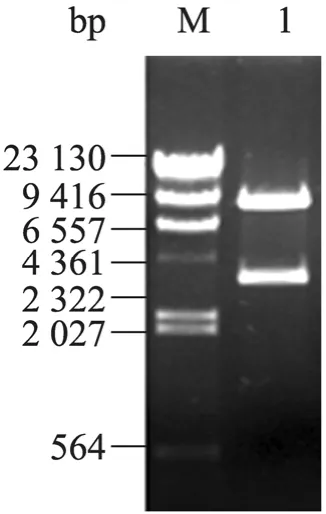
图2 pAdTrack-CMV-SREBP-1载体的构建Fig. 2 Construction of pAdTrack-CMV-SREBP-1 vector. M: λDNA/Hind Ⅲ DNA marker; 1: pAdTrack-CMV-SREBP-1 digested with NotⅠand SalⅠ.
2.3 pAd-SREBP-1重组腺病毒载体的构建与鉴定
使用 PmeⅠ对鉴定正确的 pAdTrack-CMVSREBP-1质粒进行线性化,回收产物转化含有pAdEasy-1的E. coli BJ5183感受态细胞中进行同源重组,挑取较小菌落进行扩繁,重组质粒用PacⅠ酶切鉴定,结果显示:在30 kb及4.5 kb处有两个条带 (图3),表明重组腺病毒载体构建成功。
2.4 腺病毒的包装、扩增及滴度测定
取 5 μg重组腺病毒载体用 PacⅠ酶切线性化,乙醇沉淀法回收大片段,回收产物转染生长在六孔细胞培养板中的汇合度约为80%的HEK 293细胞以包装重组腺病毒。转染后注意更换新鲜培养基,并在转染3 d后观察绿色荧光表达情况,此后应每天跟踪观察腺病毒的包装与增殖过程。转染约10~12 d后,细胞即出现明显的病变反应:变圆呈葡萄球状,并有50%左右的细胞脱壁,此时即可收集第一代腺病毒。病毒上清反复感染HEK 293细胞3次后,获得高滴度的腺病毒 (图4)。采用病毒批量快速测定法测定其滴度为109U/mL。
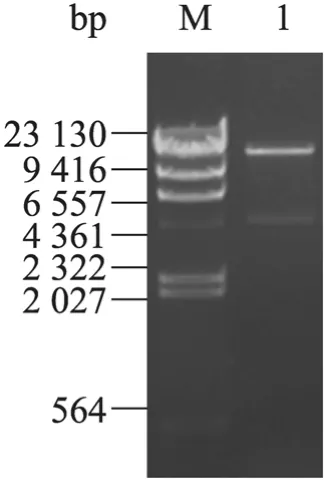
图3 pAd-SREBP-1重组质粒的酶切鉴定Fig. 3 Identification of pAd-SREBP-1 recombinant plasmid by enzyme digestion. M: λDNA/Hind Ⅲ DNA marker; 1: pAd-SREBP-1 digested with PacⅠ.

图4 腺病毒的包装与扩增Fig. 4 Adenovirus package and amplification. (A) GFP expression of HEK 293 cell three days after transfection of pAd-SREBP-1 recombinant adenovirus. (B) GFP expression of HEK 293 cell 8 days after transfection of pAd-SREBP-1 recombinant adenovirus. (C) GFP expression of HEK 293 cell 11 days after transfection of pAd-SREBP-1 recombinant adenovirus. (D) GFP expression of HEK 293 cell 48 h after infection of high titer of recombiant adenovirus.
2.5 腺病毒感染乳腺上皮细胞最佳 MOI (Multiplicity of infection)值的确定
对乳腺上皮细胞接种不同剂量的高滴度腺病毒液,以确定最佳感染复数 (MOI),72 h后置于倒置荧光显微镜下观察,发现最适宜的病毒接种量为100 μL,MOI值为200 (图5)。

图5 接种腺病毒72 h后的乳腺上皮细胞Fig. 5 Goat mammary epithelial cells infected with adenovirus for 72 h.
2.6 乳腺上皮细胞中SREBP-1的超表达效果检测
在规定时间内收集腺病毒感染的乳腺上皮细胞样品,提取RNA并检测浓度及纯度,反转录后用于qRT-PCR,检测SREBP-1基因的超表达效率。定量结果表明:与空载体感染组相比,感染重组腺病毒 72 h组的超表达效果显著优于48 h感染组,感染重组腺病毒的乳腺上皮细胞在48 h后,SREBP-1基因的mRNA表达量升高了约15倍,72 h后靶基因的mRNA表达量显著升高了30倍 (图6)。
2.7 SREBP-1基因超表达后对脂肪酸代谢相关基因的影响
使用2.6中收集的RNA样品进行qRT-PCR检测 SREBP-1基因超表达后对脂肪酸代谢相关基因的影响。由图 7可以看出,接种腺病毒(MOI=200) 72 h后,与空载体感染组相比,FASN及ACC均显著上调了约两倍,PPARγ上调了1.47倍,LXRα及ATGL表达量均升高了1.21倍;但是SCD的mRNA水平无明显变化。
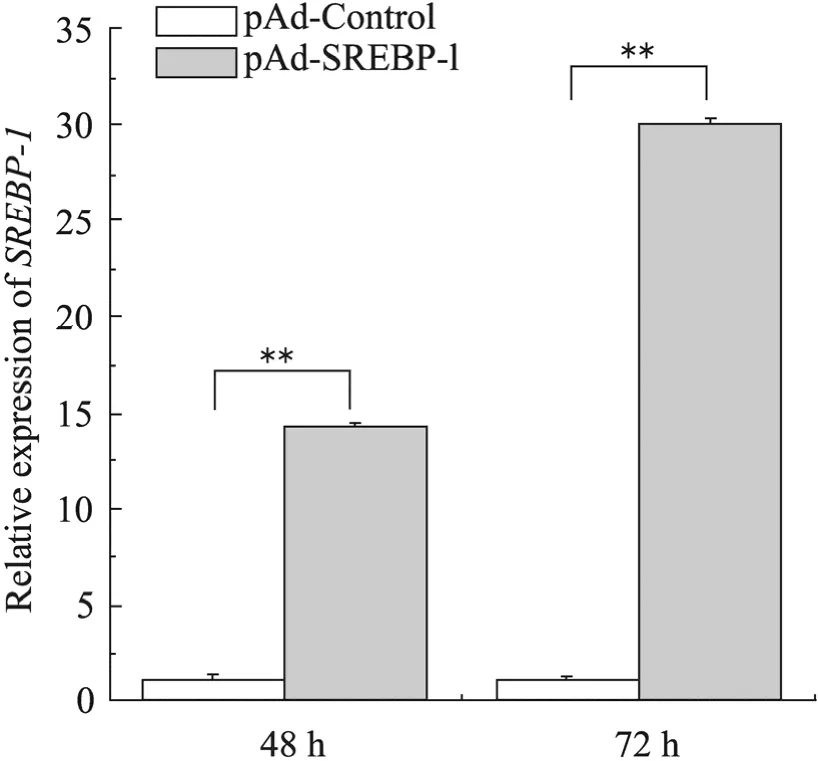
图6 SREBP-1基因在山羊乳腺上皮细胞中的超表达Fig. 6 Over-expression of SREBP-1 gene in goat mammary epithelial cells. n=3; **P<0.01 compared with pAd-Control group.
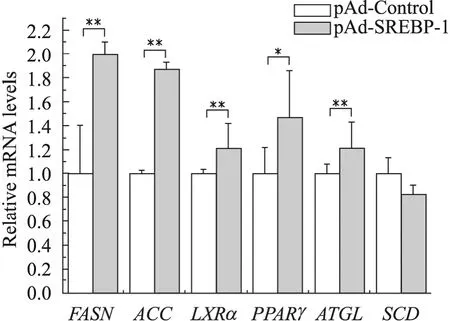
图7 FASN、ACC、LXRα、PPARγ、SCD及ATGL基因实时荧光定量结果分析Fig. 7 qRT-PCR analysis of FASN, ACC, LXR, PPARγ, SCD and ATGL gene. n=3; *P<0.05 compared with pAd-Control group; **P<0.01 compared with pAd-Control group.
3 讨论
使用腺病毒技术研究基因功能的关键是首先要获得高滴度的病毒液。在病毒的包装及扩增过程中,第一代病毒的包装决定了整个腺病毒包装能否成功,细胞的状态、腺病毒基因的转染量及第一次收集病毒的时间均会影响病毒包装的效率。首先,包装第一代腺病毒时所选取的细胞状态一定要好,选择在对数生长期的细胞进行包装,因为第一代腺病毒包装所需时间较长 (7~10 d左右),因此选取的细胞密度不宜过高,一般选取汇合度约70%左右HEK 293细胞即可,接种第二代及第三代病毒的细胞汇合度一般选在80%以上。其次,重组腺病毒质粒经Pac I酶切后释放出腺病毒基因,向HEK 293细胞中转染该腺病毒基因的量应不低于4 μg,否则造成第一次收毒时病毒滴度过低,再次扩增时不易成功。另外,第一次收病毒的时间不宜过早,只要大部分细胞仍处于贴壁状态就应继续在培养箱内培养。收毒过早会使病毒滴度偏低,直接影响后续扩繁,收毒过晚则细胞破裂,也会降低病毒滴度。在本研究中,使用收集的高滴度病毒感染乳腺上皮细胞72 h后,细胞中SREBP-1的mRNA的表达量上升了30倍,超表达效果显著。
SREBPs家族3个成员在机体脂质代谢过程中发挥不同的功能[10],研究表明,SREBP-2基因主要参与调控机体胆固醇合成相关基因的表达,SREBP-1 (主要是 SREBP-1c) 基因主要调控机体脂肪酸、磷脂及甘油三酯的生物合成过程[11]。除了在肝脏、皮下脂肪组织、肾上腺及骨骼肌等组织中具有较高的表达外[12],SREBP-1c在泌乳期奶牛的乳腺组织中的表达量也较高[13]。在奶牛乳腺组织中,SREBP-1基因的表达水平与乳汁中脂肪酸的种类密切相关[14]。Bécard等[15]利用腺病毒技术研究SREBP-1c基因过表达对肝脏中葡萄糖代谢相关基因的影响,结果表明 SREBP-1c在胰岛素调控的葡萄糖代谢过程中发挥重要作用,推测其可能与胰岛素抵抗及葡萄糖代谢紊乱引起的一系列疾病的发病机制密切相关,为此类疾病的治疗提供了新的思路。Sekiya等[16]研究发现,与肝脏组织及细胞不同的是,脂肪细胞中SREBP-1c表达量的上升并未引起生脂基因的变化。乳腺作为一个具有极强分泌功能的器官,不仅含有大量的乳腺上皮细胞,而且含有较多的脂肪组织,因此,乳腺在泌乳期合成脂肪酸的过程较为复杂。Brown和Goldstein[2]研究发现,在大量合成三酰甘油酯 (TAG) 的组织 (如乳腺)中,脂肪酸及胆固醇生物合成过程中的基因均受到 SREBPs基因家族调控。另外,Michael等[7]发现在 SREBP-1基因敲除鼠的乳汁中所含C16∶0脂肪酸的比例显著低于 (下降约 25%)正常组,表明由于SREBP-1基因功能的缺失,导致脂肪酸从头合成途径部分受阻。
脂肪酸的从头合成过程共由 25种酶催化,其中,ACC催化乙酰辅酶A形成丙二酰辅酶A,FASN是催化丙二酰辅酶A形成16碳脂肪酸的关键酶,SCD是催化单不饱和脂肪酸形成的限速酶。研究表明SREBP-1基因可以直接调控这3种酶的活性[17-18],进而调控体内脂肪酸的生物合成过程。Bécard等[15]在研究中发现SREBP-1c超表达后FASN的表达量上升了2.1倍,而在SREBP-1基因敲除鼠中[17],ACC及SCD的mRNA表达量分别下降了约2.5倍及10倍,表明SREBP-1可诱导生脂基因的表达。本研究中腺病毒介导的SREBP-1基因超表达技术,使乳腺上皮细胞中FASN及ACC的表达量上调了2倍,与前人研究结果一致。但是并未引起 SCD基因的表达量发生变化,表明活体水平与细胞水平之间可能存在一定的差异。
LXRα是一种在肝脏组织中高表达的核受体,固醇及其衍生物可激活该基因的表达[19]。研究发现SREBP-1基因启动子上存在LXRα基因的结合位点 (LXRE),LXRα与LXRE结合可直接激活SREBP-1基因的表达,进而调控生脂基因的表达。在 LXRα基因敲除的动物体内,FASN、ACC及SCD基因的基础活性均显著降低[20]。钟瑜等[21]研究发现 LXRα基因的超表达导致SREBP-1基因表达量升高,而PPARγ基因表达量下降,其机制是由于LXRα超表达后,与更多的配体RXR结合后形成异源二聚体,导致PPARγ无法与配体RXR结合,表达受到抑制。SREBP-1基因对LXRα基因有正反馈调节作用,SREBP-1基因的超表达,导致LXRα基因表达量上升了1.2倍,同时也引起 PPARγ基因表达量的上升,但LXRα和PPARγ基因表达间是否存在确定的正相关或负相关关系尚待进一步研究证实。
目前关于ATGL及PPARγ的研究大多与脂解相关[22-23],ATGL主要参与甘油三酯 (TG) 水解过程的第一步,形成甘油二酯 (DG) 和游离脂肪酸[24],DG进一步水解后为机体供能。而PPARγ则通过与 LXRα竞争性的结合配体 RXR[25],使LXRα-SREBP-1通路介导的生脂过程受到抑制,PPARγ活性增强启动脂解过程,为机体供能。使用pAd-SREBP-1病毒液处理乳腺上皮细胞72 h后,导致SREBP-1基因及其靶基因的表达量显著上升,脂肪酸合成过程加速,导致脂肪沉积增加,脂质积累到一定程度后,产物通过反馈途径启动脂解过程[26],ATGL及PPARγ基因上调,以维持机体的代谢平衡。本研究发现 SREBP-1超表达后,引起PPARγ及ATGL表达量分别上调了1.4倍及1.2倍。这一结果说明在乳腺上皮细胞中,SREBP-1基因的超表达可能会引起脂代谢紊乱,具体机制有待进一步研究。
本研究通过构建西农萨能羊 SREBP-1基因的腺病毒超表达载体,成功获得了高滴度的腺病毒 (109U/mL),并且发现在山羊乳腺上皮细胞中,SREBP-1基因的超表达诱导了生脂基因的表达。推测SREBP-1基因在山羊泌乳过程中,尤其是短中链脂肪酸的形成过程中发挥着重要作用,对提高山羊奶的营养价值及脂肪酸代谢调控基因网络的构建均具有重要意义。
REFERENCES
[1] Yokoyama C, Wang XD, Briggs MR, et al. SREBP-1: a basic-helix-loop-helix-leucine zipper protein that controls transcription of the low density lipoprotein receptor gene. Cell, 1993, 75(1): 187−197.
[2] Brown MS, Goldstein JL. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell, 1997, 89(3): 331−340.
[3] Horton JD, Shimomura L. Sterol regulatory element-binding proteins: activators of cholesterol and fatty acid biosynthesis. Curr Opin Lipidol, 1999, 10(2): 143−150.
[4] Edwards PA, Tabor D, Kast HR, et al. Regulation of gene expression by SREBP and SCAP. Biochim Biophys Acta, 2000, 1529(1/3): 103−113.
[5] Stein T, Morris JS, Davies CR, et al. Involution of the mouse mammary gland is associated with an immune cascade and an acute-phase response, involving LBP, CD14 and STAT3. Breast Cancer Res, 2004, 6(2): R75−R91.
[6] Wang Z, Luo J, Wang W, et al. Characterization and culture of isolated primary dairy goat mammary gland epithelial cells. Chin J Biotech, 2010, 26(8): 1123−1127.王桢, 罗军, 王伟, 等. 奶山羊乳腺上皮细胞的分离、培养及鉴定. 生物工程学报, 2010, 26(8): 1123−1127.
[7] Rudolph MC, Monks J, Burns V, et al. Sterol regulatory element binding protein and dietary lipid regulation of fatty acid synthesis in the mammary epithelium. Am J Physiol Endocrinol Metab, 2010, 299(6): E918−E927.
[8] Wang W, Luo J, Zhao WS, et al. Screening of shRNA sequence target Xinong Saanen goat FAS gene and the construction of recombinant adenovirus vector. Acta Agr Boreal-Occident Sin, 2010, 19(3): 6−12.王伟, 罗军, 赵旺生, 等. 西农萨能羊 FAS基因shRNA序列筛选及其腺病毒载体的构建. 西北农业学报, 2010, 19(3): 6−12.
[9] Jiang QL, Wang JM, Wen LM, et al. Establishing a realtime large-scale recombinant virus titering method taking GFP as marker gene. Acad J Sec Mil Med Univ, 2002, 23(9): 1034−1035.江千里, 王健民, 温丽敏, 等. 批量快速测定法测定标志基因为GFP的重组病毒滴度. 第二军医大学学报, 2002, 23(9): 1034−1035.
[10] Osborne TF, Espenshade PJ. Evolutionary conservation and adaptation in the mechanism that regulates SREBP action: what a long, strange trip it’s been. Genes Dev, 2009, 23(22): 2578−2591.
[11] Walker AK, Jacobs RL, Watts JL, et al. A conserved SREBP-1/phosphatidylcholine feedback circuit regulates lipogenesis in metazoans. Cell, 2011, 147(4): 840−852.
[12] Eberlé D, Hegarty B, Bossard P, et al. SREBP transcription factors: master regulators of lipid homeostasis. Biochimie, 2004, 86(11): 839−848.
[13] Angulo J, Hiller B, Albrecht E, et al. Effect of different dietary fats on protein expression of sterol regulatory element-binding protein 1 (SREBP-1) in mammary gland tissue of lactating cows. Lives Sci, 2012, 143(2/3): 300−304.
[14] Rudolph MC, Monks J, Burns V, et al. Sterol regulatory element binding protein and dietary lipid regulation of fatty acid synthesis in the mammary epithelium. Am J Physiol Endocrinol Metab, 2010, 299(6): E918−E927.
[15] Bécard D, Hainault I, Azzout-Marniche D, et al. Adenovirus-mediated overexpression of sterol regulatory element binding protein-1c mimics insulin effects on hepatic gene expression and glucose homeostasis in diabetic mice. Diabetes, 2001, 50(11): 2425−2430.
[16] Sekiya M, Yahagi N, Matsuzaka T, et al. SREBP-1-independent regulation of lipogenic gene expression in adipocytes. J Lipid Res, 2007, 48(7): 1581−1591.
[17] Shimano H. Sterol regulatory element-binding proteins (SREBPs): transcriptional regulators of lipid synthetic genes. Prog Lipid Res, 2001, 40(6): 439−452.
[18] Fleischmann M, Iynedjian PB. Regulation of sterol regulatory-element binding protein 1 gene expression in liver: role of insulin and protein kinase B/cAkt. Biochem J, 2000, 349(Pt1): 13−17.
[19] Repa JJ, Mangelsdorf DJ. The role of orphan nuclear receptors in the regulation of cholesterol homeostasis. Ann Rev Cell Dev Biol, 2000, 16: 459−481.
[20] Repa JJ, Liang GS, Qu JF, et al. Regulation of mouse sterol regulatory element-binding protein-1c gene (SREBP-1c) by oxysterol receptors, LXRα and LXRβ. Genes Dev, 2000, 14(22): 2819−2830.
[21] Zhong Y. RNA interference and overexpression of LXRα gene on fatty acid metabolism in the mammary gland epithelial cell of dairy goat[D]. Shaanxi: Northwest A & F university, 2011.钟瑜. LXRα基因RNA干扰和过表达对奶山羊乳腺上皮细胞脂肪酸代谢的影响[D]. 陕西: 西北农林科技大学, 2011.
[22] Schweiger M, Schreiber R, Haemmerle G, et al. Adipose triglyceride lipase and hormone-sensitive lipase are the major enzymes in adipose tissue triacylglycerol catabolism. J Biol Chem, 2006, 281(52): 40236−40241.
[23] Rosen ED, Sarraf P, Troy AE, et al. PPARγ is required for the differentiation of adipose tissue in vivo and in vitro. Mol Cell, 1999, 4(4): 611−617.
[24] Schoenborn V, Heid IM, Vollmert C, et al. The ATGL gene is associated with free fatty acids, triglycerides, and type 2 diabetes. Diabetes, 2006, 55(5): 1270−1275.
[25] Tobin KAR, Steineger HH, Alberti S, et al. Cross-talk between fatty acid and cholesterol metabolism mediated by liver X receptor-α. Mol Endocrinol, 2000, 14(5): 741−752.
[26] Walker AK, Näär AM. SREBPs: regulators of cholesterol/lipids as therapeutic targets in metabolic disorders, cancers and viral diseases. Clin Lipidol, 2012, 7(1): 27−36.