IL-17与肿瘤的关系①
2012-02-05钱鑫杜娇金阳
钱鑫杜娇金阳
(华中科技大学同济医学院附属协和医院呼吸内科卫生部呼吸疾病重点实验室,武汉430022)
IL-17与肿瘤的关系①
钱鑫杜娇金阳
(华中科技大学同济医学院附属协和医院呼吸内科卫生部呼吸疾病重点实验室,武汉430022)
1863年,R.Virchow基于肿瘤常常发生在慢性炎症部位和炎症细胞往往出现在肿瘤组织中的事实,提出了慢性炎症和肿瘤发生相关的假说[1]。随着近些年来研究的深入,该理论已被广泛接受。肿瘤细胞通过产生各种细胞因子和趋化因子来募集白细胞(包括中性粒细胞、树突状细胞、巨噬细胞、嗜酸性粒细胞、嗜碱性粒细胞和淋巴细胞),这些白细胞通过产生一系列的细胞因子和炎症介质参与肿瘤免疫[1]。
白介素17(Interleukin-17,IL-17)是一种具有多种生物学效应的细胞因子,主要由Th17细胞产生,可以诱导产生多种细胞因子、趋化因子、炎症效应物质和抗微生物蛋白,从而参与多种自身免疫性疾病和感染炎症[2]。近些年来,发现IL-17与肿瘤的关系密切。由于存在正反两方面的研究证据,其在肿瘤发生发展中的确切作用仍不十分明确,一方面IL-17可以通过诱导肿瘤的血管生成等来发挥促瘤效应;另一方面它又可以通过增强NK细胞、细胞毒性T细胞(Cytotoxic T lymphocytes,CTLs)的活性来发挥抗肿瘤效应。因此,本文就IL-17在肿瘤中所发挥的作用作一综述。
1 IL-17/IL-17R的结构及分布
IL-17起初被称为细胞毒性T细胞抗原8(Cytotoxic T lymphocytes antigen 8,CTLA-8),最先是从鼠T细胞杂交瘤细胞中分离而来[3]。随后编码人IL-17(hIL-17)的cDNA从CD4+T细胞库中克隆出来,它预测的一级结构中含155个氨基酸序列,其中包含1个N端的信号肽,其结构与嗜T细胞疱疹病毒开放阅读框13(HVS13)所编码的氨基酸序列有72%的一致性,和鼠 CTLA-8有63%的一致性[4]。根据目前的研究,IL-17家族包括6个成员,分别是IL-17A(CTLA-8)、IL-17B、IL-17C、IL-17D、IL-17E (IL-25)和 IL-17F[5]。体内 IL-17 的来源很局限,最先被认为是由Th17细胞分泌,一种不同于Th1、Th2的CD4+T细胞[6]。之后研究发现参与固有免疫的细胞如巨噬细胞、树突状细胞(DC细胞)、自然杀伤T 细胞(NK T 细胞)、γδT 细胞也可以产生IL-17[7];除了固有免疫细胞,CD8+T细胞也能分泌IL-17[5]。目前越来越多的证据表明,在肿瘤组织中γδT细胞才是 IL-17 最主要的来源[8,9]。
与IL-17一样,人IL-17受体(IL-17R)序列与小鼠IL-17受体有69%的相似性,而与目前已知细胞因子受体家族丝毫没有同源性[10]。IL-17R家族包括5个成员(IL-17RA~IL-17RF)[5]。与 IL-17表达局限不同,IL-17R广泛表达于正常组织细胞和肿瘤细胞等[10,11]。
IL-17受体与其它同源细胞因子受体一样为多聚体复合物,虽然确切的结构尚未明了,但是目前研究发现,IL-17至少与两个IL-17RA和一个IL-17RC组成的受体复合物相结合才能发挥生物学功能[5]。
2 IL-17的促瘤效应
目前多项临床研究显示,在胃癌、成神经管细胞瘤、卵巢癌、结肠癌、肺癌、乳腺癌、蕈样真菌病和SEZARY综合征等患者外周血或肿瘤组织中可检测出IL-17或IL-17mRNA水平增高[12-18],且其水平与肿瘤的恶性程度相关,但其促进肿瘤发生的机制尚未明确。可能通过以下途径来发挥作用。
2.1 抑制肿瘤细胞凋亡和促进肿瘤细胞增殖 一部分研究认为IL-17可以通过抑制肿瘤细胞凋亡和促进肿瘤细胞增殖来发挥促瘤效应。Nam等[19]发现,在体外IL-17可以抑制多种肿瘤细胞凋亡;将IL-17R敲除的乳腺癌细胞植入小鼠后,观察到肿瘤细胞凋亡增加。He等[20]也报道,在 IL-17R缺陷(IL-17R-/-)小鼠中肿瘤细胞凋亡的数目明显增多,同时抗增殖细胞核抗原抗体染色显示肿瘤细胞增殖明显减少。除基因敲除小鼠外,在裸鼠中也观察到类似的效应,在接种了含IL-17cDNA-Sq-19和IL-17cDNA-A549的肿瘤组织中观察到肿瘤细胞凋亡分别减少了34%和47%[21]。但也有研究认为IL-17对肿瘤细胞周期及凋亡没有影响[22]。
2.2 干扰肿瘤免疫 除了抑制肿瘤细胞凋亡途径外,IL-17还可以通过抑制特异性免疫应答来发挥促瘤效应。Wang等[23]将黑色素瘤、膀胱癌细胞接种于IL-17基因敲除小鼠(IL-17-/-小鼠),与野生鼠相比,肿瘤生长速率降低,肿瘤组织中浸润的CD8+T细胞增多,而且在IL-17-/-小鼠和IL-17-/-IFN-γ-/-小鼠中肿瘤肺部转移的数量也明显减少,表明IL-17可能通过抑制机体特异性免疫应答从而促进肿瘤生长,而且这种促肿瘤生长的效应可以部分抵消IFN-γ的抑制肿瘤作用。此外在IL-17R-/-小鼠、IL-17R-/-IFN-γR-/-小鼠中也观察到肿瘤生长缓慢,肿瘤组织内CD8+T细胞浸润增多,脾脏、外周血和肿瘤组织内骨髓源性抑制细胞(Myeloid derived suppressor cell,MDSC)细胞的数量明显减少[20];另一方面直接给予IL-17可以观察到肿瘤组织中CD8+T细胞浸润减少,MDSC细胞增多[20],故IL-17可能通过抑制CD8+T细胞的浸润,诱导MDSC聚集从而促进肿瘤的生长和抑制肿瘤免疫反应。
IL-17还可以通过扰乱正常的免疫系统功能导致肿瘤发生。研究发现将APC基因突变的(Apc-Min/+)小鼠敲除IL-17A基因后,其肠道肿瘤发生的数目明显减少,肿瘤组织中促炎介质和炎症因子明显减少,肿瘤组织中淋巴细胞的浸润减少(CD4+T细胞过度增殖与肠道肿瘤发生相关),CD4+T细胞和Treg细胞功能恢复正常化,免疫异常(脾肿大和胸腺萎缩)状态得到改善[24]。但也有实验指出IL-17对免疫系统功能无影响。Wakita等[9]发现IL-17-/-小鼠种植瘤组织内CD4+、CD8+、γδT细胞数量和比率未见明显变化,表明IL-17可能不是通过破坏正常的免疫系统而促进肿瘤生长。这和之前Wang[23]在 IL-17-/-小鼠中观察的结论相反,其原因或许是由于细胞株不同生物学效应也不同所造成,之前Wang使用的是黑色素瘤、膀胱癌细胞,而Wakita使用的是纤维肉瘤细胞。由此可见IL-17对机体抗肿瘤免疫作用具有组织器官特异性。
2.3 促进肿瘤血管生成 体外研究发现外源性IL-17 对肿瘤细胞增殖没有直接的作用[18,21,22,25-28],但是体内研究结果恰好相反,且可能与促进血管生成有关。在体内试验中,小鼠接种含编码IL-17cDNA的肿瘤细胞,其肿瘤生长迅速,肿瘤体积明显增大[21,25-27]。新生血管对于所有实体肿瘤生长、维持和转移是必需的[29]。因此推测IL-17是否通过促进血管生成来发挥促肿瘤作用。Takeshi Kato等[14]在17份卵巢癌肿瘤组织检测到11份标本表达IL-17mRNA(64.7%),而正常卵巢组织未检测到 IL-17mRNA,且IL-17阳性的肿瘤组织微血管密度明显比IL-17阴性标本大。在动物实验中,接种含IL-17cDNA的重组肿瘤细胞的肿瘤组织中可以发现血管密度明显增多,与临床观察结果一致[21-25]。而肿瘤血管密度增高是血管生成活化的显著表现[29],从而证实IL-17可以通过促进血管生成来发挥促瘤作用。
IL-17这种促血管生成的作用可能是通过促进血管内皮生长因子(Vascular endothelial growth factor,VEGF)表达来实现的。Numasaki等[25]发现,IL-17促进肿瘤血管生成的机理不仅通过促进血管内皮迁徙和血管索的形成,而且还通过促进成纤维细胞或者肿瘤组织产生一系列促血管生成因子(包括VEGF)来打破其和血管生成抑制因子的平衡。在体外实验中可以观察到IL-17促进纤维肉瘤细胞、结肠癌细胞、骨肉瘤细胞分泌 VEGF[9,15,30]。在肿瘤组织中也同样观察到IL-17与VEGF有关。Liu等发现结肠癌组织中IL-17水平与VEGF表达正相关[15]。此外VEGF除了促进血管生成外,还可以通过抑制树突状细胞(DC)和多种造血细胞系的分化成熟和T细胞成熟来抑制免疫系统的功能,从而造成肿瘤免疫逃逸[31-33],因此 IL-17尚可通过 VEGF间接发挥促进肿瘤免疫逃逸功能。
除了通过促进VEGF生成途径外,也有研究发现IL-17可以通过其他血管生成因子发挥作用。IL-17刺激非小细胞肺癌细胞选择性上调血管生成因子 CXCL1、CXCL5、CXCL2和 CXCL8(IL-8)的表达,从而促进肿瘤生长,同时抗CXCR2抗体可以消除绝大部分IL-17所导致的促NSCLC生长作用[21]。类似的是,IL-17-/-小鼠其肿瘤组织血管密度明显减少,且IL-17明显促进肿瘤细胞Ang-2和 VEGF转录,进一步说明IL-17可以通过产生血管生成因子来促进肿瘤血管生成,从而导致肿瘤生长[9]。
2.4 促进肿瘤转移和浸润 Chen等[16]发现IL-17表达与NSCLC预后不良和淋巴管生成有关。其机制与其促进非小细胞肺癌细胞表达血管内皮生长因子C(VEGF-C)有关,而VEGF-C可以增强淋巴管内皮细胞(LEC)的趋化性和促使内皮索状构造形成[34]。在蕈样真菌病、乳腺癌、垂体瘤起始阶段未检测到IL-17表达或者低表达,而在其进展阶段则可以检测到 IL-17 表达明显增高[17、18、35]。这种作用可能是通过促进肿瘤细胞表达MMP-2、MMP-9所致。在垂体瘤患者肿瘤组织中,肿瘤浸润组IL-17、IL-17R、MMP-9水平明显比非浸润组高,且在浸润组 MMP-9 水平与 IL-17、IL-17R 水平正相关[35],与之前动物实验结果相吻合[26]。在肝癌中,IL-17通过激活NF-κB途径上调肝癌细胞MMP-2和MMP-9表达从而促进肿瘤细胞浸润和转移[36],且IL-17介导的肿瘤浸润作用可以被MMP-2、MMP-3和MMP-9非特异性拮抗剂所抑制[17]。IL-17除了通过MMPs途径外,还可以通过ICAM-1途径。IL-17可以促进多种组织细胞表达 ICAM-1,包括肿瘤细胞[14,25]。虽然 ICAM-1 与 LFA-1 结合参与 T-T 细胞、T细胞-基质细胞、效应细胞与靶细胞间相互作用、NK细胞的活化、中性粒细胞的募集、抗原提呈有关,但有研究发现ICAM-1与肿瘤浸润和转移有关[37,38]。
2.5 通过细胞因子途径发挥促瘤作用 IL-17除了促血管生成外,还可以诱导其它细胞因子的产生来发挥间接作用。IL-17可以诱导肿瘤细胞及肿瘤微环境中的成纤维细胞、内皮细胞、DC细胞等释放IL-6从而活化肿瘤细胞Stat3途径,抑制肿瘤细胞凋亡,促进肿瘤细胞增殖,增强血管生成来发挥促肿瘤效应[23]。在裸鼠中,皮下接种含hIL-17cDNA的宫颈癌细胞株,其肿瘤生长明显比对照组迅速,其促肿瘤作用可能与IL-17促进肿瘤细胞表达IL-6和募集巨噬细胞至肿瘤组织有关,而IL-6和巨噬细胞可以促进多种肿瘤细胞生长[26]。
3 IL-17的抑瘤效应
Chen等[39]在192份胃腺癌标本中检测到174份表达IL-17(90.6%),且Kaplan-Meier生存分析显示IL-17高表达的患者五年生存率明显高于IL-17
低表达的患者,提示IL-17可能作为一个保护性因素抑制肿瘤的生长。在卵巢癌、食管癌研究中也发现相同的结果[40,41]。而其具体机制尚未被阐述清楚。其抑瘤效应可能通过以下途径:
3.1 通过 CD4+、CD8+T细胞发挥抗肿瘤免疫 有直接证据表明IL-17通过机体免疫系统发挥抗肿瘤效应。将含IL-17cDNA的肿瘤细胞接种于裸鼠中,肿瘤生长与对照组无明显差异[27,42]。但将其接种于正常小鼠后发现肿瘤生长受到抑制,且使用抗CD4/CD8单克隆抗体后,肿瘤继续生长,提示IL-17可以通过 CD4+、CD8+T细胞发挥肿瘤抑制作用[27]。在结肠癌中也观察到相似的现象。Kryczek等[22]将结肠癌细胞株MC38接种于IL-17-/-小鼠,与野生小鼠相比,肿瘤体积增长速度加快,肺内有更多的转移灶;同时肿瘤组织IFN-γ+T细胞和肿瘤引流淋巴结 IFN-γ+CD4+、IFN-γ+CD8+细胞数均较野生鼠少,间接表明IL-17通过募集T淋巴细胞浸润发挥肿瘤免疫抑制作用。
3.2 增强NK细胞的活性 IL-17可以通过募集NK细胞浸润,增强NK细胞活性发挥部分抗肿瘤作用。Hirahara[27]等发现,转染了 IL-17cDNA 的肿瘤组织中NK细胞数量明显增多,且NK细胞活性抑制剂可减弱小鼠的抗肿瘤免疫,使肿瘤数量稍增多。而且,IL-17还可以通过增强NK细胞活性明显减少肿瘤肺转移[42]。这种效应可能是IL-17通过促进肿瘤细胞表达粘附分子从而增强NK细胞杀伤细胞活性[43]。
3.3 促进CTLs活化和产生 有报道显示IL-17可以通过增强特异性的CTLs活性来抑制血液系统肿瘤如肥大细胞瘤和浆细胞瘤的生长,有意思的是IL-17并不直接影响CTLs的活性,也不促进CTLs表达效应分子,如穿孔素和Fas-L,推测可能是IL-17通过促进其他细胞因子的产生来发挥这种效应[28]。有多种机制可以解释IL-17促进CTLs的产生和活化。IL-17 可以促进多种细胞产生 IL-6[23-26,44],而 IL-6可以诱导CTLs的产生[28]。此外IL-17还可以刺激巨噬细胞产生 IL-12[44],而IL-12不仅可以诱导CTLs的产生而且还可以增强其杀伤活性[45,46]。CTLs表面TCR通过特异性识别靶细胞上的pMHCⅠ类、pMHCⅡ类分子复合物来发挥杀伤细胞效应,因此pMHC复合物形成对CTLs发挥作用至关重要。转染IL-17基因纤维肉瘤细胞(Meth-A)通过强有力的表达MHCⅠ和MHCⅡ类分子从而诱导特异性的抗肿瘤免疫[27]。
3.4 促进中性粒细胞浸润 此外IL-17作为一种强有力的细胞因子可以募集和促进中性粒细胞产生,而中性粒细胞浸润在抗肿瘤效益中发挥重要作用[47]。Hirahara[27]等在转染了IL-17cDNA的肿瘤组织中发现中性粒细胞浸润明显。而IL-17诱导的中性粒细胞浸润在卡介苗治疗膀胱癌中发挥关键作用[8]。
3.5 抑制肿瘤细胞浸润 此外,肿瘤微环境中的IL-17还可能发挥抑制肿瘤浸润的作用。在食管癌中,IL-17水平与肿瘤浸润深度成反比[41]。转染hIL-17基因的中国仓鼠卵巢癌细胞其侵袭性明显减弱,肺脏转移能力明显降低[42]。
4 小结和展望
肿瘤细胞微环境产生的多种细胞因子在肿瘤致病机制中发挥着重要作用,IL-17一方面可以通过促进肿瘤细胞增殖,抑制细胞凋亡,分泌血管生成因子促血管生成,表达MMP-2和MMP-9促进肿瘤细胞浸润和转移,分泌IL-6等细胞因子,抑制CD4+T、CD8+T细胞在肿瘤组织中浸润,抑制IFN-γ的功能等发挥促肿瘤生成的作用;另一方面通过募集中性粒细胞、NK细胞、CD4+T、CD8+T细胞至肿瘤组织中,增强NK细胞活性,促进CTL细胞活化和产生等发挥抑瘤效应。
由于一些关于IL-17对肿瘤细胞的作用来源于细胞株的体外实验,而细胞株的不同导致所获结果也不尽相同。此外细胞株不能代表肿瘤细胞。为此,分析这些结果必须考虑这些因素,如结肠癌细胞株中,IL-17可以促进SW480、HCT 116、HT-29、Lo-Vo和LS174T表达VEGF,却对MC38表达VEGF无影响[15,25]。此外对于同一肿瘤其研究方法不同,所取得的 研 究 结果 也 大 不相 同,如 卵巢 癌[14、40](表1)。
机体是个复杂的网络系统,各种细胞、细胞因子、趋化因子等交织在一起,相互作用、相互制约发挥着各种各样的功能。IL-17通过产生IL-6等细胞因子抑制肿瘤细胞凋亡和促进血管生成;另外一方面通过诱导CTLs的产生发挥抑制肿瘤作用。其促进肿瘤或者抑制肿瘤依靠肿瘤微环境中的其他细胞及细胞因子。因此在未来的研究中我们尚需进一步研究肿瘤微环境中IL-17同各种细胞因子、趋化因子在肿瘤发生中的协同作用,进一步研究机体内IL-17来源不同是否对肿瘤的效益也不同,IL-17是否在肿瘤发生的各个阶段中发挥不同作用等等,从而为未来肿瘤定向靶向治疗提供充足的依据。
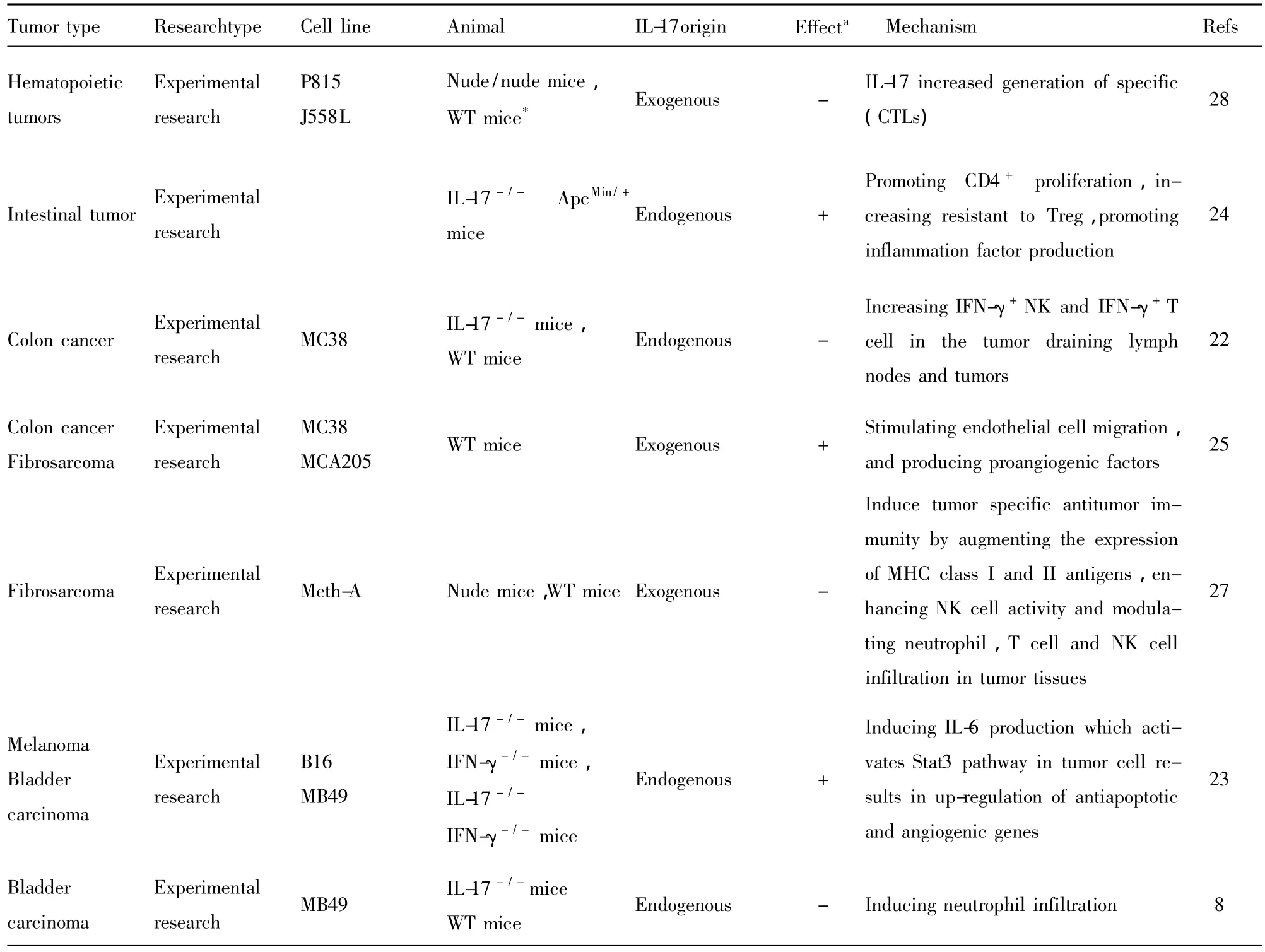
表1 IL-17与肿瘤关系表Tab.1 The effect of IL-17 on tumor

(续表1)
1 Coussens L M,Werb Z.Inflammation and cancer[J].Nature,2002; 420(6917):860-867.
2 Onishi R M,Gaffen S L.Interleukin-17 and its target genes:mechanisms of interleukin-17 function in disease[J].Immunology,2010; 129(3):311-321.
3 Rouvier E,Luciani M F,Mattéi M G et al.CTLA-8,cloned from an activated T cell,bearing AU-rich messenger RNA instability sequences,and homologous to a herpesvirus saimiri gene[J].J Immunol,1993;150(12):5445-5556.
4 Yao Z,Painter S L,Fanslow W C et al.Human IL-17:a novel cytokine derived from T cells[J].J Immunol,1995;155(12):5483-5486.
5 Gaffen S L.An overview of IL-17 function and signaling[J].Cytokine,2008;43(3):402-407.
6 Fossiez F,Djossou O,Chomarat P et al.T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines[J].J Exp Med,1996;183(6):2593-2603.
7 Korn T,Bettelli E,Oukka M et al.IL-17 and Th17 cells[J].Annu Rev Immunol,2009;27:485-517.
8 Takeuchi A,Dejima T,Yamada H et al.IL-17 production by γδ T cells is important for the antitumor effect of Mycobacterium bovis bacillus Calmette-Guerin treatment against bladder cancer[J].Eur J Immunol,2011;41(1):246-251.
9 Wakita D,Sumida K,Iwakura Y et al.Tumor-infiltrating IL-17-producing γδT cells support the progression of tumor by promoting angiogenesis[J].Eur J Immunol,2010;40(7):1927-1937.
10 Yao Z,Spriggs M K,Derry J M et al.Molecular characterization of the human interleukin(IL)-17 receptor[J].Cytokine,1997;9 (11):794-800.
11 Haudenschild D,Moseley T,Rose L et al.Soluble and transmembrane isoforms of novel interleukin-17 receptor-like protein by RNA splicing and expression in prostate cancer[J].J Biol Chem,2002; 277(6):4309-4316.
12 Zhang B,Rong G,Wei H et al.The prevalence of Th17 cells in patients with gastric cancer[J].Biochem Biophys Res Commun,2008;374(3):533-537.
13 Zhou P,Sha H,Zhu J.The role of T-helper 17(Th17)cells in patients with medulloblastoma[J].J Int Med Res,2010;38(2):611-699.
14 Kato T,Furumoto H,Ogura T et al.Expression of IL-17 mRNA in ovarian cancer[J].Biochem Biophys Res Commun,2001;282(3): 735-738.
15 Liu J,Duan Y,Cheng X et al.IL-17 is associated with poor prognosis and promotes angiogenesis via stimulating VEGF production of cancer cells in colorectal carcinoma[J].Biochem Biophys Res Commun,2011;407(2):348-354.
16 Chen X,Wan J,Liu J et al.Increased IL-17-producing cells correlate with poor survival and lymphangiogenesis in NSCLC patients[J].Lung Cancer,2010;9(3):348-354.
17 Zhu X,Mulcahy L A,Mohammed R A et al.IL-17 expression by breast-cancer-associated macrophages:IL-17 promotes invasiveness of breast cancer cell lines[J].Breast Cancer Res,2008;10(6): R95.
18 Cirée A,Michel L,Camilleri-Bröet S et al.Expression and activity of IL-17 in cutaneous T-cell lymphomas(mycosis fungoides and Sezary syndrome)[J].Int J Cancer,2004;112(1):113-120.
19 Nam J S,Terabe M,Kang M J et al.TGF-β subverts the immune system into directly promoting tumor growth through IL-17 [J].Cancer Res,2008;68(10):3915-3923.
20 He D,Li H,Yusuf N et al.IL-17 promotes tumor development through the induction of tumor promoting microenvironments at tumor sites and myeloid-derived suppressor cells[J].J Immunol,2010; 184(5):2281-2288.
21 Numasaki M,Watanabe M,Suzuki T et al.IL-17 enhances the net angiogenic activity and in vivo growth of human non-small cell lung cancer in SCID mice through promoting CXCR-2-dependent angiogenesis[J].J Immunol,2005;175(9):6177-6189.
22 Kryczek I,Wei S,Szeliga W et al.Endogenous IL-17 contributes to reduced tumor growth and metastasis[J].Blood,2009;114(2): 357-359.
23 Wang L,Yi T,Kortylewski M et al.IL-17 can promote tumor growth through an IL-6-Stat3 signaling pathway[J].J Exp Med,2009;206 (7):1457-1464.
24 Chae W J,Gibson T F,Zelterman D et al.Ablation of IL-17A abrogates progression of spontaneous intestinal tumorigenesis[J].Proc Natl Acad Sci USA,2010;107(12):5540-5544.
25 Numasaki M,Fukushi J,Ono M et al.Interleukin-17 promotes angiogenesis and tumor growth[J].Blood,2003;101(7):2620-2627.
26 Tartour E,Fossiez F,Joyeux I et al.Interleukin 17,a T-cell-derived cytokine,promotes tumorigenicity of human cervical tumors in nude mice[J].Cancer Res,1999;59(15):3698-3704.
27 Hirahara N,Nio Y,Sasaki S et al.Inoculation of human interleukin-17 gene-transfected Meth-A fibrosarcoma cells induces T cell-dependent tumor-specific immunity in mice[J].Oncology,2001;61 (1):79-89.
28 Benchetrit F,Ciree A,Vives V et al.Interleukin-17 inhibits tumor cell growth by means of a T-cell-dependent mechanism [J].Blood,2002;99(6):2114-2121.
29 Cavallaro U,Christofori G.Molecular mechanisms of tumor angiogenesis and tumor progression [J].J Neurooncol,2000;50(1-2): 63-70.
30 Honorati M C,Cattini L,Facchini A.Possible prognostic role of IL-17R in osteosarcoma[J].J Cancer Res Clin Oncol,2007;133(12): 1017-1021.
31 Gabrilovich D,Ishida T,Oyama T et al.Vascular endothelial growth factor inhibits the development of dendritic cells and dramatically affects the differentiation of multiple hematopoietic lineages in vivo[J].Blood,1998;92(11):4150-4166.
32 Oyama T,Ran S,Ishida T et al.Vascular endothelial growth factor affects dendritic cell maturation through the inhibition of nuclear factor-kappa B activation in hemopoietic progenitor cells[J].J Immunol,1998;160(3):1224-1232.
33 Ohm J E,Gabrilovich D I,Sempowski G D et al.VEGF inhibits T-cell development and may contribute to tumor-induced immune suppression[J].Blood,2003;101(12):4878-4886.
34 Chen X,Xie Q,Cheng X et al.Role of interleukin-17 in lymphangiogenesis in non-small-cell lung cancer:Enhanced production of vascular endothelial growth factor C in non-small-cell lung carcinoma cells[J].Cancer Sci,2010;101(11):2384-2390.
35 Qiu L,He D,Fan X et al.The expression of interleukin(IL)-17 and IL-17 receptor and MMP-9 in human pituitary adenomas[J].Pituitary,2011;14(3):266-275.
36 Li J,Lau G K,Chen L et al.Interleukin 17A promotes hepatocellular carcinoma metastasis via NF-κB induced matrix metalloproteinases 2 and 9 expression[J].PLoS One,2011;6(7):e21816.
37 Rosette C,Roth R B,Oeth P et al.Role of ICAM1 in invasion of human breast cancer cells[J].Carcinogenesis,2005;26(5):943-950.
38 Roland C L,Harken A H,Sarr M G et al.ICAM-1 expression determines malignant potential of cancer[J].Surgery,2007;141(6): 705-707.
39 Chen J G,Xia J C,Liang X T et al.Intratumoral expression of IL-17 and its prognostic role in gastric adenocarcinoma patients[J].Int J Biol Sci,2011;7(1):53-60.
40 Kryczek I,Banerjee M,Cheng P et al.Phenotype,distribution,generation,and functional and clinical relevance of Th17 cells in the human tumor environments[J].Blood,2009;114(6):1141-1149.
41 Lv L,Pan K,Li X D et al.The accumulation and prognosis value of tumor infiltrating IL-17 producing cells in esophageal squamous cell carcinoma[J].PLoS One,2011;6(3):e18219.
42 Hirahara N,Nio Y,Sasaki S et al.Reduced invasiveness and metastasis of Chinese hamster ovary cells transfected with human interleukin-17 gene[J].Anticancer Res,2000;20(5A):3137-3142.
43 Honorati M C,Neri S,Cattini L et al.IL-17 enhances the susceptibility of U-2 OS osteosarcoma cells to NK cell lysis[J].Clin Exp Immunol,2003;133(3):344-349.
44 Jovanovic D V,Di Battista J A,Martel-Pelletier J et al.IL-17 Stimulates the production and expression of proinflammatory cytokines,IL-β and TNF-α,by human macrophages[J].J Immunol,1998;160(7): 3513-3521.
45 Trinchieri G.Interleukin-12 and the regulation of innate resistance and adaptive immunity [J].Nat Rev Immunol,2003;3(2):133-146.
46 Markiewicz M A,Wise E L,Buchwald Z S et al.IL-12 enhances CTL synapse formation and induces self-reactivity[J].J Immunol,2009; 182(3):1351-1361.
47 Katano M,Torisu M.Neutrophil-mediated tumor cell destruction in cancer ascites[J].Cancer,1982;50(1):62-68.
48 Glenn D.Cytokins in cancer pathogenesis and cancer therapy[J].Nat Rev Cancer,2004;4(1):11-22.
49 Lewis C E,Leek R,Harris A et al.Cytokine regulation of angiogenesis in breast cancer:the role of tumor-associated macrophages[J].J leukoc Biol,1995;57(5):747-751.
[收稿2011-11-10 修回2011-12-22]
(编辑 张晓舟)
R392.12
A
1000-484X(2012)08-0760-07
10.3969/j.issn.1000-484X.2012.08.021①本文为国家自然科学基金资助项目(81072400)和武汉市科技计划资助项目(20116103834001)
钱 鑫(1987年-),男,在读硕士,主要从事肺癌发生机制的研究,E-mail:moneystarnihao@163.com;
及指导教师:金 阳(1970年-),男,主任医师,副教授,硕士生导师,主要从事肺癌发生机制的研究,E-mail:whuhjy@sina.com。
